血清sclerostin水平与维持性血液透析患者血管钙化的关系
段朝阳,姚智会,刘晓唤,郑 阳,韩 锦,张春艳,张 岩,胡艳超,王聪霞
(西安交通大学第二附属医院:1. 肾病科;2. 心血管内科,陕西西安 710004)
慢性肾衰竭(chronic renal failure, CRF)患者的血管钙化(vascular calcification, VC)发生率显著高于一般人群[1-2]。除传统危险因素(如年龄、糖尿病、高血压、高脂血症、吸烟、饮酒和心血管疾病家族史等)外,非传统因素(如高甲状旁腺激素、高磷血症、成纤维细胞生长因子-23异常、贫血和内毒素血症等)也是CRF患者易发生血管钙化的原因[3-5]。此外,研究表明Wnt信号通路在血管钙化中发挥作用[6],sclerostin是Wnt信号通路的抑制因子[7],其在血管钙化中的作用还不明确。周华等[8]研究表明慢性肾脏病5期患者体内高sclerostin水平与桡动脉钙化呈正相关;LV等[9]研究表明sclerostin在进展期CRF患者体内显著增高,与血管钙化程度正相关;而YANG等[10]研究则表明:CRF透析患者体内sclerostin水平下降,它与主动脉钙化负相关。以上文献回顾表明:sclerostin水平与CRF患者血管钙化关系的研究结论不一致。基于此本研究欲探讨血清sclerostin水平与我院透析患者VC的关系。
1 对象与方法
1.1研究对象选取2017年3月至5月于西安交通大学第二附属医院血液透析室行维持性血液透析的患者。本研究遵循的程序符合伦理要求,获得参与者的知情同意。纳入标准:①年龄 18~80岁;②门诊或住院的CRF维持性血液透析患者(规律透析≥3个月)。排除标准 :①精神病患者。②近1月内使用激素或免疫抑制剂。③近1月内手术或外伤。④近1月内发生急性心脑血管事件,如急性冠脉综合征、急性期脑出血、动脉夹层等。⑤患其他严重疾病,如恶性肿瘤、严重心力衰竭和恶病质等。8例患者因严重心衰、严重肺部感染和恶性肿瘤排除,36例患者因无胸部CT检查结果而剔除,最终研究共纳入94例。
1.2研究方法收集患者临床资料①一般情况:年龄、性别、高血压、糖尿病、吸烟和饮酒史;②生化检查:血钙、血磷、全段甲状旁腺激素、血肌酐、尿素氮、总胆固醇、三酰甘油、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、血红蛋白和白蛋白(以上数据来源于我院检验科);③胸部CT:是否钙化(包括主动脉和冠状动脉)由同一位医师判断并分成钙化组和非钙化组;④血清sclerostin水平:选用上海源叶人sclerostin试剂盒利用酶联免疫法测定。
1.3统计学方法采用SPSS 20.0进行统计分析。计量资料符合正态分布采用均数±标准差表示,不符合正态分布采用中位数(四分位数间距)表示。正态分布资料两组间比较采用两独立样本t检验,非正态分布采用非参数检验。计数资料率的比较采用卡方检验。采用单因素和多因素Logistic回归分析临床数据与VC的相关性。P<0.05为差异有统计学意义。
2 结 果
2.1两组患者一般资料与生化指标的比较钙化组与非钙化组在性别、吸烟、饮酒和高血压方面无统计学差异(P>0.05);钙化组年龄和糖尿病患病率高于非钙化组(P<0.01)。钙化组与非钙化组在血红蛋白、白蛋白、低密度脂蛋白胆固醇、胆固醇、甘油三酯、高密度脂蛋白胆固醇、血磷、血肌酐和尿素氮水平无明显差异(P>0.05);钙化组血钙和甲状旁腺激素水平显著高于非钙化组(P<0.01,表1)。
表1钙化组与非钙化组患者一般资料与生化指标的比较
Tab.1 Comparison of clinical data between calcification and non-calcification groups
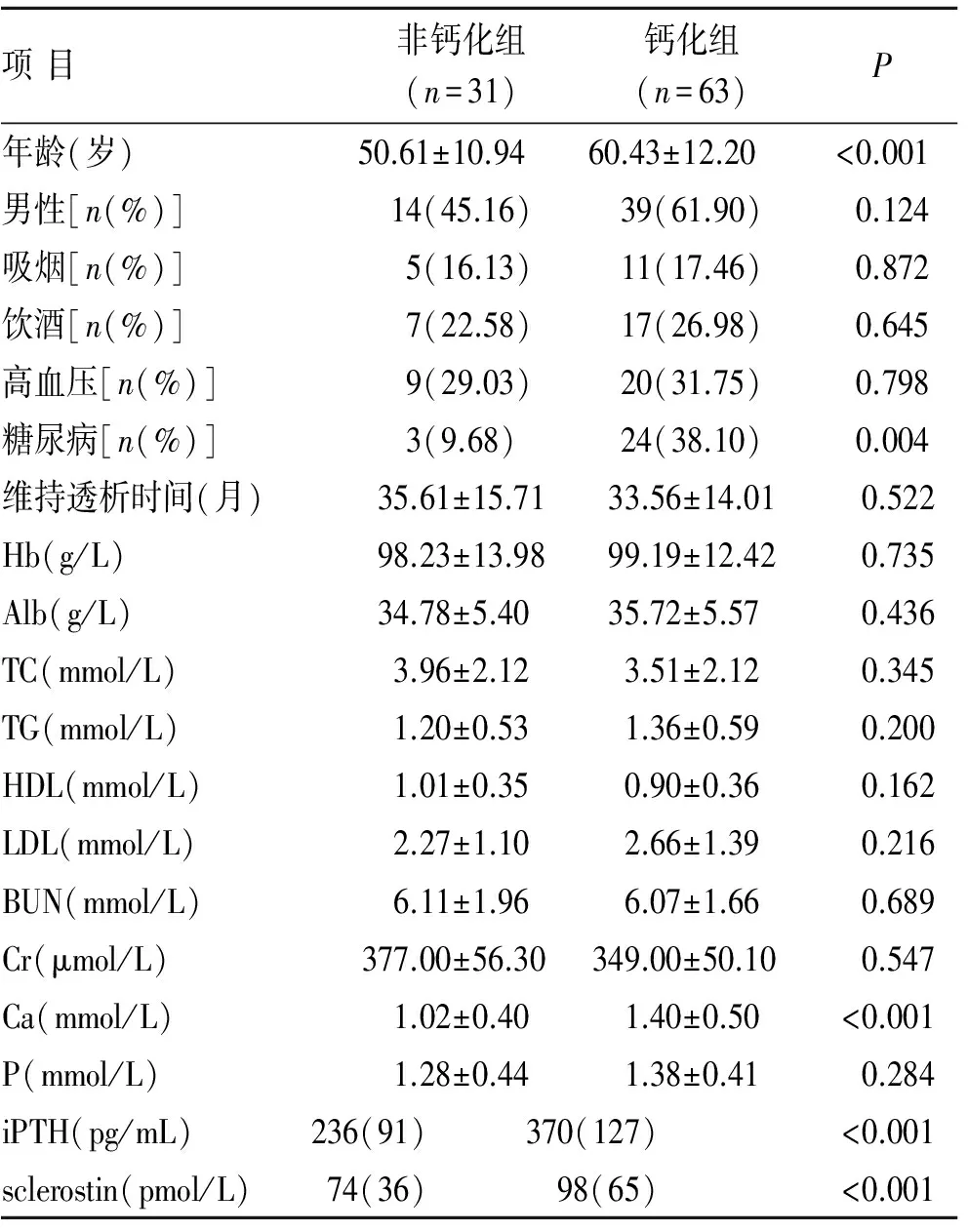
项目非钙化组(n=31)钙化组(n=63)P年龄(岁)50.61±10.9460.43±12.20<0.001男性[n(%)] 14(45.16) 39(61.90)0.124吸烟[n(%)]5(16.13) 11(17.46)0.872饮酒[n(%)]7(22.58) 17(26.98)0.645高血压[n(%)]9(29.03) 20(31.75)0.798糖尿病[n(%)]3(9.68) 24(38.10)0.004维持透析时间(月)35.61±15.7133.56±14.01 0.522Hb(g/L)98.23±13.9899.19±12.420.735Alb(g/L)34.78±5.4035.72±5.570.436TC(mmol/L)3.96±2.123.51±2.120.345TG(mmol/L)1.20±0.531.36±0.590.200HDL(mmol/L)1.01±0.350.90±0.360.162LDL(mmol/L)2.27±1.102.66±1.390.216BUN(mmol/L)6.11±1.966.07±1.660.689Cr(μmol/L)377.00±56.30349.00±50.100.547Ca(mmol/L)1.02±0.401.40±0.50<0.001P(mmol/L)1.28±0.441.38±0.410.284iPTH(pg/mL)236(91)370(127)<0.001sclerostin(pmol/L)74(36)98(65)<0.001
Hb:血红蛋白;Alb:白蛋白;TC:总胆固醇;TG:甘油三酯;HDL:高密度脂蛋白胆固醇;LDL:低密度脂蛋白胆固醇;Ca:血钙; BUN:尿素氮;Cr:血肌酐;Ca:钙;P:磷;iPTH:全段甲状旁腺激素。
2.2血清sclerostin水平与VCLogistic回归分析单因素Logistic回归分析显示年龄、糖尿病、iPTH、血钙和血清sclerostin水平与VC相关。sclerostin水平每增加一个单位,VC发生率增加3%。经多因素Logistic回归分析,sclerostin与VC关系稳定存在(表2)。
表2相关因素与血液透析患者VC的Logistic回归分析
Tab.2Logisticregression analysis of the VC related factors in maintenance dialysis patients
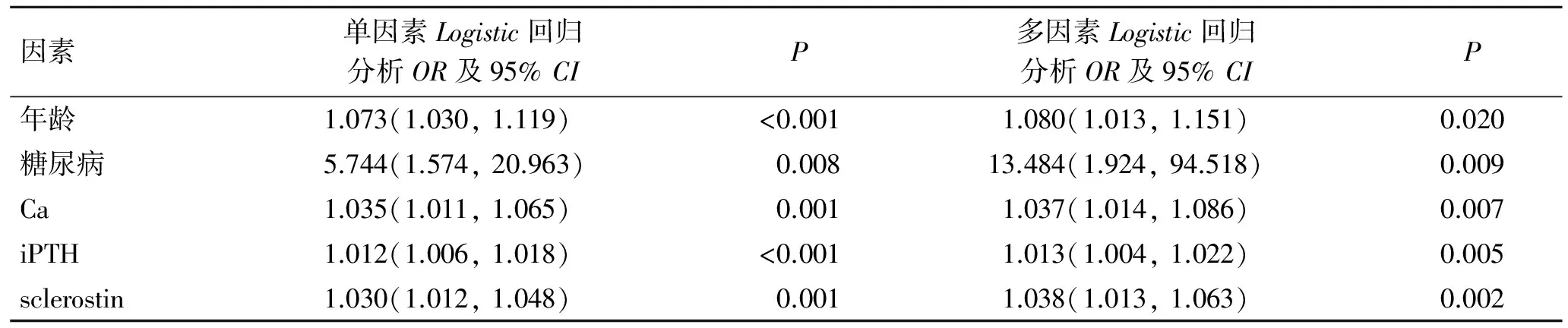
因素单因素Logistic回归分析OR及95%CIP多因素Logistic回归分析OR及95%CIP年龄1.073(1.030,1.119)<0.0011.080(1.013,1.151)0.020糖尿病5.744(1.574,20.963)0.00813.484(1.924,94.518)0.009Ca1.035(1.011,1.065)0.0011.037(1.014,1.086)0.007iPTH1.012(1.006,1.018)<0.0011.013(1.004,1.022)0.005sclerostin1.030(1.012,1.048)0.0011.038(1.013,1.063)0.002
2.3sclerostin、年龄、糖尿病、血钙和全段甲状旁腺激素及各指标联合预测VC的ROC当sclerostin水平为91.27 pmol/L时灵敏度和特异度均为0.71,此时灵敏度和特异度之和最大,因此,预测VC的最佳截断值为91.27 pmol/L。联合年龄、糖尿病、钙和全段甲状旁腺激素时对VC预测的灵敏度为0.91,特异度为0.74。sclerostin、年龄、糖尿病、血钙、全段甲状旁腺激素及以上各指标联合预测VC的曲线下面积分别为0.7510.720、0.642、0.723、0.788和0.936(图1)。
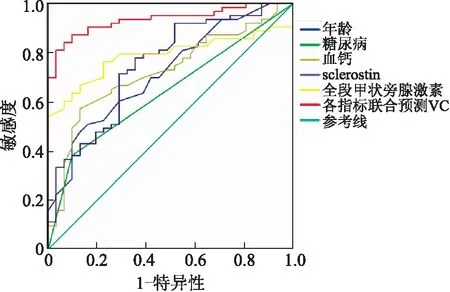
图1年龄、糖尿病、血钙、sclerostin和全段甲状旁腺激素及各指标联合预测VC的ROC
Fig.1 Receiver operator characteristic curves of age, diabetes, calcium, sclerostin, iPTH and their combination for predicting VC
3 讨 论
维持性血液透析的CRF患者血管钙化发生率显著高于一般人群[1-2],这与肾衰竭患者钙磷代谢紊乱、高内毒素血症、纤维细胞生长因子23水平异常、α-Kloth蛋白降低和iPTH增高等有关[3-5]。血管钙化增加CRF患者死亡率[11-12],全面掌握血管钙化的相关因素能更好地服务于钙化机制探讨。
近年来,国内外对血清sclerostin水平与血管钙化关系的研究较多,但是结果不一致。sclerostin是一种由骨细胞特异性分泌的糖蛋白,它是Wnt信号通路抑制蛋白[7],而Wnt信号通路通过多种途径调控血管钙化[6-7],基于此我们推测血清sclerostin水平与血管钙化相关。通过本研究,我们得出:维持性血液透析患者血清sclerostin水平与VC发生相关。周华等[8]的研究证明sclerostin水平与慢性肾衰竭5期患者的桡动脉钙化相关,桡动脉钙化者sclerostin水平显著高于未钙化者;LV等[9]的研究证明sclerostin水平与慢性肾脏病3期和4期患者的腹主动脉、冠状动脉和颈动脉相关,与无血管钙化者相比,钙化者sclerostin水平显著增高;李怀鱼等[13]研究证明血液透析患者sclerostin水平与腹主血管钙化相关,腹主血管钙化者sclerostin水平显著高于未钙化者;而YANG等[10]用经过2年随访的队列研究表明:CRF透析患者体内sclerostin水平下降,主血管钙化者的sclerostin水平低于未钙化者,低水平sclerostin水平是透析患者主血管钙化的危险因素。我们的研究结果与周华、LV和李怀鱼等的研究结果一致[8,9,13],与YANG等[10]研究结果不一致,各研究结论有差异可能是由地区差异、研究血管部位不同,血管钙化的检测仪器不同以及检测sclerostin的试剂盒不同造成的。由于不同研究差异较大,目前还不能得出血清sclerostin水平与血管钙化的确切关系,具体机制也需要进一步研究证实。ELANAYE等[14]研究表明血清sclerostin水平受很多因素影响,如年龄、血磷水平和iPTH等,这些因素同样能影响VC,经多因素Logistic回归分析控制潜在混杂因素后血清sclerostin水平仍与VC显著相关(P<0.01)。sclerostin预测VC的截断值为91.27 pmol/L,此时灵敏度和特异度均为0.71;联合年龄、糖尿病、钙和全段甲状旁腺激素时对VC预测的灵敏度为0.91,特异度为0.74。年龄、糖尿病、血钙、sclerostin、全段甲状旁腺激素及以上各指标联合预测VC的曲线下面积分别为0.720、0.642、0.723、0.751、0.788和0.936。由此提出sclerostin与其他指标联合对预测VC的价值更高。
本研究局限性:①横断面研究,只能证明血清sclerostin水平与透析患者VC相关,不能阐述因果关系。②单中心研究,不能代表西部地区,更不能代表整个中国。③样本量较少。
综上所述,我们研究发现CRF维持性血液透析有VC患者血清sclerostin水平显著高于无VC者,血清scleostin水平与VC相关,sclerostin预测VC的截断值为91.27 pmol/L,与其他指标联合对预测VC价值更高。下一步我们将多中心收集临床样本,全面收集相关临床资料,随访观察进行队列研究,阐明sclerostin蛋白与透析患者VC的因果关系和独立作用。
参考文献:
[1] PEETERS MJ, VAN DEN BRAND JA, VAN ZUILEN AD, et al. Abdominal aortic calcifition in patients with CKD[J]. J Nephrol, 2017, 30(6):109-118.
[2] PARIKH NI, HWANG SJ, LARSON MG, et al. Indexes of kidney function and coronary artery and abdominal aortic calcium (from the Framingham Offspring Study)[J]. Am J Cardiol, 2008, 102(14):440-443.
[3] GRACIOLLIA FG, NEVES KR, DOSREIS LM, et al. Phosphorus overload and PTH induce aortic expression of Runx2 in experimental uraemia[J]. Nephrol Dial Transpl, 2009, 24(5):1416-1421.
[4] JIMBO R, KWAKAMIMORI F, MU S, et al. Fibroblast growth factor 23 accelerates phosphate-induced vascular calcification in the absence of Klotho deficiency[J]. Kidney Int, 2014, 85(9):1103-1111.
[5] CW M, LE H, MT E, et al. Circulating endotoxemia: A novel factor in systemic inflammation and CKD[J]. Clin J Am Soc Nephrol, 2011, 6(21):133-141.
[6] CAI T, SUN DQ , DUAN Y, et al. WNT/β -catenin signaling promotes VSMCs to osteogenictransdifferentiation and calcification through directly modulating Runx2 gene expression[J]. Exp Cell Res, 2016, 345(22):206-217.
[7] KRISHKAM V,BRYANT HU,MACDOUGALD OA. Regulation of bone mass by Wnt signaling[J]. J Clin Invest, 2006, 116(9):1202-1209.
[8] 周华,崔笠,杨敏,等. 慢性肾脏病5期患者sclerostin与桡动脉钙化的关系[J]. 临床荟萃,2015, 30(6):645-650.
[9] LV WANG, GUAN LI, ZHANG Y, et al. Sclerostin as a new key factor in vascular calcification in chronic kidney disease stages 3 and 4[J]. Int Urol Nephrol, 2016, 48(9):2043-2050.
[10] YANG CY, CHANG ZF, CHAU Y. Circulating Wnt/β-catenin signalling inhibitors and uraemic vascular calcifications[J]. Nephrol Dial Transpl, 2015, 30(26):1363-1369.
[11] GOODMAN WG, LONDON G, AMANN K, et al. Vascular calcification in chronic kidney disease[J]. Am J Kidney Dis, 2004, 43(2):572-579.
[12] BASTOS GF, VOUTE MT,HOEKS SE, et al. Calcification of the abdominal aorta as an independent predictor of cardiovascular events: A meta-analysis[J]. Heart, 2012, 98(10):988-994.
[13] 李怀鱼,杨军,王振兴,等. 血液透析患者血清中骨硬化蛋白和DKK1蛋白表达与腹主动脉钙化程度的相关性分析[J]. 中国药物与临床, 2017, 17(1):79-84.
[14] DELANAYE P, KRZESINSKI JM, WARLING X, et al. Clinical and biological determinants of sclerostin plasma concentration in hemodialysis patients[J]. Nephron Clin Pract, 2014, 128(9):127-134.

