种植不同植物的生态浮床对浮游藻类的化感作用*
雷纯义,朱术超,关易云,李善,刘蔚秋
(1.广东省植物资源重点实验室∥中山大学生命科学学院,广东 广州 510275;2. 广东黑石顶省级自然保护区,广东 肇庆 526536)
水是人类赖以生存的重要资源,但是随着人口的增长和经济的发展,环境污染导致的水体富营养化已成为世界性的问题,引起人们的广泛关注。水体富营养化导致藻类过度增殖,从而引发水华,而水华藻类大量消耗水体中的氧,并释放藻毒素等有毒物质,严重威胁水生生物,从而对水生生态系统产生严重影响,藻毒素还可通过食物链进入人体,危害人类健康[1-2]。随着全球变暖趋势,水华发生的频率和程度日益严重[3],有效控制藻类过度生长及防止水华暴发是目前环境和生态领域中最为关注的问题之一。
通过植物浮床吸收水体中的氮磷营养盐,从而减少水华发生的风险是目前国内外城市水体治理中广泛采用的方法。植物除了通过竞争与藻类争夺光照和营养物质的方式抑制藻类的生长,还可能通过释放化感物质抑制藻类,因此利用植物的化感作用抑制藻类生长的研究也逐渐受到重视[4-5]。对于植物对浮游藻类的化感作用的研究主要集中在抑藻化感物质的分离鉴定以及化感作用的生理生态机理方面[6-7],而在实际应用中筛选出对藻类具有较强化感作用的浮床植物应同样受到重视。
香根草是目前国内外在环境修复中广泛使用的一种植物,由于其对水淹具有良好的耐性且根系发达,其在植物浮床方面的应用亦受到人们的重视[8- 9]。香根草含有多种挥发性成分,研究显示这些挥发性成分对微生物、藻类及其他高度植物具有明显的化感抑制作用[10]。论文选用香根草Vetiveriazizanioides以及另外两种常用于浮床的植物黄菖蒲Irispseudacorus和西芹Apiumgraveolens作为研究对象,用这3种植物及其不同搭配构建植物浮床,研究其对6种常见淡水蓝藻和绿藻的生长的影响,分析单种植物浮床及混种植物浮床对藻类生长的抑制特征,探讨种间作用在生态浮床的生态效应中可能存在的作用,为筛选合适的浮床植物及种植策略提供理论依据。
1 材料与方法
1.1 实验材料
选择香根草、黄菖蒲和西芹作为浮床植物,其中香根草购自华南农业大学野外基地,黄菖蒲和西芹来源于市售。
选择蓝藻铜绿微囊藻Microcystisaeruginosa(FACHB-315)和水华鱼腥藻Anabaenaflosaquae(FACHB-245)以及绿藻斜生栅藻Scenedesmusobliquus(FACHB-13)、羊角月牙藻Selenastrumcapricornutum(FACHB-271)、蛋白核小球藻Chlorellapyrenoidesa(FACHB-11)和莱茵衣藻Chlamydomonasreinhardti(FACHB-359)作为受试浮游藻类(购自中国科学院水生生物研究所淡水藻种库,FACHB)。
铜绿微囊藻和水华鱼腥藻培养于BG11培养基,斜生栅藻、羊角月牙藻及蛋白核小球藻培养于AAM培养基,莱茵衣藻培养于MCV培养基。各藻种培养于恒温光恒湿照培养箱中,温度为25 ℃(L)/20 ℃(D),光照强度为55 mmol·m-2·s-1,光暗周期为12 h∶12 h,每天定时摇动2次。进行藻类试验前,对各藻种进行活化培养,活化培养条件与试验培养条件一致,取对数生长期藻类进行试验。
1.2 实验设计
在直径为60 cm、高为90 cm的塑料桶中加入自来水至30 cm高处,体积约为85 L,曝气3 d后,配置为0.1×Hoagland营养液。在每个桶中放置一个面积为25 cm×25 cm的泡沫板构建生态浮床,每个板上钻6个孔,每个孔种植2株植物,分别种植上述3种植物及其不同组合,共7种处理,分别为香根草12株,黄菖蒲12株,西芹12株,香根草和黄菖蒲各6株,香根草和西芹各6株,黄菖蒲和西芹各6株以及香根草,黄菖蒲和西芹各4株,另设1个未种植的空白浮床作为对照,每个处理3个重复,将各植物冲洗干净后种于浮床上。香根草、黄菖蒲及西芹的初始株高分别为35、55和20 cm,根长分别为20、25和12 cm,每株鲜质量分别为12、6.5和10 g,种植2周后分别取上述各水体进行化感实验。
在250 mL的三角瓶中加入经0.45 μm滤膜抽滤过的50 mL植物种植水,并加入处于对数生长期的各试验藻类,使每个三角瓶藻类初始密度为1.0×104cell/mL。每天取样2.5 mL水样于650 nm处测光吸收值。每2天补充5 mL植物种植水,连续观察8 d,8 d后测定各组藻类的叶绿素a含量和MDA含量。
1.3 实验方法
各藻类细胞密度与光密度A650的标准曲线绘制:分别配制密度为0.01×106~10×106cell/mL的各藻类溶液,于650 nm测定A值,绘制A650与藻密度的一元线性标准曲线(所有标准曲线的r>0.995),在化感实验过程中依据各水体中的A650值估算藻类密度。
叶绿素a含量测定采用丙酮研磨提取,分光光度法测定[11]。溶液中丙二醛(MDA)含量测定采用硫代巴比妥酸法测定[12],并根据溶液中藻细胞密度换算为每细胞MDA含量。
1.4 数据处理
对具有显著抑制或促进作用的处理计算抑制率,计算公式为:
R=[(A0-A)/A0]×100%
式中R表示抑制率,A0表示对照组的值,A表示处理组的值。
数据处理利用SPSS 17.0 软件,各组间差异性分析采用单因素方差分析(one-way ANOVA,LSD),以P<0.05时设为差异显著。
2 结果和分析
2.1 浮游藻类细胞密度
由表1可见,在实验开始数天后,香根草,香根草+西芹及香根草+黄菖蒲+西芹处理对所有受试藻类密度均表现出显著的抑制作用(香根草+西芹处理仅对斜生栅藻作用不显著),但是不同藻类开始受到显著抑制的时间不同,其中莱茵衣藻对浮床植物最为敏感,处理1天即开始受到显著抑制,水华鱼腥藻和斜生栅藻在处理2~3 d后受到明显抑制,而铜绿微囊藻、蛋白核小球藻、羊角月牙藻在处理3~5 d后受到明显抑制。另外,香根草+黄菖蒲处理亦显著抑制水华鱼腥藻、斜生栅藻和莱茵衣藻的密度。但是在实验前期,黄菖蒲及黄菖蒲+西芹处理促进铜绿微囊藻、蛋白核小球藻及羊角月牙藻的生长,至实验后期,黄菖蒲处理对水华鱼腥藻、斜生栅藻和莱茵衣藻的生长表现出明显的促进作用,而西芹亦在一定程度上促进斜生栅藻的生长。

表1 各浮游藻类在不同浮床植物处理的水体中生长8 d的密度变化(平均值,n=3)1)Table 1 Density dynamics of various planktonic algae grown in water treated with various floating-bed plants for 8 days (mean,n=3) 106 cell/mL
续上表

3.斜生栅藻ScenedesmusobliquusCK0.17ab0.26b0.42c0.68c1.38bc1.85c2.10d2.14dV0.14a0.21ab0.31b0.45ab0.55a0.63a0.61a0.58aI0.13a0.24b0.45c0.86d1.46c2.04d1.99d2.47eA0.14a0.23b0.45c0.87d1.37bc1.56b2.17d2.67eV+I0.14a0.21ab0.29ab0.36a0.49a0.68a0.78ab1.06bV+A0.30c0.34c0.45c0.57bc1.21b1.94cd1.99d1.96dI+A0.21b0.37c0.59d1.05e1.55c1.82c1.77c1.59cV+I+A0.18ab0.16a0.23a0.35a0.51a0.81a0.92b0.99b4.羊角月牙藻SelenastrumcapricornutumCK0.08a0.15a0.25ab0.51b0.97cd1.28b1.40b1.58cV0.07a0.17a0.21a0.25a0.32a0.37a0.32a0.35aI0.25b0.33c0.35bc0.44ab0.65bc0.99ab0.99ab1.23bcA0.09a0.14a0.28ab0.55b0.96cd1.29b1.22b1.20bcV+I0.07a0.11a0.20a0.39ab0.80c1.14b1.22b1.52cV+A0.12a0.21ab0.30ab0.36ab0.43ab0.44a0.44a0.62abI+A0.17ab0.29bc0.44c0.74c1.17d1.48b1.46b1.52cV+I+A0.10a0.21a0.29ab0.36ab0.43ab0.44a0.42a0.45ab5.蛋白核小球藻ChlorellapyrenoidesaCK0.13a0.21ab0.40ab0.94b1.73bcde2.88cd3.11c3.41dV0.14a0.30ab0.40ab0.41a0.44a0.47a0.46a0.50aI0.30bc0.43bc0.64c1.05bc2.15de3.23d3.42c4.12dA0.17ab0.23ab0.47abc1.04bc1.85cde2.08bcd1.52ab1.35abV+I0.11a0.16a0.29a0.73ab1.28abcd2.00bc2.14bc2.78bcdV+A0.22a0.37bc0.52bc0.70ab0.97abc1.23ab1.26ab1.57abcI+A0.37c0.55c0.89d1.50c2.33e2.72cd2.76c2.96cdV+I+A0.22a0.50c0.67c0.78ab0.86ab0.89ab0.70a0.62a6.莱茵衣藻ChlamydomonasreinhardtiCK0.07d0.11d0.17d0.27d0.50cd0.68cd0.76c0.82dV0.05bc0.07ab0.09a0.14a0.20a0.32a0.30a0.27aI0.04a0.06a0.10ab0.20bc0.45c0.76d0.86d0.98eA0.06bc0.10cd0.15cd0.29de0.54de0.76d0.78cd0.77cdV+I0.05ab0.08bc0.12abc0.21c0.32b0.39ab0.47b0.49bV+A0.07cd0.09c0.16d0.19abc0.33b0.42b0.47b0.44bI+A0.05bc0.08bc0.13b0.33e0.60e0.65c0.71c0.72cV+I+A0.05ab0.07ab0.10a0.15ab0.23a0.35ab0.33a0.32a
1) CK,V,I,A,V+I,V+A及V+I+A分别表示空白对照,香根草,黄菖蒲,西芹,香根草+黄菖蒲,香根草+西芹,黄菖蒲+西芹及香根草+黄菖蒲+西芹处理。数据以平均值表示(n=3),每种藻类同一列数字后不同字母表示不同处理对此种藻类生长的影响存在显著差异(P<0.05, one-way ANOVA, LSD),与对照相比显著抑制的处理以黑体标出,显著促进的处理以斜体+黑体标出。标准差未列出。
由表2可见,8 d后,香根草和香根草+黄菖蒲+西芹处理对各种藻类密度的抑制率最高,香根草+西芹其次,而黄菖蒲+西芹处理对斜生栅藻和莱茵衣藻密度的抑制虽然达到显著水平,但是抑制率相对较低。另外黄菖蒲处理在一定程度上促进水华鱼腥藻、斜生栅藻和莱茵衣藻的生长,西芹处理则对斜生栅藻的生长具有一定的促进。
2.2 浮游藻类叶绿素a(Chl.a)含量
由图1可见,在实验处理8 d后,香根草及香根草+黄菖蒲+西芹处理显著抑制除羊角月牙藻以外的各受试藻类的Chl.a含量(香根草处理对蛋白核小球藻的抑制效果亦不明显),另外香根草+黄菖蒲处理抑制水华鱼腥藻、斜生栅藻和莱茵衣藻培养液的Chl.a含量,斜生栅藻的Chl.a含量还受到黄菖蒲及香根草+西芹抑制。但是黄菖蒲显著促进铜绿微囊藻、羊角月牙藻、蛋白核小球藻的Chl.a含量,另外黄菖蒲+西芹处理促进水华鱼腥藻和斜生栅藻的Chl.a含量。香根草对两种蓝藻铜绿微囊藻和水华鱼腥藻Chl.a含量的抑制率分别达到90%和69%。

表2 不同浮床植物处理的水体中生长8 d对浮游藻类密度的抑制率(平均值±标准差,n=3)1) Table 2 Inhibitory rate of planktonic algae density after grown in water treated with various floating-bed plants for 8 days (mean±SD., n=3) %
1) CK,V,I,A,V+I,V+A及V+I+A分别表示空白对照,香根草,黄菖蒲,西芹,香根草+黄菖蒲,香根草+西芹,黄菖蒲+西芹及香根草+黄菖蒲+西芹处理。负数表示具促进作用,“-”表示无显著影响。
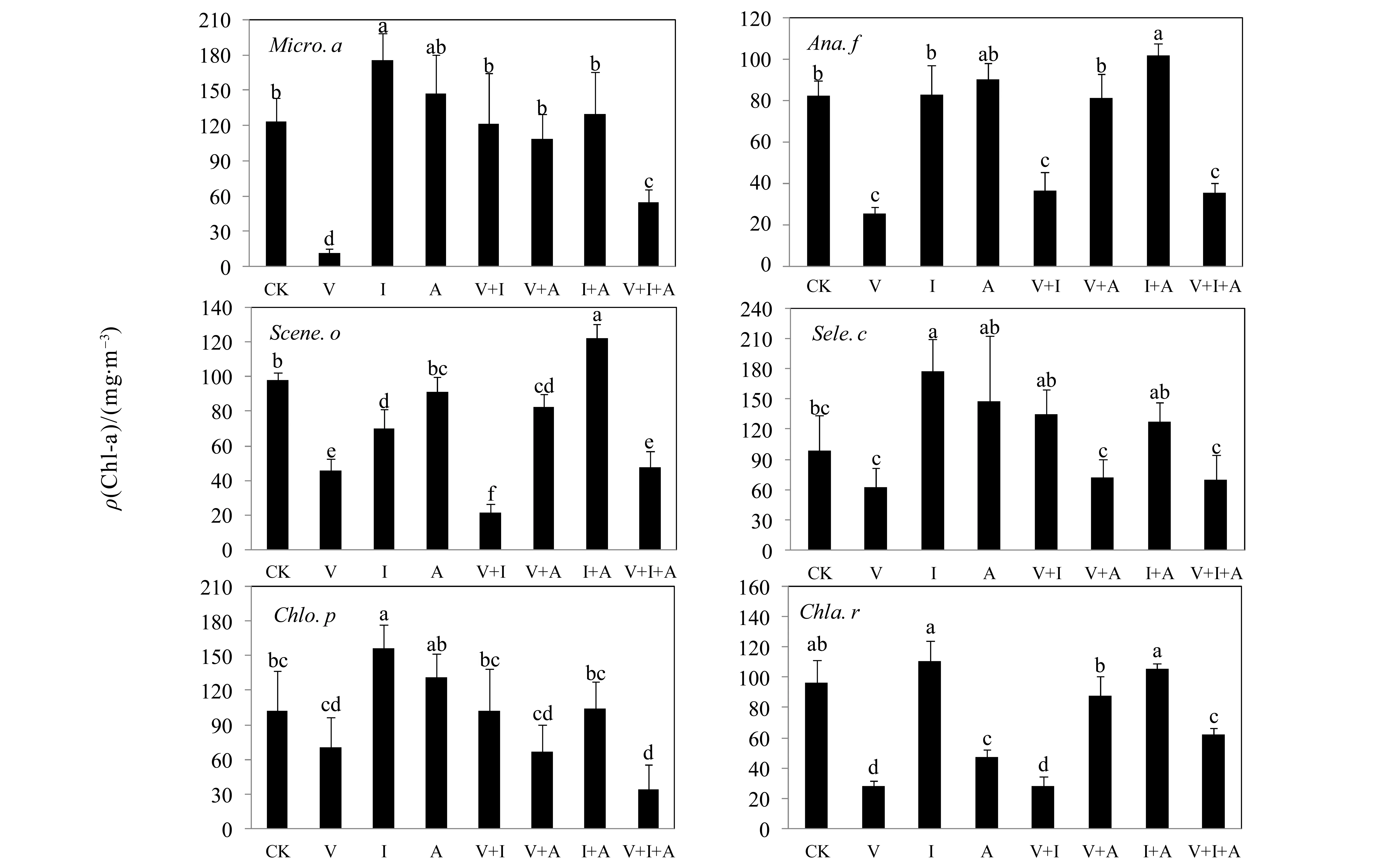
图1 浮游藻类在不同浮床处理过的水体中生长8 d后的叶绿素a含量(平均值+标准差,n=3),图中不同字母表示不同处理间差异显著(P<0.05, one-way ANOVA, LSD)Fig.1 Contents of chl. Chl.a of various planktonic algae grown in water treated with different floating-bed plants for 8 days (mean+SD., n=3), different letters on the columns indicate significant different between treatments (P<0.05, one-way ANOVA, LSD)注:CK,V,I,A,V+I,V+A及V+I+A分别表示空白对照,香根草,黄菖蒲,西芹,香根草+黄菖蒲,香根草+西芹,黄菖蒲+西芹及香根草+黄菖蒲+西芹处理,Micro. a, Ana. f, Scene. o, Sele. c, Chlo. p, Chla. r分别表示铜绿微囊藻,水华鱼腥藻,斜生栅藻,羊角月牙藻,蛋白核小球藻以及莱茵衣藻。数据以平均值+SD表示(n=3),不同小写字母表示不同种植水处理间差异显著(P<0.05,one-way ANOVA,LSD)。数据柱上方的数字表示抑制率,负数表示促进效率。
2.3 藻细胞丙二醛(MDA)含量
实验处理8 d后,香根草和香根草+黄菖蒲+西芹处理导致所有藻类体内的MDA含量大幅上升,另外香根草+黄菖蒲和香根草+西芹处理还导致水华鱼腥藻和莱茵衣藻体内的MDA含量上升,而黄菖蒲和西芹处理对藻类MDA含量无明显影响(图2)。

图2 浮游藻类在不同浮床处理过的水体中生长8 d后的丙二醛含量(平均值+标准差,n=3),图中不同字母表示不同处理间差异显著(P<0.05, one-way ANOVA, LSD)Fig.1 Contents of MDA of various planktonic algae grown in water treated with different floating-bed plants for 8 days (mean+SD., n=3), different letters on the columns indicate significant different between treatments (P<0.05, one-way ANOVA, LSD)注:CK,V,I,A,V+I,V+A及V+I+A分别表示空白对照,香根草,黄菖蒲,西芹,香根草+黄菖蒲,香根草+西芹,黄菖蒲+西芹及香根草+黄菖蒲+西芹处理,Micro. a, Ana. f, Scene. o, Sele. c, Chlo. p, Chla. r分别表示铜绿微囊藻,水华鱼腥藻,斜生栅藻,羊角月牙藻,蛋白核小球藻以及莱茵衣藻。数据以平均值+SD表示(n=3),不同小写字母表示不同种植水处理间差异显著(P<0.05,one-way ANOVA,LSD)。
3 讨 论
3.1 植物对藻类生长的影响
目前尚未见到有关香根草对浮游植物的化感抑制作用的研究,但是有研究报道香根草根提取物岩兰草油对铜绿微囊藻和斜生栅藻的生长具抑制作用[10]。本研究中香根草对所有藻类的生长和Chl.a含量均具明显的抑制作用。关于西芹对浮游植物的化感作用未见到相关研究,但是有研究显示种植密度为5 g·L-1的黄菖蒲对浮游植物的生长及Chl.a影响不大[13],本研究中黄菖蒲和西芹对藻类生长的抑制作用多不显著,特别是黄菖蒲对数种藻类的生长甚至具有促进作用。不过本研究中黄菖蒲的种植密度仅为0.9 g·L-1,远低于文献报道的5 g·L-1。我们的研究还显示,西芹和黄菖蒲对不同藻类的化感作用具有一定的种间差异性,这与前人的研究结果相似[14]。
另外使人意外的是香根草+黄菖蒲+西芹处理极显著抑制所有受试藻类的生长及Chl.a含量,抑制率总体与香根草单种处理相近,高于香根草+黄菖蒲和香根草+西芹处理,由于在香根草+黄菖蒲+西芹处理中,香根草的种植密度只有单种处理时的1/3,我们推测这3种植物在浮床上的搭配种植导致了种间协同作用,提高了对浮游植物的化感抑制作用。此结果表明在进行浮床植物的选择和搭配时,应充分考虑不同植物间的相互协同作用,目前这方面的研究极为匮乏,在今后的研究中应引起重视。
3.2 植物对藻类膜脂过氧化的影响
植物细胞中的MDA含量是衡量细胞发生膜脂过氧化的重要指标,MDA含量上升说明细胞受到的逆境胁迫增强[15-16],而化感抑制物质常引起被抑制植物体内的MDA上升[16-17]。本研究中,香根草处理显著促进藻细胞的MDA积累,说明香根草对所有受试藻类均产生强烈的化感抑制作用。另外,黄菖蒲和西芹对藻类的MDA含量无明显影响,香根草+黄菖蒲+西芹处理大幅增加所有受试藻类体内的MDA含量,这些结果均与前面的生长实验及Chl.a的结果一致,并再一次证实了种间协同作用导致化感抑藻作用增强,但对于这种现象的内在机理仍需进一步的研究。
参考文献:
[1] 隗黎丽. 微囊藻毒素对鱼类的毒性效应 [J]. 生态学报, 2010,30(12): 3304-3310.
WEI L L. Effects of microcystins on fish [J]. Acta Ecologica Sinica, 2010, 30(12): 3304-3310.
[2] 黄艺,张郅灏. 微囊藻毒素的致毒机理和人体健康风险评价研究进展 [J]. 生态环境学报, 2013, 22(2): 357-364.
HUANG Y, ZHANG Z H. Advances in the study of toxicology and human health risk assessment of microcystin [J]. Ecology and Environmental Sciences, 2013, 22(2): 357-364.
[3] YE C, SHEN Z M, ZHANG T, et al. Long-term joint effect of nutrients and temperature increase on algal growth in Lake Taihu, China [J]. Journal of Environmental Sciences, 2011, 23(2): 222-227.
[4] BERGER J, SCHAGERL M. Allelopathic activity ofCharaaspera[J]. Hydrobiologia, 2003, 501 (1/2/3): 109-115.
[5] HONG Y, HU H Y, SAKODA A, et al. Isolation and characterization of antialgal allelochemicals fromArundodonaxL [J]. Allelopathy Journal, 2010, 25: 357-367.
[6] NAKAI S, INOUE Y, HOSOMI M, et al.Myriophyllumspicatum-released allelopathic polyphenols inhibiting growth of blue-green algaeMicrocystisaeruginosa[J]. Water Research, 2000, 34: 3026-3032.
[7] HILT S. Allelopathic inhibition of epiphytes by submerged macrophytes [J]. Aquatic Botany, 2006, 85: 252-256.
[8] ZHAO F L, YANG W D, ZENG Z, et al. Nutrient removal efficiency and biomass production of different bioenergy plants in hypereutrophic water [J]. Biomass and Bioenergy, 2012, 42 : 212-218.
[9] 朱术超,刘毅,李善,等. 几种植物浮床的水质净化及水华防治效率 [J]. 中山大学学报(自然科学版), 2016, 55(6): 140-147.
ZHU S C, LIU Y, LI S, et al. Effects of plant floating beds on water purification and bloom control [J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2016, 55(6): 140-147.
[10] 章典, 李诚, 刘璐, 等. 岩兰草油对淡水藻类的抑制作用 [J]. 生态学报, 2015, 35(6): 185-1851.
ZHANG D, LI C, LIU L, et al. Studies on the inhibition of vetiver oil to freshwater algae [J]. Acta Ecologica Sinica, 2015, 35(6): 1845-1851.
[11] 国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法 [M]. 4版. 北京:中国环境科学出版社, 2002.
Editorial Board of "Water and Wastewater Monitoring and Analysis Methods" of the State Environmental Protection Administration's. Water and wastewater monitoring analysis method [M]. 4th ed. Beijing: China Environmental Science Press, 2002.
[12] NIE X P, LIU B Y, YU H J, et al. Toxic effects of erythromycin, ciprofloxacin and sulfamethoxazole exposure to the antioxidant system inPseudokirchneriellasubcapitata[J].Environmental Pollution, 2013, 172: 23-32.
[13] 陈国元, 唐凯. 不同质量浓度黄菖蒲和狭叶香蒲对铜绿微囊藻的化感作用 [J]. 环境工程学报, 2014, 8(2): 465-470.
CHEN G Y, TANG K. Allelopathic effect of different concentrations ofIrispseudacorusL. andTyphaangustifoliaL. onMicrocystisaeruginosa[J]. Chinese Journal of Environmental Engineering, 2014, 8(2): 465-470.
[14] MULDERIJ G, VAN D E, ROELOFS J G M. Differential sensitivity of green algae to allelopathic substances fromChara[J]. Hydrobiologia, 2003, 491: 261-271.
[15] BARRINGTON D J, GHADOUANI A. Application of hydrogen peroxide for the removal of toxic cyanobacteria and other phytoplankton from wastewater [J]. Environmental Science and Technology, 2008, 42: 8916-8921.
[16] HONG Y, HU H Y, XIE X, et al. Gramine-induced growth inhibition, oxidative damage and antioxidant responses in freshwater cyanobacteriumMicrocystisaeruginosa[J]. Aquatic Toxicology, 2009, 91(3): 262-269.
[17] 张维昊, 周连凤, 吴小刚, 等. 菖蒲对铜绿微囊藻的化感作用 [J]. 中国环境科学, 2006, 26(3): 355-358.
ZHANG W H, ZHOU L F, WU X G, et al. [J]. Allelopathic effect ofAcoruscalamusonMicrocystisaeruginosa. China Environmental Science, 2006, 26(3): 355-358.

