基于DNA条形码技术的防风药材市场调查研究
罗丹丹,方海兰,李 杨,段宝忠
(大理大学药学与化学学院,云南大理 671000)
防风为常用中药,来源于伞形科防风属植物防风 Saposhnikovia divaricata(Turcz.)Schischk.的根,具有祛风解表,胜湿止痛,止痉功效〔1〕。各地常将川防风Ligusticum brachylobum Franch.、竹叶防风Seseli mairei H.Wolff、松叶防风S.yunnanense Franch.以及同科多种植物如杏叶防风Pimpinella candolleana Wight&Arn.、石 防 风 Peucedanum terebinthaceum(Fisch.ex Trevir.)Ledeb.、葛缕子 Carum carvi L.等作为防风混伪品使用〔2-5〕,由于这些药材均来源于伞形科,其根部特征与防风较为相似,采用传统的性状和显微鉴别等方法难以鉴别〔6-8〕,对临床用药安全造成极大威胁。
DNA条形码(DNA barcoding)技术是分子鉴定的最新发展,即通过比较一段通用DNA片段,对物种进行快速、准确的识别和鉴定〔9〕。陈士林等对大量样本的研究表明,ITS2序列是鉴定药用植物及其混伪品的理想条形码〔10〕。该技术已广泛用于重楼〔11〕、臭牡丹〔12〕、艾叶〔13〕、何首乌〔14〕等多种中药材的混伪品鉴别研究,并取得了良好的效果。目前已有学者采用ITS2条形码对防风及其伪品中华前胡和杏叶防风等开展了鉴别研究,结果表明DNA条形码技术可有效鉴别防风及其混伪品〔15〕,但未见该技术用于竹叶防风、松叶防风等常见伪品的分子鉴别研究。鉴于此,本研究在建立防风及其常见混伪品的参照DNA条形码数据库的基础上,对来源于市场的28批标签为防风的药材进行了研究,以期为DNA条形码技术在药品检验和市场监管领域的应用提供参考。
1 仪器与材料
1.1 仪器PCR仪(2720,Applied Biosystems,USA);1-14K型高速冷冻离心机(Sigma公司);植物组织研磨仪(Retsch MM400);NanoDrop 2000∕2000C分光光度计(Thermo Fisher Scientific公司);各种量程的微量移液器(Eppendorf)。
1.2 材料本研究采集包括防风Saposhnikovia divaricata、竹叶防风Seseli mairei、杏叶防风Pimpinella candolleana及华山前胡Peucedanum ledebourielloides等4个物种8份植物样本,经大理大学段宝忠副教授鉴定,并从GenBank下载防风常见伪品的ITS2序列16条,含上述8个物种共24条ITS2序列用于构建防风及其混伪品的标准条形码数据库。见表1。28批标签为防风的药材(HSM-01~28)收集于市场或委托药商购于市场,其基原不详。见表2。
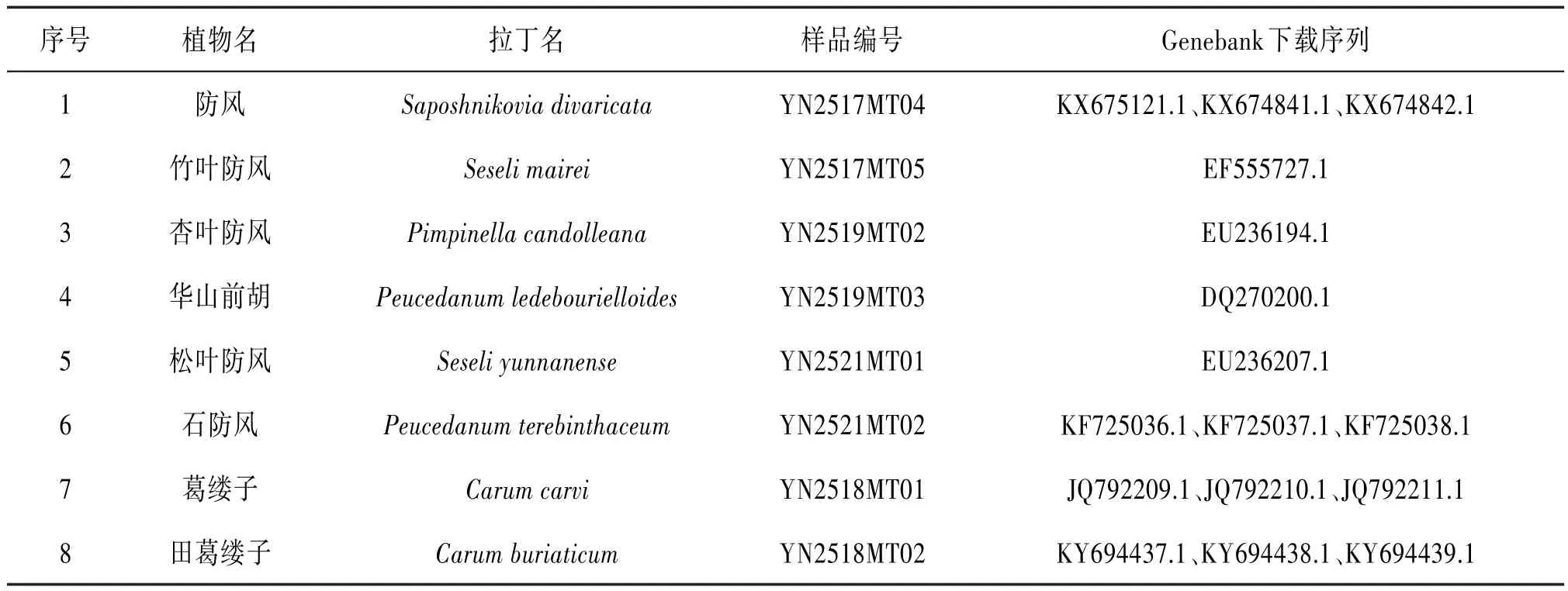
表1 防风及其习用品ITS2序列信息表
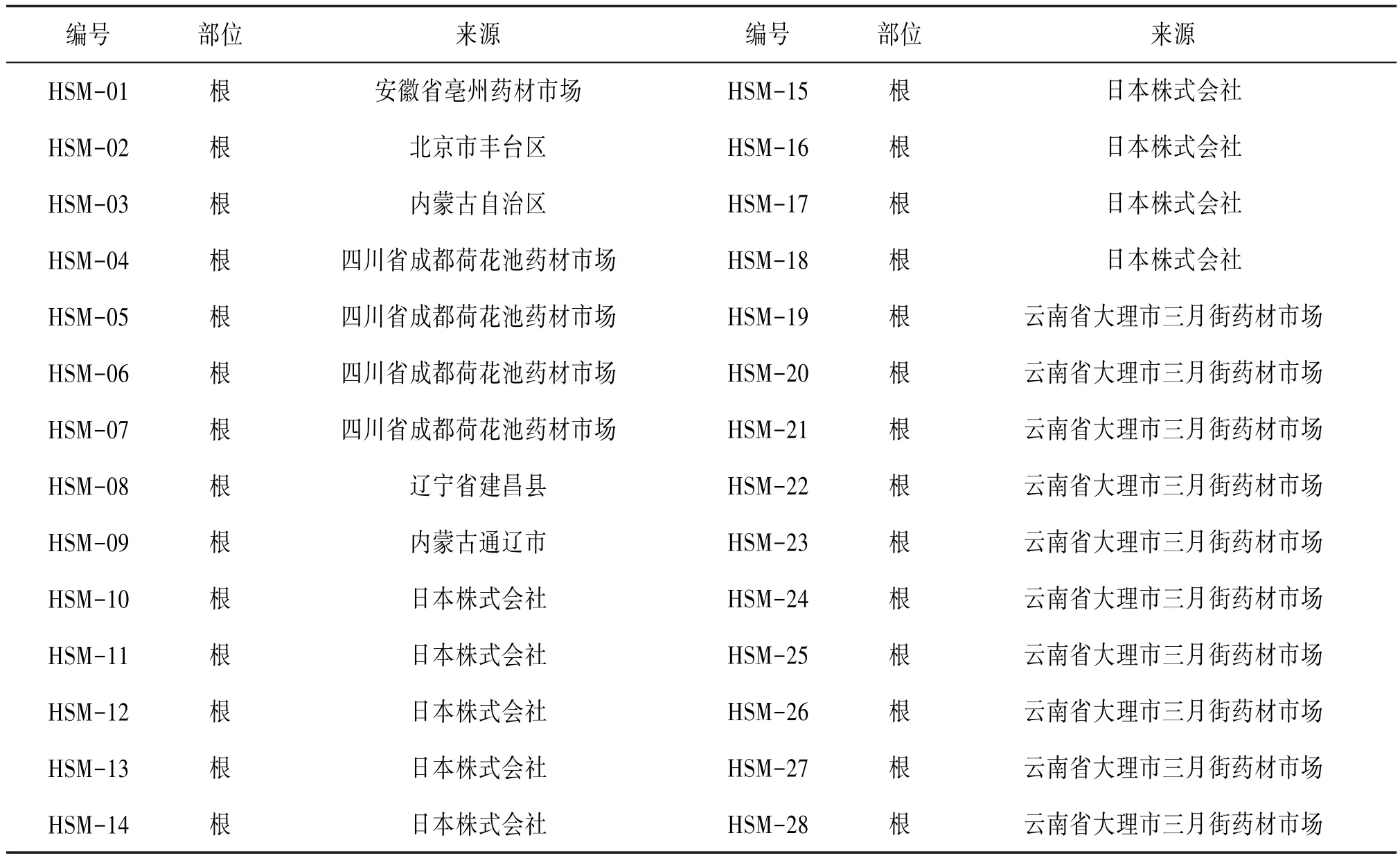
表2 市场收集药材样品表
2 方法
2.1 DNA提取植物样本叶片采用硅胶进行干燥,取30 mg,市场购买药材切碎,取40 mg。用植物组织研磨仪(Retsch MM400,Germany)研磨2 min。总DNA提取在植物组织提取试剂盒(Tiangen Biotech Co.,China)的操作规程基础上进行了改进。研磨后,使用核分离缓冲液(100 mmol∕L Tris-HCl,pH 8.0;20 mmol∕L EDTA,pH 8.0;0.3 mmol∕L NaCl;2%PVP40;2%β-巯基乙醇)抽提2次;水浴温度为54℃,水浴时间6 h;水浴后,使用氯仿-异戊醇(24∶1)抽提2次。其他操作均按试剂盒规程。
2.2 PCR扩增及测序ITS2序列的反应条件,扩增引物,以及扩增程序参照文献进行〔16〕。引物由上海生工生物工程股份有限公司合成,有条带的PCR产物送上海美吉生物医药科技有限公司进行双向测序。
2.3 数据处理所得的测序峰图利用CodonCode Aligner Version 5.1.5(CodonCode Co.,USA)进行组装拼接。基于隐马尔夫模型的HMMer注释方法将所得序列及GenBank序列,除去5.8S和28S区,获得ITS2序列。采用MEGA 6.0(Molecular Evolutionary Genetics Analysis)构 建 NJ(Neighbor-Joining)树,Kimura 2-Parameter(K2P)法计算遗传距离。
3 结果
3.1 DNA提取与PCR扩增效率PCR扩增效率及测序成功率是评价DNA条形码序列的两个重要指标。本研究中,所提取的36份样品DNA(包括8份植物样本和28份药材样本),经NanoDrop 2000测定,A260∕A280值为1.8 ~ 2.0之间,样品DNA浓度为100~300 ng∕μL。表明改进后的提取方法所提取的DNA质量较好。PCR扩增效率及测序成功率均为100%。
3.2 参考样本ITS2序列遗传距离用于构建标准数据库的24条ITS2序列(8条植物样本序列,16条GenBank下载序列)长度范围为221~229 bp,GC含量为51.80%~59.26%。防风种内5个样本间的K2P遗传距离为0.000,防风与其他物种间的K2P距离范围为0.037~0.307。防风种内遗传距离小于种间遗传距离,表明ITS2序列可用于防风及其混伪品的鉴别。
3.3 市场药材鉴定分析将28批标签为防风的药材(编号HSM-01~28),分别在NCBI数据库(https:∕∕www.ncbi.nlm.nih.gov∕)、中药材DNA条形码鉴定系统(TCM-DBS,http:∕∕.tcmbarcode.cn∕china∕)进行相似性搜索,DNA条形码比对结果见表3。从表3可看出,28批药材样品分属于5个物种,其中有10份药材为防风,占35.71%;8份与竹叶防风具有高度相似性,占28.57%;6份与华山前胡相似,占21.43%;3份与杏叶防风相似,占10.71%;1份为伞形科其他物种。

表3 市售标签为防风的药材BLAST及TCM-DBS鉴定结果
3.4 市场药材NJ树分析将市场28个药材样品的ITS2序列与24条参考DNA条形码,构建NJ树。见图1。从图1可看出,样品HSM-02~04、06~12与正品防风S.divaricata聚为一支;样品HSM-01、05、20~24、26与竹叶防风 S.mairei聚为一支;样品HSM-13~18与华山前胡 P.ledebourielloides聚为一支;样品HSM-19和HSM-27~28与杏叶防风P.candolleana聚为一支。仅HSM-25未与参考序列库内的物种聚为一支,BLAST结果为白花前胡P.praeruptorum或红前胡P.rubricaule。
4 讨论与结论
药材基原物种的准确鉴定是避免混伪品混淆使用的关键。传统的性状和显微鉴定方法主要依靠形态特征进行鉴定,这类方法主观性强,同时对鉴定者的专业水平要求高。随着当前传统鉴定专业人才的匮乏,药材外观相似或同物异名对市场药材监管部门提出了挑战。DNA条形码是一种分子鉴定技术,其不受环境因素、样品形态和材料部位的限制,已成为中药原植物和药材鉴定的有效手段〔9〕,其操作简单,可实现鉴定结果的客观和自动化,有效缓解了中药材鉴定人才缺乏的现状。
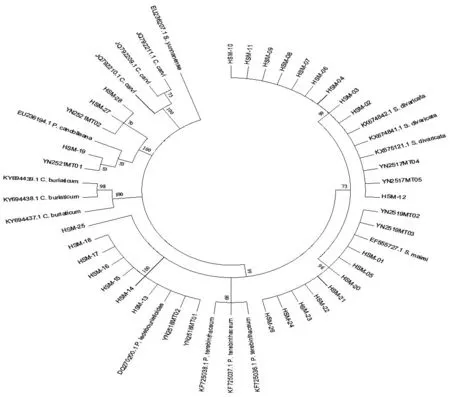
图1 基于ITS2序列构建的防风市场药材NJ树
本研究采用ITS2条形码鉴定防风常见混伪品〔17-18〕,建立了防风及其混伪品的参考DNA标准条形码数据库,并利用该数据库对市场收集的28批标签为“防风”的药材进行了鉴定和验证。结果表明ITS2序列可有效鉴别已知混伪品。DNA鉴定结果表明,市售防风药材来源复杂,在调查的28批防风药材中,仅有10批为正品防风S.divaricata,其余药材植物基原可能有竹叶防风S.mairei,华山前胡P.ledebourielloides,白花前胡P.praeruptorum、杏叶防风P.candolleana等多种,这些药材性味功效与防风差异较大〔19〕,对防风临床用药的安全和有效造成了极大威胁。上述DNA条形码的鉴定结果与前人的研究结果基本一致〔3〕,表明DNA条形码可作为中草药来源鉴定和市场混伪品检测的有效工具。
[参考文献]
〔1〕国家药典委员会.中华人民共和国药典:一部〔M〕.北京:中国医药科技出版社,2015:149-150.
〔2〕窦忠健,杨勤福,李伟.中药防风及其混伪品的鉴别〔J〕.河南中医药学刊,1999,14(4):15-16.
〔3〕谢宗万.中药材品种论述:中册〔M〕.上海:上海科学技术出版社,1984:68-81.
〔4〕李鹏.防风正品与伪品的鉴定〔J〕.甘肃医药,2013,32(6):467-468.
〔5〕李海涛,徐安顺,张丽霞,等.防风及其地方习用品种的性状与显微鉴别〔J〕.中药材,2013,36(12):1940-1942.
〔6〕王会如,张娜.防风与亳州移栽防风和一种伪品防风的比较〔J〕.首都医药,2002,9(4):56-57.
〔7〕郭朝民.防风与竹叶防风的鉴别〔J〕.河南中医药学刊,2002,17(5):9-10.
〔8〕宋美录,吕丽,李继红,等.药用防风及其近缘种的显微性状调查〔J〕.河北北方学院学报(自然科学版),2015,31(6):96-99.
〔9〕陈士林.中药DNA条形码分子鉴定〔M〕.北京:人民卫生出版社,2012:10.
〔10〕CHEN S L,YAO H,HAN J P,et al.Validation of the ITS2 region as a novel DNA barcode for identifying medicinal plant species〔J〕.PLoS ONE,2010,5(1):e8613.
〔11〕方海兰,夏从龙,段宝忠,等.基于DNA条形码的中药材种子种苗鉴定研究—以重楼为例〔J〕.中药材,2016,39(5):986-990.
〔12〕DUAN B Z,FANG H L,LI X W,et al.Survey of tradition⁃al Dai medicine reveals species confusion and potential safety concerns:a case study on Radix Clerodendri Japoni⁃cum〔J〕.Chin J Nat Med,2017,15(6):417-426.
〔13〕梅全喜,陈小露,向丽,等.艾叶的DNA条形码鉴定研究〔J〕.亚太传统医药,2017,13(7):3-9.
〔14〕尚飞能,方海兰,段宝忠.基于ITS2条形码和化学指纹鉴别何首乌及其伪品〔J〕.大理大学学报,2017,2(4):12-15.
〔15〕林好,钱洁颖,李斯璐,等.基于DNA条形码(ITS2)的中药材防风与其混伪品的鉴定〔J〕.中国当代医药,2016,23(15):4-7.
〔16〕HEBERT P D N,CYWINSKA A,BALL S L,et al.Biologi⁃cal identifications through DNA barcodes〔J〕.Proceedings of the Royal Society B:Biological Sciences,2003,270(1512):313-321.
〔17〕王建华,楼之岑.防风类药材的形态组织学研究(Ⅱ)〔J〕.北京医科大学学报,1991,23(1):54-58.
〔18〕王建华,楼之岑.防风类药材的形态组织学研究(Ⅰ)〔J〕.北京医科大学学报,1990,22(4):277-280.
〔19〕王建华,崔景荣,朱燕,等.防风及其地区习用品解热镇痛作用的比较研究〔J〕.中国医药学报,1989,4(1):20-22.

