离子强度对大豆11S球蛋白表面疏水性及结构的影响
齐宝坤,江连洲,王 欢,李 杨*
大豆蛋白不仅具有高营养价值,而且功能特性良好,常被应用于食品加工中[1]。大豆11S球蛋白是构成大豆蛋白的组分,由酸性亚基(A亚基)和碱性亚基(B亚基)组成,分子质量为300~380 kDa,以疏水性六聚体的形式存在,具有一定的刚性。酸性亚基和碱性亚基交互对应形成比较稳定的结构形式,通过二硫键连接而成[2],氢键和静电作用对大豆11S球蛋白整体结构的稳定具有重要的贡献。蛋白质分子和盐离子之间的相互作用是从分子水平上控制溶液中蛋白质的结构和功能性质,盐离子会使大豆蛋白溶液中离子-偶极和离子-离子之间的相互作用发生改变,从而使大豆蛋白的结构发生变化[3-5]。研究盐离子对蛋白质的空间结构和溶液性质的影响,有助于理解、设计和优化蛋白质在两相体系的分离以及蛋白质表达等与蛋白相关的生产加工过程。李向红等[6]研究离子强度对大豆分离蛋白热诱导聚集体的影响,研究表明离子的引入对大豆分离蛋白的表面电荷产生影响,电荷屏蔽作用使分子间静电斥力降低,促进了高离子强度条件下聚集体的产生。Mills等[7]研究指出大豆蛋白聚集体结构随环境中离子强度的升高发生明显改变。多数研究集中在离子强度对大豆分离蛋白功能特性的影响,而离子强度对大豆11S球蛋白空间结构、溶液性质和表面疏水性(H0)影响的研究鲜有报道。本实验对不同离子强度条件下大豆11S球蛋白溶解性、H0、Zeta电位、粒径进行测定,同时采用拉曼光谱技术对蛋白质的分子结构进行分析,探讨离子强度对大豆11S球蛋白H0及结构的影响,找寻不同离子强度条件下大豆11S球蛋白结构与H0的内在联系。在实际生产中,通过调整加工工艺条件对大豆蛋白产品实施定向操控,有效改善大豆蛋白的功能特性,为今后开发高稳定性和高功能性大豆蛋白、提高大豆蛋白的生产利用率提供重要的理论指导和技术支撑。
1 材料与方法
1.1 材料与试剂
东农46大豆,东北农业大学大豆研究所。
8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonate,ANS) 美国Sigma公司;Lowry法蛋白质含量测定试剂盒 上海荔达生物科技有限公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
Allegra X-15R低温高速离心机 美国Beckman公司;AKTA-蛋白质纯化仪 美国GE公司;F-4500荧光分光光度计 日本Hitachi公司;ZetaPALS-Zeta电位仪、ZetaPALS-激光粒度分析仪 美国布鲁克海文仪器公司;Raman Station 400拉曼光谱仪 美国PE公司。
1.3 方法
1.3.1 大豆11S球蛋白的制备
参考Nagano等[8]的方法。
大豆→脱皮→粉碎→过60 目筛→正己烷脱脂→脱脂大豆粉→与水混合(料液比1∶15(g/mL))→调节pH 7.5→提取2 h→离心分离(10 000×g,15 min)→上清液→添加亚硫酸钠(0.98 g/L)→提取1 h→调节pH 6.4→4 ℃过夜→离心分离(12 000×g,20 min)→沉淀→冻干→大豆11S球蛋白粗提物。
应用AKTA-蛋白质纯化仪和HiLoad 16/60 Superdex 200 prep grade凝胶制备级预装柱,对大豆11S球蛋白粗提物进行纯化,并进一步采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析蛋白质组成,通过光密度扫描测得大豆11S球蛋白纯度约为92%。
1.3.2 不同离子强度缓冲溶液的配制
向pH值为7.6、0.01 mol/L的柠檬酸-磷酸二氢钠缓冲液中添加不同质量浓度的NaCl溶液,配制离子强度分别为0、0.1、0.2、0.3、0.4、0.5和0.9的缓冲溶液,将配制好的缓冲液用0.45 μm水相滤膜过滤。在缓冲溶液的配制过程中,经测定离子强度有0.01的误差,可以忽略不计。
1.3.3 溶解性的测定
参考Samoto等[9]的方法。称取100 mg大豆11S球蛋白样品分散于10 mL的去离子水中,磁力搅拌30 min后,12 000×g离心20 min。上清液经适度稀释,采用Lowry法测定稀释后的上清液中蛋白质的含量,以牛血清白蛋白为标准物制作标准曲线。蛋白质的溶解度表示为上清液中蛋白质量与样品中总蛋白质量的比值。溶解性按下式计算:

1.3.4 H0的测定
采用ANS荧光探针法测定蛋白质H0[10]。将大豆11S球蛋白样品溶于0.01 mol/L磷酸盐缓冲液中配成10 mg/mL的蛋白溶液,室温条件搅拌1 h后在10 000×g条件下离心30 min,上清液用相同的磷酸盐缓冲液稀释至0.07~0.67 mg/mL(采用Lowry法测定蛋白浓度)。分别取不同质量浓度的样品溶液4 mL,加入8 mmol/L的ANS溶液40 μL,充分振荡混匀后静置3 min,测定样品的荧光强度。激发波长(λEx)为390 nm,发射波长(λEm)为470 nm,夹缝宽均为5 nm。以蛋白质质量浓度为横坐标,荧光强度为纵坐标作图,曲线初始斜率即为蛋白质的H0。
1.3.5 Zeta电位的测定
根据Zhao Chengbin等[11]的测定方法,采用ZetaPALSZeta电位仪测定大豆11S球蛋白溶液的Zeta电位。将11S球蛋白样品用缓冲液稀释至质量分数为0.2%,上样体积为1 mL。Zeta电位测定条件:聚苯乙烯池(1 cm)若干,铂电极(0.45 cm2,间距0.4 cm)一对。温度为25 ℃,温度平衡时间为2 min。
1.3.6 粒径分布的测定
根据李杨等[12]的测定方法,采用ZetaPALS-激光粒度分析仪测定大豆11S球蛋白的平均粒径分布。将11S球蛋白样品用磷酸缓冲液稀释至蛋白质量分数为0.2%的溶液。过0.45 μm水系醋酸纤维素滤膜,室温条件下测量。
1.3.7 拉曼光谱的测定
参考张萍等[13]的测定方法,将大豆11S球蛋白用缓冲溶液配制成质量浓度为100 mg/mL的溶液进行拉曼测定。激发光波长设定为785 nm,激光功率为300 mW,扫描范围为400~2 000 cm-1,每次扫描时间60 s,积分10 次,4 次扫描进行累加。拉曼图谱处理:谱图基线校正、谱峰查找采用ACD Labs V12软件,以苯丙氨酸(1 003±1)cm-1作为归一化因子,以此作为各拉曼峰强度变化的依据,得到不同条件下大豆11S球蛋白的拉曼光谱,采用Raman Spectral Analysis Package Version 2.1软件计算大豆11S球蛋白各结构的含量。
1.4 统计分析
每个样品重复3 次实验,ANOVA差异显著性分析利用SPSS V17.0软件完成,P值小于0.05为显著性差异,采用Origin 8.0软件作图。
2 结果与分析
2.1 离子强度对大豆11S球蛋白溶解性和H0的影响
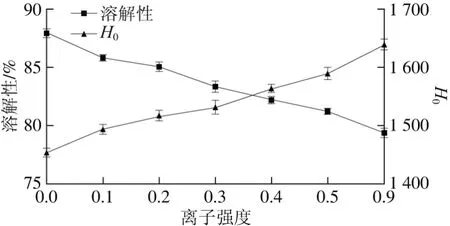
图1 离子强度对大豆11S球蛋白溶解性和H0的影响Fig. 1 Effect of ionic strength on the solubility and surface hydrophobicity of 11S glycinin
由图1可以看出,与未添加盐离子的大豆11S球蛋白相比,添加盐离子会使大豆11S球蛋白溶解性降低;随着离子强度的升高,大豆11S球蛋白的溶解性进一步降低,表现为“盐析”效应。出现这种现象的原因主要包括2 个方面:一是盐离子与环境中的水分子相互作用使大豆11S球蛋白与水分子相互作用相对减少,球蛋白分子表面的亲水基团与水分子之间的相互作用力减弱,这种盐离子与蛋白质分子之间的竞争性水合促使蛋白质分子间碰撞几率增加,使蛋白质分子间发生聚集,导致溶解性降低;另一方面是由于盐离子的引入屏蔽了蛋白质分子表面的电荷,减弱了蛋白质分子间静电排斥作用[14],使溶液稳定性下降,蛋白分子之间通过疏水相互作用发生聚集,这也是导致溶解性降低的重要原因。
与未添加盐离子的大豆11S球蛋白相比,添加盐离子会使大豆11S球蛋白H0增加;随着离子强度的升高,大豆11S球蛋白的H0进一步增加。在水溶液中大豆11S球蛋白分子内各种极性基团之间的氢键和静电相互作用不具备足够能量驱动蛋白分子发生折叠,蛋白质分子内非极性基团的疏水相互作用是驱动蛋白发生折叠的主要作用力,但是疏水相互作用不稳定,环境极性的改变会对疏水相互作用产生重要的影响。盐离子的添加使蛋白质的外部环境发生改变,破坏了蛋白质分子间的疏水相互作用[15],导致蛋白质空间结构变的松散,疏水性氨基酸残基暴露于蛋白质分子表面,从而使H0升高[16]。
2.2 离子强度对大豆11S球蛋白Zeta电位和平均粒径的影响
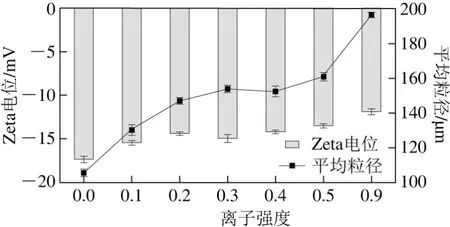
图2 离子强度对大豆11S球蛋白Zeta电位和平均粒径的影响Fig. 2 Effect of ionic strength on Zeta-potential and average particle size of 11S glycinin
盐离子的引入可以使蛋白溶液中带电微粒周围的电荷分布情况受到影响,致使大豆11S球蛋白溶液的Zeta电位发生改变。由图2可以看出,与未添加盐离子的大豆11S球蛋白相比,添加盐离子会使大豆11S球蛋白Zeta电位绝对值降低,这可能是由于盐离子的引入会使蛋白质分子表面的阳离子数量增多,引起大豆球蛋白分子表面扩散双电层被压缩,由于盐桥的作用,蛋白质内外的静电平衡会被打破,从而导致Zeta电位绝对值降低[17]。随着离子强度的增加,大豆11S球蛋白溶液的Zeta电位绝对值进一步降低,这也说明盐离子能够屏蔽大豆蛋白表面的电荷。张辉[18]研究了离子强度对大豆分离蛋白Zeta电位的影响,表明离子强度增加能够使大豆蛋白表面电荷受到屏蔽作用,这与本实验的研究结果一致。
H0是衡量蛋白质疏水作用的重要指标,而疏水作用是蛋白质聚集现象的主要作用力,这种聚集在一定程度上影响了蛋白质分子的平均粒径分布[19]。由图2可以看出,与未添加盐离子的大豆11S球蛋白相比,添加盐离子会使大豆11S球蛋白形成尺寸更大的颗粒。当离子强度从0.1升高至0.9时,大豆11S球蛋白的平均粒径也从130.2 μm增加至196.3 μm。这可能是由于随着离子强度的增加,环境中与大豆11S球蛋白分子竞争水合的盐离子越来越多,使得蛋白质与水分子间的相互作用减弱,球蛋白分子间的碰撞几率增加,球蛋白分子可能通过分子间的疏水相互作用和静电相互作用等聚集形成具有较大粒径的可溶性聚集物[20]。
结合溶解性和H0分析可知,大豆11S球蛋白是一种疏水基团包埋于分子内部,亲水基团暴露于分子外部的球状蛋白质,离子强度的升高引起静电屏蔽作用的增加,使蛋白质分子间的静电排斥力降低,从而促进蛋白质分子聚集[21]。同时高离子强度条件下蛋白分子的球状结构变得松散,分子内部的疏水性氨基酸残基暴露出来,导致大豆11S球蛋白的溶解性降低、H0增加。
2.3 不同离子强度条件下大豆11S球蛋白的拉曼光谱分析
拉曼光谱不仅可以提供蛋白质主链二级结构信息,同时还可以提供侧链的结构信息,尤其是色氨酸、酪氨酸微环境变化的信息[22]。如图3所示,由于拉曼光谱图中特征峰的强度与蛋白质中特定基团或化学键的数目成正比,如果特征峰的强度发生改变,则说明蛋白质分子中特性基团和化学键的数目发生了改变[23]。
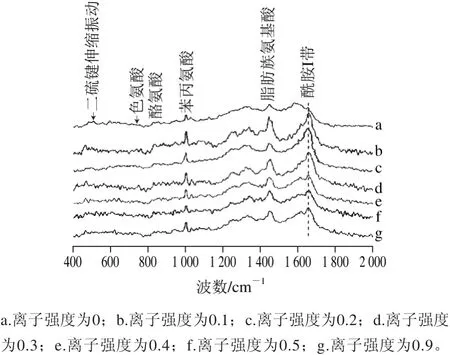
图3 不同离子强度条件下大豆11S球蛋白的拉曼光谱图Fig. 3 Raman spectra of 11S glycinin at different ionic strengths
2.3.1 不同离子强度条件下大豆11S球蛋白二级结构分析
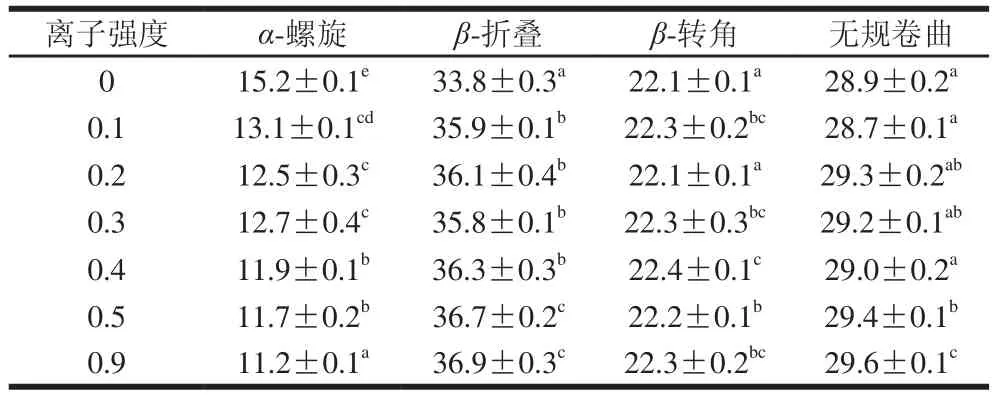
表1 酰胺I带拟合不同离子强度条件下大豆11S球蛋白二级结构含量Table 1 Secondary structure contents of 11S glycinins determined by curve fitting of Amide I bands at different ionic strengths%
采用Raman Spectral Analysis Package Version 2.1软件对大豆11S球蛋白的拉曼图谱二级结构进行定量计算,利用酰胺I带拟合不同离子强度条件下大豆11S球蛋白二级结构含量,结果如表1所示。随着离子强度的增加,大豆11S球蛋白二级结构中α-螺旋含量显著降低,β-折叠含量有所增加,β-转角和无规卷曲含量变化不显著。研究表明α-螺旋结构含量的变化与静电作用有关,而β-折叠结构的变化则与疏水作用相关[24]。α-螺旋结构是由蛋白质的羟基和氨基之间的氢键所维持的,在不同离子强度条件下氢键受到了一定的影响,同时高离子强度条件下蛋白质通过特殊的离子作用稳固偶极子而增强了疏水作用,导致蛋白质分子H0增强[25]。通过与H0变化规律相关性分析表明,大豆11S球蛋白H0与α-螺旋结构含量呈显著负相关(r=-0.799,P<0.05)。Kato等[26]对天然蛋白质与变性蛋白质的表面性质研究表明,蛋白质的H0与α-螺旋结构含量呈负相关,这与本实验的研究结果一致。
2.3.2 不同离子强度条件下大豆11S球蛋白氨基酸侧链分析
蛋白质拉曼光谱的850 cm-1和830 cm-1谱峰是酪氨酸残基的对位取代苯的有关振动,由于环的呼吸振动和面外弯曲倍频之间的费米共振,两谱峰成对出现。两峰的强度比(I850/I830)为费米共振线,可用来表征酪氨酸残基的包埋与暴露情况[27]。当I850/I830比值为0.3~0.5时,酪氨酸残基趋向于“包埋”态;当I850/I830比值为1.25~1.40时,酪氨酸残基趋向于“暴露”态;当0.5<I850/I830<1.25时,酪氨酸残基一部分暴露于蛋白质分子表面,一部分包埋在蛋白质内部。可根据I850/I830的值计算包埋在分子内部和暴露在分子表面的酪氨酸残基的分子数N[28]。由表2可以看出,酪氨酸费米共振线I850/I830比值在0.5~1.25范围内,随着离子强度的增加,I850/I830比值变化不显著。虽然N包埋略有增加,但是N暴露/N包埋显著增加,这表明随着离子强度的增加,大豆11S球蛋白的酪氨酸残基趋向于“暴露”态。
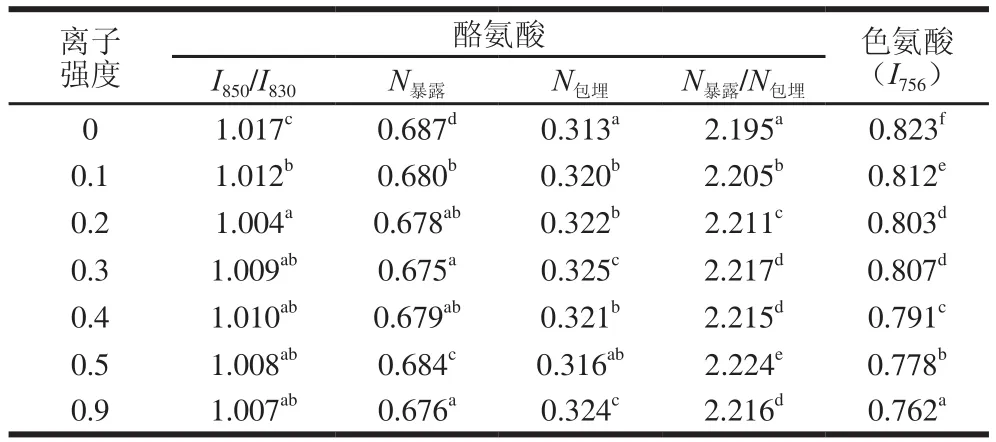
表2 不同离子强度条件下酪氨酸与色氨酸残基包埋/暴露情况Table 2 Embedding/exposure of tyrosine and tryptophan residues at different ionic strengths
756 cm-1附近的拉曼谱带归属为色氨酸侧链,色氨酸拉曼光谱强度(I756)可以反映色氨酸微环境的极性,色氨酸谱带的强度越小,表明越多的色氨酸残基由蛋白质分子内部暴露于分子表面。由表2可以看出,随着离子强度的增加,大豆11S球蛋白分子内的色氨酸残基拉曼光谱强度逐渐降低,这表明盐离子的添加使大豆11S球蛋白分子内的色氨酸残基暴露于分子表面,色氨酸残基从“包埋”态转变为“暴露”态,这与酪氨酸费米共振I850/I830的分析结果一致。这种氨基酸侧链的暴露可能是由于蛋白质空间结构展开引起的,从而导致H0的增加。
2.3.3 不同离子强度条件下大豆11S球蛋白二硫键分析
二硫键是大豆蛋白中的重要功能基团,对稳定蛋白质的空间结构起着关键作用。蛋白分子内二硫键的构型发生改变将对蛋白质的空间结构产生一定的影响,同时蛋白质的功能特性也随之改变[29]。天然蛋白的二硫键伸缩振动一般在500~510 cm-1范围内,即为g-g-g构型,如果在这个范围内的谱带强度减小或发生位移,在515~525 cm-1(g-g-t构型)和535~545 cm-1(t-g-t构型)出现拉曼特征峰,则意味着蛋白质分子中二硫键构型发生了改变[30]。为了研究离子强度对大豆11S球蛋白二硫键特征拉曼光谱峰强度和位置的影响,采用Peak Analyzer软件进行多峰值Guassina拟合,得到不同离子强度条件下大豆11S球蛋白二硫键构型相对含量的变化,结果如图4所示。不同离子强度条件下大豆11S球蛋白分子的二硫键构型发生了改变,随着离子强度的增加,大豆11S球蛋白中g-g-g构型和g-g-t构型呈降低趋势,而t-g-t构型逐渐增加,但在高离子强度条件下变化较小。结合不同离子强度条件下H0分析发现,随着离子强度的增加,大豆蛋白H0与g-g-g和g-g-t构型的二硫键含量呈负相关,而与t-g-t构型的二硫键含量呈正相关,这表明二硫键的构型可能会影响蛋白质的H0。
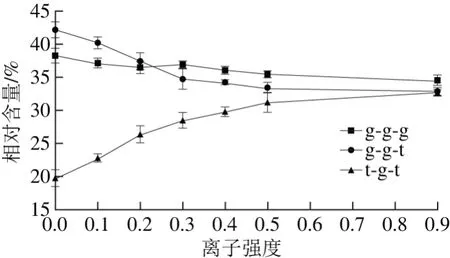
图4 不同离子强度条件下大豆11S球蛋白二硫键构型的变化Fig. 4 Conformational change of disulfide bond of 11S glycinin at different ionic strengths
3 结 论
随着离子强度(0~0.9)的增加,大豆11S球蛋白的溶解性降低,H0增加,Zeta电位绝对值降低,平均粒径增加。离子强度的升高引起静电屏蔽作用的增加,使蛋白质分子间的静电排斥力降低,从而促进蛋白质分子聚集。同时高离子强度条件下蛋白分子的球状结构变得松散,分子内部的疏水性氨基酸残基暴露出来,导致大豆11S球蛋白的溶解性降低、H0增加。拉曼光谱分析表明随着离子强度的增加,大豆11S球蛋白二级结构中α-螺旋含量降低,β-折叠含量增加,蛋白质的酪氨酸和色氨酸残基由“包埋”态转变为“暴露”态,这种变化可能是由于蛋白质空间结构展开引起的,从而导致H0的增加。不同离子强度条件下大豆11S球蛋白的二硫键构型发生了改变,二硫键构型的改变可能会影响蛋白质的H0。
参考文献:
[1] 魏冬旭, 江连洲, 王辰, 等. pH值对大豆11S球蛋白结构和表面疏水性的影响[J]. 食品科学, 2015, 36(11): 1-5. DOI:10.7506/spkx1002-6630-201511001.
[2] MUJOO R, TRINH D T, PKW N. Characterization of storage proteins in different soybean varieties and their relationship to tofu yield and texture[J]. Food Chemistry, 2003, 82(2): 265-273. DOI:10.1016/S0308-8146(02)00547-2.
[3] HAQUE Z Z, ARYANA K J. Effect of copper, iron, zinc and magnesium ions on bovine serum albumin gelation[J]. Food Science Technology Research, 2002, 8(1): 1-3. DOI:10.3136/fstr.8.1.
[4] SCHOKKER E P, SINGH H, PINDER D N, et al. Heat-induced aggreation of β-lactoglobulin AB at pH 2.5 as influenced by ionic strength and protein concentration[J]. International Dairy Journal,2000, 10(4): 233-240. DOI:10.1016/S0958-6946(00)00047-9.
[5] CLARK A H, KAVANAGH G M, ROSS-MURPHY S B. Globular protein gelation-theory and experiment[J]. Food Hydrocolloids, 2001,15(4): 383-400. DOI:10.1016/S0268-005X(01)00042-X.
[6] 李向红, 华欲飞, 刘展, 等. 不同离子强度大豆分离蛋白热诱导聚集体的研究[J]. 中国食品学报, 2010, 10(2): 104-109. DOI:10.3969/j.issn.1009-7848.2010.02.015.
[7] MILLS C, HUANG L, NOEL R, et al. Formation of thermally induced aggregates of the soya globulin β-conglycincin[J]. Biochemica et Biophysica Acta, 2001, 1547: 339-350. DOI:10.1016/S0167-4838(01)00199-6.
[8] NAGANO T, HIROTSUKA M, MORI H, et al. Dynamic viscoelastic study on the gelation of 7S globulin from soybeans[J]. Journal of Agricultural and Food Chemistry, 1992, 40(6): 941-944. DOI:10.1021/jf00018a004.
[9] SAMOTO M, MAEBUCHI M, MIYAZAKI C, et al. Abundant proteins associated with lecithin in soy protein isolate[J].Food Chemistry, 2007, 102(1): 317-322. DOI:10.1016/j.foodchem.2006.05.054.
[10] ZHAO C B, ZHOU L Y, LIU J Y, et al. Effect of ultrasonic pretreatment on physicochemical characteristics and rheological properties of soy protein/sugar Maillard reaction products[J]. Journal of Food Science and Technology, 2016, 53(5): 2342-2351. DOI:10.1007/s13197-016-2206-z.
[11] ZHAO C B, ZHANG H, XU X Y, et al. Effect of acetylation and succinylation on physicochemical properties and structural characteristics of oat protein isolate[J]. Process Biochemistry, 2017,57: 117-123. DOI:10.1016/j.procbio.2017.03.022.
[12] 李杨, 李秋慧, 王海晴, 等. 大豆蛋白-磷脂酶解物共建乳化体系性质研究[J]. 中国食品学报, 2015, 15(11): 41-47. DOI:10.16429/j.1009-7848.2015.11.007.
[13] 张萍, 郑大威, 刘晶, 等. 基于表面增强拉曼光谱技术的豆芽6-BA残留快速检测方法[J]. 光谱学与光谱分析, 2012, 32(5): 1266-1269.DOI:10.3964/j.issn.1000-0593(2012)05-1266-04.
[14] LI X, CHENG Y, YI C, et al. Effect of ionic strength on the heatinduced soy protein aggregation and the phase separation of soy protein aggregate/dextran mixtures[J]. Food Hydrocolloids, 2009, 23:1015-1023. DOI:10.1016/j.foodhyd.2008.07.024.
[15] RENKEMA J M S, GRUPPEN H, VANVLIET T J. Influence of pH and ionic strength on heat-induced formation and rheological properties of soy protein gels in relation to denaturation and their protein compositions[J]. Journal of Agricultural & Food Chemistry,2002, 50(21): 6064-6071. DOI:10.1021/jf020061b.
[16] MORZEL M, GATELLIER P, SAYD T, et al. Chemical oxidation decreases proteolytic susceptibility of skeletal muscle myofibrillar proteins[J]. Meat Science, 2006, 73(3): 536-543. DOI:10.1016/j.meatsci.2006.02.005.
[17] SYRBE A, BAUER W J, KLOSTERMEYER H. Polymer science concepts in dairy systems: an overview of milk protein and food hydrocolloid interaction[J]. International Dairy Journal, 1998, 8:179-193. DOI:10.1016/S0958-6946(98)00041-7.
[18] 张辉. 离子强度对大豆分离蛋白结构及表面疏水性的影响[J]. 食品工业科技, 2016, 37(8): 145-149. DOI:10.13386/j.issn1002-0306.2016.08.021.
[19] YOSHIKO M, YOSHIE K, KUNIO T. Protective effect of small amounts of sodium dodecyl sulfate on the helical structure of bovine serum albumin in thermal denaturation[J]. Journal of Colloid and Interface Science, 2003, 257(1): 41-46. DOI:10.1016/S0021-9797(02)00017-6.
[20] GRUNE T, JUNG T, MERKER K, et al. Decreased proteolysis caused by protein aggregates, inclusion bodies, plaques, lipofuscin, ceroid,and ‘aggresomes’ during oxidative stress, aging, and disease[J].International Journal of Biochemistry & Cell Biology, 2004, 36(12):2519-2530. DOI:10.1016/j.biocel.2004.04.020.
[21] ZHAO C B, WU F, LI Y P, et al. Effects of β-glucans on properties of soya bean protein isolate thermal gels[J]. International Journal of Food Science and Technology, 2015, 50(2): 347-355. DOI:10.1111/ijfs.12635.
[22] 伍林, 欧阳兆辉, 曹淑超, 等. 拉曼光谱技术的应用及研究进展[J]. 光散射学报, 2005, 17(2): 180-186. DOI:10.3969/j.issn.1004-5929.2005.02.013.
[23] 柯惟中, 余多慰, 陈婉蓉, 等. 热处理和紫外辐射DNA影响的拉曼光谱研究[J]. 光学学报, 1997, 17(12): 1681-1683.
[24] PRZYBYCIEN T M, BAILEY J E. Secondary structure perturbations in salt-induced protein precipitates[J]. Biochimica et Biophysica Acta,1991, 1076(1): 103-111. DOI:10.1016/0167-4838(91)90226-P.
[25] SREERAMA N, VENYAMINOV S Y U, WOODY R W. Estimation of the number of α-helical and β-strand segments in proteins using circular dichroism spectroscopy[J]. Protein Science, 1999, 8(2): 370-380. DOI:10.1110/ps.8.2.370.
[26] KATO A, NAKAI S. Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J]. Biochemica et Biophysica Acta, 1980, 624(1): 13-20.DOI:10.1016/0005-2795(80)90220-2.
[27] ELLEPOLAA S W, CHOIB S M, PHILLIPSC D L, et al. Raman spectroscopic study of rice globulin[J]. Journal of Cereal Science,2006, 43(1): 85-93. DOI:10.1016/j.jcs.2005.06.006.
[28] ICONOMIDOU V A, CHRYSSIKOS D G, GIONIS V, et al.Secondary structure of chorion proteins of the teleostean fish Dentex dentex by ATR FT-IR and FT-Raman spectroscopy[J].Journal of Structural Biology, 2000, 132(2): 112-122. DOI:10.1006/jsbi.2000.4307.
[29] CIMPOIU C, CASONI D, HOSU A. Separation and identification of eight hydrophilic vitamins using a new TLC method and Raman spectroscopy[J]. Journal of Liquid Chromatography and Related Technologies, 2005, 28(16): 2551-2559.DOI:10.1080/10826070500189737.
[30] TSUNURA K, ENATSU M, KURAMORI K, et al. Conformational change in a single molecular species, β3 of β-conglycinin in acidic ethanol solution[J]. Bioscience Biotechnology & Biochemistry, 2001,65(2): 292-297. DOI:10.1271/bbb.65.292.

