急性出血性卒中致心电图改变研究
孙楠 梅勇 王德国 王安才
既往的临床研究发现,在急性卒中发生发展过程中往往伴随着心电图或心肌酶谱的改变[1-2],现已将这些改变列为脑心综合征的研究范畴[3]。在临床中,急性出血性卒中较易合并脑心综合征,且脑心综合征所致的异常心电图呈多样化,包括QTc间期延长、T波改变、ST段改变等复极异常,也涵盖了房性早搏、室性早搏、传导阻滞等一系列心律失常[4]。但对如QTc间期延长等复极异常所致的不良预后并没有系统的对比研究。本研究旨在探讨急性出血性卒中发生部位及相应的心电图异常间的关系,并对颅脑不同部位、不同形式出血所致的QTc间期延长等常见复极异常做进一步研究分析,以提高临床医生对患者预后的判断准确率。
1 资料和方法
1.1 一般资料
收集皖南医学院弋矶山医院2017年1月至2018年2月收治的156名急性出血性卒中患者,其中男96例,女60例,平均(61.96±11.57)岁,平均发病病程在10 h内,急诊送入我院。排除标准:既往心、肝、肾等重要脏器疾病史,既往心律失常病史,与电解质紊乱相关的异常心电图,脑肿瘤病史。其中头颅CT提示脑干出血13例,自发性蛛网膜下腔出血19例,小脑出血9例,丘脑出血24例,基底节出血44例,脑叶出血25例,创伤性蛛网膜下腔出血22例。
1.2 方法
所有患者入院后在发病病程24 h内完善头颅CT及12导联心电图检查,并常规予以血常规、血生化等相关检查,排除因肝、肾功能异常导致的血钾(K+<3.50 mmol/L或>5.3 mmol/L)、血钠(Na+<135 mmol/L或>147 mmol/L)、血钙(Ca2+<1.9 mmol/L或>2.5 mmol/L)等电解质紊乱,排除因电解质紊乱所致的心电图异常。
1.3 判断标准
根据《心电图标准化和解析的建议和临床应用国际指南2009》[5],心电图P波增宽的定义为,测量P波形态清晰的Ⅰ、Ⅱ、V1导联上P波与等电位线交点两次交点间的距离,将测量最大值设为P波宽度,P波时限>0.12 ms判断为P波增宽;QRS波增宽以T-P为等电位线,QRS波时限>120 ms为纳入标准;T波异常包括T波低平(T波振幅小于同导联R波振幅的1/10)、倒置(Ⅰ、Ⅱ、aVL、V2~V6导联T波振幅<0.1 mV)、高尖(以R波为主的肢体导联T波振幅绝对值>0.6 mV,胸导联>1.0 mV)、双峰等;ST段改变包括压低(任意导联ST段下压>0.5 mV)和抬高(V2、V3导联ST段抬高≥0.2 mV,其他导联≥0.1 mV);QT间期延长以计算按心律校正后的QT间期(QTc),≥440 ms为纳入标准,新出现或既往未知的Q波(Q≥0.04 s,Q≥R/4);窦性心律失常包括窦性心动过速、窦性心动过缓、窦性心律不齐等;房性心律失常包括房颤、房扑、房性早搏等;室性心律失常包括室速、室早等。
1.4 统计学方法
数据分析采用SPSS 20统计软件,计数资料以百分率表示,组间比较采用χ2检验或Fisher确切概率法,P<0.05为差异有统计学意义。
2 结果
2.1 134例急性自发出血性卒中患者心电图异常率
在134例自发颅内出血性卒中患者中,有104例出现心电图异常,其中脑干出血12例(92.31%),自发性蛛网膜下腔出血18例(94.74%),小脑或丘脑出血26例(78.79%),基底节出血35例(79.55%),脑叶出血13例(52.00%)。与脑叶出血进行比较,差异有统计学意义(P<0.05)。见表1。

表1 134例急性自发出血性卒中心电图异常率
*:与脑叶出血心电图异常发生率比较
2.2 急性出血性卒中心电图改变情况及不同出血方式中复极异常发生率
急性出血性卒中的心电图异常包括QTc间期延长、ST段改变、T波异常、异常Q波等复极改变,也出现了窦性心动过速、窦性心动过缓、房颤、房性早搏、室性早搏、房室传导异常等不同形式的心律失常。不同部位出血心电图异常的表现形式具有多样性,且患者可合并多种类型的心电图异常形式,故心电图异常累计频数可大于例数(表2)。在156例急性出血性卒中患者中,较多出现了ST段异常,其中134例自发出血性卒中患者中有44例(32.84%);22例创伤性出血性卒中患者中有2例(9.09%),两者比较,差异有统计学意义(P<0.05)。T波异常在156例急性出血性卒中患者中同样较为常见,其中134例自发出血性卒中患者中,有34例(25.37%);22例创伤性出血性卒中患者中有1例(4.55%),两者比较差异有统计学意义(P<0.05)。在134例自发出血性卒中患者中,8例(5.97%)出现了异常Q波,22例创伤性出血患者中1例(4.55%)出现了异常Q波,两者比较差异无统计学意义(P>0.05)。在对QTc间期延长发生率的对比研究中发现,自发性出血患者中54例(40.30%),创伤性出血患者中9例(40.91%)出现了QTc间期延长,两者比较差异无统计学意义(P>0.05)。见表3。

表2 急性出血性卒中心电图改变情况

表3 不同出血方式中复极异常发生率
2.3 不同部位卒中QTc间期延长发生率
在自发出血性卒中导致的心电图异常表现中,较多出现了QTc间期延长,其中脑干出血为7例(58.33%),自发性蛛网膜下腔出血12例(66.67%),小脑或丘脑出血14例(53.85%),基底节出血18例(51.43%),脑叶出血3例(23.08%)。自发性蛛网膜下腔出血与脑叶进行比较,差异有统计学意义(P<0.05)。见表4。
2.4 自发性蛛网膜下腔出血与创伤性蛛网膜下腔出血心电图异常及QTc间期延长发生率
将19例自发性蛛网膜下腔出血患者与22例创伤性蛛网膜下腔出血患者进行对比研究发现,自发性蛛网膜下腔出血患者中18例(94.74%)出现心电图异常;创伤性蛛网膜下腔出血患者中9例(40.91%)出现心电图异常,差异有统计学意义(P<0.05)。见表5。对两者QTc间期做对比研究发现,自发性蛛网膜下腔出血患者中12例(66.67%)出现QTc间期延长;创伤性蛛网膜下腔出血患者中5例(55.56%)出现QTc间期延长,差异无统计学意义(P>0.05)。见表6。

表4 不同部位卒中QTc间期延长发生率
*:与脑叶出血QTC间期延长比较
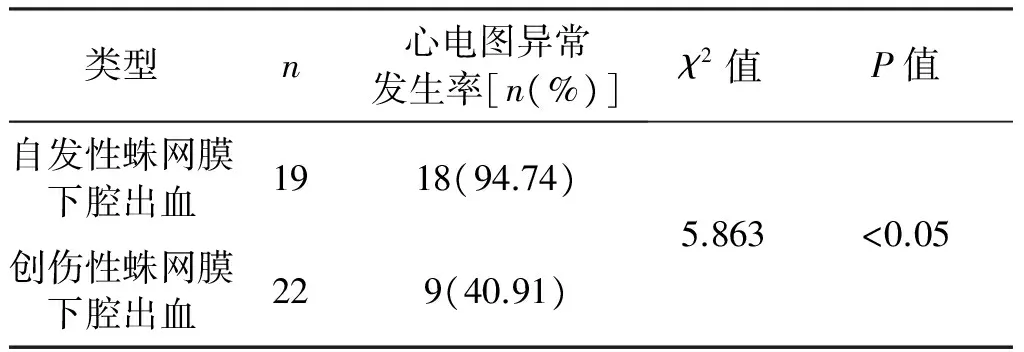
表5 自发性蛛网膜下腔出血与创伤性蛛网膜下腔出血心电图异常率

表6 自发性蛛网膜下腔出血与创伤性蛛网膜下腔出血QTc间期延长发生率
3 讨论
本研究主要是针对24 h内发生的急性出血性卒中所致的心电图改变,对134例急性自发出血性卒中的研究发现,有104例患者出现心电图异常,发生率为77.61%。在急性出血性卒中中,由于脑室积血会导致颅内压增高[6],压迫具有正常功能的心血管调节中枢,且病灶周围由于缺血水肿产生的炎性介质会干扰大脑正常功能[7],在卒中急性期,机体处于应激状态,产生大量肾上腺素、去甲肾上腺素等儿茶酚胺类物质,导致血管痉挛,并对心肌进一步产生毒性作用[8-9],导致心肌复极、电传导、节律等的异常,且出血部位与心电图异常发生率有一定关系。本研究发现脑叶出血心电图异常率最低,脑干及自发性蛛网膜下腔出血患者心电图异常率较高,且较易合并多种复极异常表现,分析考虑,脑干是生命中枢,心血管调节的高级中枢位于脑干等大脑中轴线部位[10]。这也进一步阐明了卒中发生部位的功能决定了脑心综合征的发生率。
在急性出血性卒中所致的心电图异常改变中,提示心肌复极异常的改变较为常见[11],例如ST段改变、T波异常、QTc间期延长、异常Q波,心室肌复极异常往往会导致更为严重的心律失常,预后通常不佳[12]。在对自发性出血和创伤性出血患者的对比研究中发现,自发性出血患者较易出现ST段改变和T波异常,且差异有统计学意义。考虑自发性出血患者通常合并高血压、高脂血症等慢性疾病,心肌存在潜在供血不足,在颅脑出血等应激状态下更易出现冠状血管痉挛、收缩、微小血栓形成或应激状态下需氧与供氧不平衡等,这与急性心梗的发生有共同的病理生理基础[13]。但本研究中发现,在不同的出血方式下QTc间期延长发生率比较,差异没有统计学意义。由于本次收集病例有限,对异常Q波及U波未充分完成对照研究。在既往的研究中也发现,急性出血性脑血管疾病发生中可伴随急性心肌梗死的发生,以蛛网膜下腔出血为主[14]。本研究中未出现类似情况,可能与本次收集样本数据较少有关。
由于对心电图QT间期的测量往往会受心室率的影响,故本研究采用经心率校正后的QT间期(QTc)作为研究对象。在急性出血性卒中病例中,大脑中线部位(脑干、小脑、丘脑、基底节)出血更易出现QTc间期延长,其中蛛网膜下腔出血患者更为常见。在后续心电图复查中发现,部分患者QTc间期较急性发病24 h内心电图有所恢复,进一步说明QTc间期往往提示预后[15]。
对自发性蛛网膜下腔出血和创伤性蛛网膜下腔出血的对比研究发现,自发性蛛网膜下腔出血更易出现心电图异常,考虑自发性蛛网膜下腔出血患者往往合并有颅内动脉瘤,动脉瘤破裂导致蛛网膜下腔出血[16],出血面积、出血量往往较大,而创伤性蛛网膜下腔出血一般为剧烈外伤导致颅脑挤压、挫裂所致,出血面积和出血量不及动脉瘤破裂[17]。但在本次关于两者QTc间期对比研究中并未发现两者有明显差异,表明蛛网膜下腔出血无论自发性还是创伤性均较易致心肌复极异常,且在临床中,蛛网膜下腔出血预后较差,对合并有心电图复极异常的患者更应加强监测[18]。
在急性出血性卒中患者中较易合并脑心综合征,患者由于原发疾病所致,可出现言语功能障碍,无法描述症状,所以入院24 h内应常规予以完善心电图检查,必要时完善心肌酶谱、肌钙蛋白检查,对心电图异常患者应加强监测。合并心电图复极异常的患者往往预后较差,所以对合并有ST段异常、T波改变、异常Q波及QTc间期延长等更应予以足够重视,对原发病灶及心电图应予以动态监测,以降低住院死亡率并改善出院预后。
[1] Qaqa AY,Suleiman A,Alsumrain M,et al. Electrocardiographic abnormalities in patients presenting with intracranial parenchymal haemorrhage[J]. Acta Cardiol,2012,67(6): 635-639.
[2] Parekh N,Venkatesh B,Cross D,et al. Cardiac troponin I predicts myocardial dysfunction in aneurysmal subarachnoid hemorrhage[J]. J Am Coll Cardiol,2000,36(4): 1328-1335.
[3] 黄丽嫦,谢再汉,舒予静,等. 急性脑血管病致脑心综合征心电图改变的临床分析[J]. 齐齐哈尔医学院学报,2015(20): 2986-2987.
[4] Huang CC,Huang CH,Kuo HY,et al. The 12-lead electrocardiogram in patients with subarachnoid hemorrhage: early risk prognostication [J]. Am J Emerg Med,2012,30(5): 732-736.
[5] 中国心电学会.心电图标准化和解析的建议与临床应用国际指南[M].北京:中国环境科学出版社,2009.
[6] Milewska A,Guzik P,Rudzka M,et al. J-wave formation in patients with acute intracranial hypertension[J]. J Electrocardiol,2009,42(5): 420-423.
[7] Wu X,Jiang H,Yu L,et al. Desipramine pretreatment improves sympathetic remodeling and ventricular fibrillation threshold after myocardial ischemia[J]. J Biomed Biotechnol,2012,2012(3): 732-909.
[8] Wybraniec MT,Mizia-Stec K,Krzych. Neurocardiogenic injury in subarachnoid hemorrhage: a wide spectrum of catecholamin-mediated brain-heart interactions[J]. Cardiol J,2014,21(3): 220-228.
[9] Inamasu J,Sugimoto K,Yamada Y,et al. The role of catecholamines in the pathogenesis of neurogenic pulmonary edema associated with subarachnoid hemorrhage[J].Acta Neurochir(Wien),2012,154(12): 2179-2184.
[10] 李敬,李颖,姜瑞博,等.脑干出血并发脑心综合征心律失常与儿茶酚胺浓度的临床分析[J].中国现代医学杂志,2016,26(23): 59-62.
[11] Bobinger T,Kallmünzer B,Kopp M,et al. Prevalence and impact on outcome of electrocardiographic early repolarization patterns among stroke patients: a prospective observational study[J]. Clin Res Cardiol,2015,104(8): 666-671.
[12] Levis JT.ECG diagnosis: deep T wave inversions associated with intracranial hemorrhage[J]. Perm Journal,2017,21:16-49.
[13] King C. Listening to the head and not the heart: subarachnoid haemorrhage associated with severe acute left ventricular failure[J]. BMJ Case Rep,2013.
[14] Köklü E,Yüksel Ö,Bayar N,et al. Subarachnoid hemorrhage that electrocardiographically mimics acute coronary syndrome: a case report[J]. Turk Kardiyol Dern Ars,2015,43(8): 730-733.
[15] Soliman EZ,Howard G,Cushman M,et al. Prolongation of QTc and risk of stroke : the REGARDS (REasons for Geographic and Racial Differences in Stroke) Study[J]. J Am Coll Cardiol,2012,59(16): 1460-1467.
[16] Ibrahim GM,Macdonald RL.Electrocardiographic changes predict angiographic vasospasm after aneurysmal subarachnoid hemorrhage[J]. Stroke,2012,43(8): 2102-2107.
[17] 徐春华. CT对创伤性和动脉瘤性蛛网膜下腔出血的鉴别诊断价值[J].中外医学研究,2016,14(35): 68-69.
[18] Elsharkawy H,Abdelsayed A,El-Hadi S,et al. Fluctuating electrocardiographic changes predict poor outcomes after acute subarachnoid hemorrhage[J]. Ochsner J,2016,16(3): 225-229.

