驯化对始红蝽(Pyrrhocoris apterus)耐寒能力的影响及越冬适应策略
曹凯丽,王芳艳,胡 敏,吾尔买提·达吾提,Roman Jashenko,季 荣,*
1 新疆师范大学生命科学学院,新疆特殊环境物种多样性保护与调控重点实验室,中亚区域跨境有害生物联合控制国际研究中心,乌鲁木齐 830054 2 新疆于田县草原站,和田 848400 3 哈萨克斯坦共和国教育科学部动物研究所,阿拉木图 050060
昆虫的耐寒性是指其长期或短期暴露于低温条件下的存活能力[1],耐寒能力可以通过过冷却点(supercooling point,SCP)、低温存活率和半致死温(LT50)度等指标评价[2- 3]。研究表明,昆虫的耐寒能力存在可塑性,驯化作为一种有效提高昆虫耐寒能力的途径,是昆虫应对不良环境的一种过程和表现,短时或持续低温驯化可明显降低昆虫的过冷却点,提高低温存活率,降低半致死温度,是昆虫耐寒性理论研究与应用研究的热点[4-6]。
始红蝽(PyrrhocorisapterusL.),属于半翅目红蝽科,广泛分布于地中海沿岸、东亚和中亚地区,具有较强的适应性[7]。始红蝽以滞育成虫在植被覆盖下的地表越冬,越冬前聚集行为明显,呼吸速率和能量代谢减慢,呼吸代谢水平降低[8-9];研究报道,越冬期间始红蝽的过冷却点为-14.5℃[10]。新疆冬季寒冷,平均温度为-8.93℃,极端温度达到-30℃以下[11-12],广泛分布于新疆的始红蝽种群如何应对低温胁迫及其越冬策略值得探讨。本研究通过逐月测定低温驯化后越冬期始红蝽过冷却点和低温存活率,分析自然种群体内耐寒物质含量,旨在阐明其耐寒能力变化及越冬适应策略。
1 材料与方法
1.1 试虫采集与处理
根据季节变化和新疆气候变化特征,当年12月至翌年3月从室外(43°51′N,87°34′E)采集始红蝽个体,室内静置30min,待其恢复爬行能力后挑选健康成虫测试。室外采集时现场测量地表温度。
1.2 驯化对始红蝽过冷却点的影响
基于新疆冬季平均气温,设置-5、-10、-15℃ 3个驯化温度(因-15℃下,始红蝽存活率最高仅为10%,有的为零,不具有统计学意义,故未分析其数据)。将试虫放入锥形瓶中,置于已调至所需温度的节能型智能恒温槽(DC- 2015,宁波新芝)中驯化30min,25℃(±3℃)恢复30min后将过冷却点仪(MS6501,东莞华仪)的热电偶探头置于试虫前翅下,以1℃/min速率降温,放入-80℃冰箱(MDF-C8,日本三洋)中逐只测试。每个驯化温度每次测定30只,重复3次。以同月未经驯化的始红蝽为对照组。
1.3 驯化对始红蝽低温存活率及LT50的影响
将试虫于0℃下30min驯化后分别置于-5、-10、-15℃下1h,25℃(±3℃)恢复30min后检查存活个体,以能够正常爬行视为存活,统计低温存活率,并根据逻辑斯蒂曲线方程计算0℃驯化前后始红蝽的半致死温度(LT50)。每个温度测试30只,重复3次,以同月未经驯化的始红蝽为对照组。
1.4 越冬期间始红蝽耐寒物质含量测定
越冬期间逐月采集始红蝽自然种群,分别采用张徐等[13]和李爽等[14]方法测定自由水/结合水比值、脂肪、甘油、海藻糖和游离蛋白质的含量,根据测定指标分别取始红蝽雌雄虫粉不少于0.1g或成虫不少于20只(♀∶♂=1∶1),重复3次。
1.5 数据分析
分别用单因素方差分析(ANOVA)和最小显著差数法(LSD)多重比较分析不同驯化温度始红蝽过冷却点与低温存活率的差异显著性(P<0.05);不同月份同一性别采用ANOVA、LSD和多范围检验(Duncan′s)分析耐寒物质差异显著性(P<0.05);相同月份不同性别采用独立样本T检验分析耐寒物质差异显著性(P<0.05),数据分析采用SPSS 19.0软件。
2 结果与分析
2.1 驯化对始红蝽过冷却点的影响
图1结果表明,低温驯化能明显降低始红蝽的过冷却点,且降低程度与驯化温度有关。12月至3月均以-10℃驯化效果最明显,其中1月过冷却点最低,对照组与驯化组过冷却点平均分别为(-13.93±1.35)℃、(-25.56±1.09)℃,差异显著(P<0.05);12月驯化效果最不明显,驯化前后过冷却点平均分别为(-14.01±0.53)℃、(-17.19±1.28)℃,且差异显著(P<0.05)。
-5℃驯化以2月驯化效果最明显,驯化前后过冷却点平均分别为(-11.47±0.58)℃、(-17.66±0.77)℃,差异显著(P<0.05);12月驯化效果最不明显,驯化前后过冷却点平均分别为(-14.01±0.53)℃、(-16.97±1.01)℃,差异显著(P<0.05)。
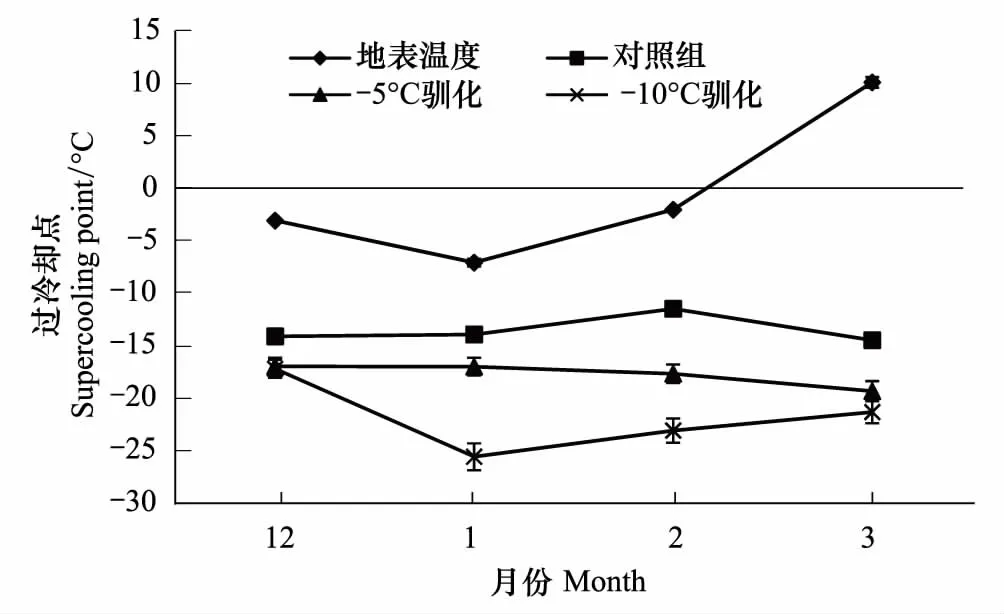
图1 越冬期间驯化对始红蝽过冷却点的影响 Fig.1 The effect of cold acclimation on the supercooling point of Pyrrhocoris apterus over winter period
未经驯化的对照组以3月过冷却点最低,平均为(-14.47±0.76)℃,-5、-10℃驯化后分别下降至(-19.32±0.86)℃、(-21.31±0.85)℃,驯化前后差异显著(P<0.05)。
从图1看出,越冬期间驯化组及自然种群始红蝽的过冷却点均低于地表温度,其中1月地表温度最低,为(-7.08±0.05)℃。
2.2 驯化对始红蝽低温存活率和半致死温度的影响
由表1可知,低温驯化能明显提高始红蝽的低温存活能力。越冬期间12月至3月驯化组的存活率均大于对照组,0℃驯化置于-5℃暴露1h,12月的平均存活率为89.70%±3.69%,与对照组56.67%±3.33%之间差异显著(P<0.05);1月和2月的平均存活率分别由驯化前的96.67%±3.33%、98.89%±1.11%提高到100.00%,驯化前后存活率无显著差异(P>0.05);3月平均存活率由驯化前43.75%±3.33%上升至100.00%,驯化前后存活率差异显著(P<0.05)。
0℃驯化后置于-10℃暴露1h,12月的平均存活率最低,为31.06%±1.33%,与对照组13.64%±2.82%之间差异显著(P<0.05);1月的平均存活率最高,为39.06%±1.11%,与对照组8.89%±1.11%之间差异显著(P<0.05);0℃驯化-15℃后暴露1h,始红蝽自然种群及12月驯化组的存活率均为零,2月驯化组平均存活率最高,仅为10.00%。
由表2可知,低温驯化可降低始红蝽的LT50。越冬阶段12月至3月,0℃驯化后始红蝽的LT50均低于自然种群,其中驯化前2月LT50最低,为-8.53℃,驯化后降至为-9.12℃。
2.3 越冬期间始红蝽耐寒物质含量的变化
由表3可知,越冬期间雌雄始红蝽体内自由水/结合水比值和游离蛋白质含量先下降后上升,12月达到最大,雌雄分别为144.50±26.22和140.32±21.92,(15.81±0.10)mg/g和(15.47±0.01)mg/g,2月降至最低,雌雄分别为90.55±16.90和90.14±1.64,(15.46±0.20)mg/g和(14.96±0.02)mg/g,之后开始上升。不同月份相同性别自由水/结合水比值和游离蛋白质含量均无显著差异(P>0.05),相同月份雌雄之间自由水/结合水比值无显著差异(P>0.05),2月雌雄之间游离蛋白质含量差异显著(P<0.05)。
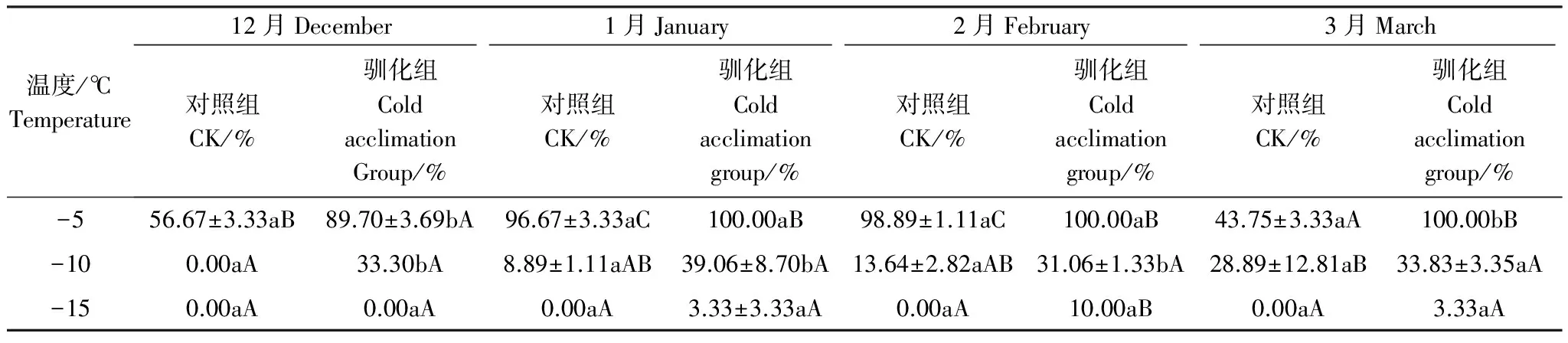
表1 越冬期间驯化对始红蝽低温存活率的影响
表中数据为平均值±标准误;数据后不同小写字母表示相同月份对照组与驯化组差异显著(P<0.05);数据后不同大写字母表示相同处理下不同月份差异显著性(P<0.05, 最小显著差数法LSD和Duncan氏检验)

表2 越冬期间驯化对始红蝽半致死温度的影响
雌雄始红蝽体内脂肪、海藻糖和甘油含量先上升后下降,2月达到最大,雌雄脂肪含量分别为(16.33±0.48)mg/g和(13.15±1.31)mg/g,海藻糖含量分别为(11.98±0.01)mg/g和(10.88±0.02)mg/g,甘油含量分别为(14.73±0.01)mg/g和(15.06±0.03)mg/g,各月之间雌雄体内海藻糖和甘油含量差异均显著(P<0.05)。雌雄脂肪含量最小值分别在12月和3月,依次为(9.97±0.03)mg/g和(9.52±1.74)mg/g,雌雄海藻糖和甘油含量最小值均在3月,分别为(7.82±0.01)mg/g和(8.42±0.05)mg/g,(15.98±0.09)mg/g和(15.34±0.02)mg/g。雌虫脂肪含量2月与其他月之间差异显著(P<0.05),2月雄虫脂肪含量与3月差异显著(P<0.05),与其他月份之间无显著差异(P>0.05)。
表中数据为平均值±标准误;不同小写字母表示同一性别不同月份差异显著(P<0.05,最小显著差数法LSD和Duncan氏检验);数据后不同大写字母表示相同月份雌雄差异显著(P<0.05,独立样本T检验)
3 结论与讨论
3.1 驯化对始红蝽耐寒能力的影响
根据过冷却点可将昆虫的耐寒性对策分为不耐结冰型(freezing intolerant)和耐结冰型(freezing tolerant),前者通过降低过冷却点适应低温环境,后者则在一定范围内能够忍受细胞外液结冰造成的伤害[15],本研究得出始红蝽属于不耐结冰型,并且同许多不耐结冰型昆虫一样在高于过冷却点的温度下迅速死亡[4,16-17]。如3月份始红蝽自然种群的过冷却点最低为(-14.47±0.76)℃,但将其置于-10℃下的存活率仅为28.89%±12.81%,因此,同样不能将过冷却点作为衡量始红蝽耐寒性的唯一指标。
驯化可明显降低始红蝽的过冷却点,提高其低温存活率和耐寒能力。本试验结果发现,3月始红蝽自然种群经过-5、-10℃驯化后,其过冷却点分别由驯化前的(-14.01±0.53)℃下降为(-16.97±1.01)℃、(-17.19±1.28)℃,-5℃暴露下存活率由43.75%±3.33%上升到100.00%。这与西花蓟马(Frankliniellaoccidentalis)、椰心叶甲 (Brontispalongissima)等昆虫研究结果一致[5- 6,13]。因此,自然界中始红蝽经过秋季到冬季的低温驯化过程后,其耐寒能力大幅度增强以确保其安全越冬。
根据过冷却点、低温存活率和LT50综合判断,越冬期间始红蝽自然种群以3月耐寒能力最强,低温驯化后则以1月最强。分析原因与新疆气候特征有关系,3月易发生“倒春寒”天气[18],自然种群须有较强的耐寒能力才能安全度过异常气候以维持种群数量,但1月气温和地表温度最低,始红蝽经过秋季和初冬的自然驯化后获得较强的耐寒能力有助于其安全越冬,这亦是始红蝽长期适应环境的结果。
3.2 始红蝽耐寒策略及其适应变化
为适应低温环境,寒带和温带的昆虫在长期进化过程中主要形成了两类耐寒策略,即生态适应策略和生理适应策略[19-20]。为安全越冬,始红蝽越冬多选择在背风、阳面或锦葵(MalvasinensisC.)的根部[7-8],聚集行为明显,越冬过程中通过累积小分子糖醇,调整呼吸代谢的强度及底物类型以提高虫体耐寒能力[9-10]。与亚洲玉米螟(Ostriniafurnacalis)、赤松毛虫(Dendrolimusspectabilis)越冬幼虫和桑尺蠖(Phthonandriaatrilineata)越冬幼虫等研究结果类似[21- 23],本研究得出,越冬期间始红蝽体内自由水/结合水比值降低,自由水被排出体外或转化为结合水,这有助于提高虫体血淋巴的溶质浓度,降低过冷却点[24-25]。越冬期间始红蝽体内蛋白质含量减少,可能与其转化为抗冻保护剂有关[26],这与蒲氏钩蝠蛾(Thitarodespui)、大草蛉(Chrysopapallens)预蛹和绿盲蝽(Apolyguslucorum)卵的研究结果一致[27- 29],但与赤松毛虫和桑尺蠖越冬幼虫研究结果不一致[22- 23],具体原因还有待进一步分析。甘油含量增加可以降低过冷却点[30],海藻糖和脂肪作为虫体重要的抗逆保护物质,其含量增加对维持细胞膜、蛋白质结构的稳定性,增加虫体耐寒能力和保证虫体正常生理功能等方面具有重要作用[20,31-32],这亦与大多数昆虫的研究结果一致[21- 22,27- 30]。
昆虫体内耐寒物质变化可能滞后于其所处环境温度的变化,这是因为相关酶活性恢复可能需要一段时间[33]。本研究亦发现同样现象,1月份地表温度最低,但其体内自由水/结合水比值、脂肪、海藻糖、甘油和游离蛋白质等含量均在2月份达到峰值,表现出一定的滞后性,这是否与虫体内酶活性有关还需进一步研究。
参考文献(References):
[1] Lee R E Jr. Insect cold hardiness: to freeze or not to freeze. Bioscience, 1989, 39(5): 308- 313.
[2] 景晓红,康乐. 昆虫耐寒性的测定与评价方法. 昆虫知识, 2004, 40(1): 7- 10.
[3] 欧阳芳,戈峰. 昆虫抗冻耐寒能力的测定与分析方法. 应用昆虫学报, 2014, 51(6):1646- 1652.
[4] Broufas G D, Koveos D S. Rapid cold hardening in the predatory miteEuseius(Amblyseius)finlandicus(Acari: Phytoseiidae). Journal of Insect Physiology, 2001, 47(7): 699- 708.
[5] Tsumuki H, Ishida H, Yoshida H, Sonoda S, Izumi Y, Murai T. Cold hardiness of adult western flower thrips,Frankliniellaoccidentalis(Pergande) (Thysanoptera:Thripidae). Applied Entomology and Zoology, 2007, 42(2): 223- 229.
[6] 李鸿波,史亮,王建军,杜予州. 西花蓟马的快速冷驯化及其生态学代价. 生态学报, 2011, 31(23): 7196- 7202.
[7] Honěk A. Factors and consequences of a non-functional alary polymorphism inPyrrhocorisapterus(Heteroptera: Pyrrhocoridae). Researches on Population Ecology, 1995, 37(1): 111- 118.
[8] 苏延乐,吕昭智,宋菁,苗伟. 始红蝽越冬聚集行为对其能量代谢的影响. 昆虫学报, 2007, 50(12): 1300- 1303.
[9] 钱雪,王冬梅,李爽,窦洁,季荣. 始红蝽呼吸代谢的季节变化及对温度的适应性. 生态学报, 2016, 36(20): 6602- 6606.
[11] 左敏,陈洪武,江远安,李丽华. 新疆近50a气温变化趋势和演变特征. 干旱气象, 2010, 28(2): 160- 166.
[12] 张山清,普宗朝,李景林,李建新,吉春容,傅玮东,王命全,李晓菊,郑新倩. 气候变化对新疆红枣种植气候区划的影响. 中国生态农业学报. 2014, 22(6): 713- 721.
[13] 张徐,吕宝乾,金启安,温海波,彭正强. 低温对椰心叶甲成虫体内几种抗寒物质含量的影响. 热带作物学报. 2013, 34(5): 942- 946.
[14] 李爽,王冬梅,李娟,扈鸿霞,季荣. 雌雄意大利蝗耐高温差异及其生理生化响应对策. 应用昆虫学报, 2015, 52(4): 960- 967.
[15] Bale J S. Insects at low temperature: a predictable relationship? Functional Ecology, 1991, 5(2): 291- 298.
[16] 崔双双,贺一原. 昆虫的耐寒性及其影响因素. 生命科学研究, 2011, 15(3): 273- 276.
[17] 王锦林,冯宇倩,宗世祥. 昆虫耐寒性的类型、测定方法及影响因素综述. 安徽农学通报, 2013, 19(9): 32- 35.
[18] 于锡基. 新疆春季寒害的研究. 新疆气象, 1993, 16(4): 42- 48.
[19] Hoffman A A, Sørensen J G, Loeschcke V. Adaptation ofDrosophilato temperature extremes: Bringing together quantitative and molecular approaches. Journal of Thermal Biology, 2003, 28(3): 175- 216
[20] 史彩华,胡静荣,李传仁,张友军. 环境胁迫下昆虫的耐寒适应机制研究进展. 植物保护, 2016, 42(6): 21- 28.
[21] 胡志凤,张统书,邢月,张天竞,董辉,丛斌. 东北地区亚洲玉米螟越冬幼虫抗寒性时间动态. 植物保护学报, 2016, 43(5): 722- 730.
[22] 韩瑞东,孙绪艮,许永玉,张卫光. 赤松毛虫越冬幼虫生化物质变化与抗寒性的关系. 生态学报, 2005, 25(6): 1352- 1356.
[23] 孙绪艮,郭慧玲,李恕廷,王兴华. 桑尺蠖越冬幼虫的耐寒性研究. 蚕业科学, 2000, 26(3): 129- 133.
[24] Wolfe J, Bryant G, Koster K L. What is ‘unfreezable water’, how unfreezable is it and how much is there? Cryo-Letters, 2002, 23(3): 157- 166.
[25] Block W, Zettel J. Activity and dormancy in relation to body water and cold tolerance in a winter-active springtail(Collembola). European Journal of Entomology, 2003, 100(3): 305- 312.
[26] 王荫长. 昆虫生物化学. 北京: 中国农业出版社, 2001, 57- 60.
[27] 易杰群,张古忍,郭晨林,闵强,邹志文. 蒲氏钩蝠蛾幼虫血淋巴物质与其耐寒性. 生态学报, 2015, 35(18): 6208- 6215.
[28] 于令媛,时爱菊,郑方强,卢虹,张帆,许永玉. 大草蛉预蛹耐寒性的季节性变化. 中国农业科学, 2012, 45(9): 1723- 1730.
[29] 卓德干,李照会,门兴元,于毅,张安盛,李丽莉,张思聪. 绿盲蝽越冬卵的耐寒能力. 生态学报, 2012, 32(5): 1553- 1561.
[30] 马延龙,候凤,马纪. 荒漠昆虫光滑鳖甲的耐寒性季节变化及其生理机制. 昆虫学报, 2009, 52(4): 372- 379.
[31] 丁惠梅,马罡,武三安,赵飞,马春森. 滞育昆虫小分子含量变化研究进展.应用昆虫学报, 2011, 48(4): 1060- 1070.
[32] 任小云,齐晓阳,安涛,韩艳华,陈红印,张礼生. 滞育昆虫营养物质的积累、转化与调控. 应用昆虫学报, 2016, 53(4): 685- 695.
[33] 张拥军. 二化螟越冬幼虫耐寒性及其机理研究[D]. 武汉: 华中农业大学, 2007.

