干旱对夏玉米苗期叶片权衡生长的影响
麻雪艳, 周广胜
1 南京信息工程大学应用气象学院, 南京 210044 2 中国气象科学研究院, 北京 100081 3 南京信息工程大学气象灾害预警协同创新中心, 南京 210044
干旱是世界范围内限制作物生长的主要灾害[1-3]。20世纪70年代以来,由于气候变暖的影响,大气蒸发力增强,土壤表层水分下降,干旱的发生频率、影响范围及致灾损失均呈增加趋势[4-5]。研究表明,21世纪前10年,全球干旱面积增加了8%,而严重受旱面积(减产30%以上)占总受旱面积(减产10%以上)的比例由20世纪50年代的34%增加到了58%,并导致世界玉米和小麦产量分别下降了3.8%和5.5%[6-7]。气候变暖背景下,未来全球温度将继续升高,降水格局将发生显著变化,表现为降水强度增大而降水频率减少,蒸散量增加,会导致干旱发生频率及强度进一步增加[4-5, 8]。据预测,至21世纪末,世界受旱面积将继续增加15%—44%,其中作物受旱面积将由1160万hm2增加至2500万hm2,会对粮食生产造成显著影响,导致全球粮食价格波动,威胁粮食安全[5,7,9]。玉米是世界第一大粮食作物,同时也是受干旱影响最大的作物,干旱导致的玉米减产是造成粮食产量波动的主要原因[10]。了解干旱对玉米生长发育及产量形成的影响,以及干旱条件下玉米的适应策略,进而针对性地采取防旱抗旱措施,对保障气候变化背景下的粮食安全具有重要意义。目前,关于干旱对玉米影响的研究已经非常广泛,但较少关于玉米对干旱适应性的研究。叶片是植物对干旱响应最敏感的器官之一[11],它既是植物重要的物质生产器官,也是植物与外界环境进行物质和能量交换的纽带,其性状的变化及权衡生长关系能够反映植物对资源的获取和贮存策略以及对干旱的适应对策[12-14]。植物向叶片的投资包括叶面积的扩张和单位叶面积的干物质积累(即比叶重)2个方面。较大的叶面积有利于植物对光能的吸收,促进资源积累,实现快速生长,但同时也会增加蒸腾失水,使植株受到水分胁迫的风险增大;比叶重体现了植物对资源的贮存,较大的比叶重能够增强植株在逆境中的存活能力[14-15]。叶面积与比叶重的权衡可反映植物在快速生长与忍受胁迫之间的资源投资策略。植株总叶面积的大小由叶片数和单叶面积决定。若植物向叶面积分配的资源一定,较大的单叶面积有利于资源获取,提高生长速率,但同时会增加蒸腾失水,因此单叶面积与叶片数之间存在权衡。叶片生物量由其包含的水分和干物质2部分组成,叶片的水分含量一定程度上表征了叶的代谢活性[12],而叶片贮存的干物质则为植物的生存和繁殖提供了物质基础,叶干重与叶含水量的权衡可反映植物在快速生长与维持生存之间的投资策略。目前,关于干旱对植物叶片性状的影响已有广泛研究[16-18],但是较少涉及干旱过程中植物叶片性状的权衡生长,限制了对植物在干旱环境中适应策略的理解。了解干旱过程中玉米叶片性状的变化规律及其之间的权衡生长关系,有助于增进对玉米适应干旱策略的理解以为针对性地采取防旱抗旱措施提供依据。为此,本研究选取了玉米绿叶面积、叶干重、比叶重、叶含水量和有效叶片数5个关键叶片性状,分别考察其在干旱过程中的变化规律,探讨绿叶面积与有效叶片数、绿叶面积与比叶重、叶干重与叶含水量之间的权衡生长关系,拟回答:持续干旱过程中玉米叶性状的变化规律是什么?叶性状之间的权衡关系如何?是否因干旱程度不同而改变?
1 材料与方法
1.1 研究地点
本实验在中国气象科学研究院固城生态环境与农业气象试验站 (39°08′N,115°40′E,海拔15.2m)的大型可控式水分试验场开展。试验场设有大型电动遮雨棚,占地750m2,共设42个试验小区,小区面积8m2(2m×4m),小区之间筑有3m深混凝土隔离墙,防止水分水平交换。试验场土壤质地为砂壤土,土壤类型为褐土,含有机碳13.67g/kg,全氮0.87g/kg, 有效磷25.76mg/kg,有效钾118.55mg/kg,pH值8.1,平均土壤容重1.37g/cm3[19],0—30cm平均田间持水量和凋萎系数分别为21.23%和7.10%。该站年平均气温12.1℃,年降水量494mm, 约70%的降水主要集中在夏季,其中以7月份最多(约150mm),但年际变异系数高达62.9%,致使正处于苗期的夏玉米受干旱影响的风险较大。
1.2 实验设计
实验供试玉米品种选择全国范围内种植面积最大的郑单958。2014年6月23日播种,行距为50cm,株距为25cm,每小区64穴,每穴播3粒。播种后,施磷酸二铵300kg/hm2并适当灌溉,保证玉米正常出苗。三叶期(7月1日)间苗并定苗至64株/小区。全生育期利用大型电动遮雨棚遮挡自然降水,播种前进行底墒调控,使各小区土壤湿度相等,三叶期(7月2日)按照当地7月份多年平均降水量的100%,80%,60%,40%,20%和7%,即按照150、120、90、60、30、10mm进行一次性灌水,形成6个初始土壤水分梯度(处理1—6),此后不再进行灌溉,随时间推移发展形成不同强度及持续时间的干旱过程。每个水分处理设3个重复小区。水分处理后每7d进行1次土壤含水量和玉米叶片性状的观测,玉米苗期(三叶期至拔节期)于7月10日,7月18日,7月31日和8月7日共进行了4次观测。
1.3 观测项目
1.3.1 土壤含水量
土壤含水量采用烘干法测定。每次观测时,在小区内两行玉米中间随机选取1个取样点,各小区取样位置大致相同,每个处理共3个取样点。利用土钻每10cm分层钻取0—90cm土样,分别放入土壤盒,随即测定湿土重,并置于烘箱内105℃烘干至重量恒定为止(烘干24h左右开始抽取上、中、下层土样3—6个,每隔2h称重1次,相邻2次重量差异≤0.02g即可)。然后进行干土样称重,计算绝对含水量,并除以田间持水量换算成土壤相对湿度(以下简称土壤湿度)。
1.3.2 夏玉米生长特征
每小区随机选取1—2株标准株玉米,每个处理共3—6株,依次测定标准株玉米的有效叶片数,每片绿叶的叶长、叶宽,叶鲜、干重,含水量等。
有效叶片数:指植株全部可见且未完全干枯脱落的叶片总数(以下简称叶片数)。
绿叶面积(Sl):用直尺量取标准株玉米每片完全展开叶的叶长(Li)和叶宽(Di),乘以形状校正系数k(取0.75),累加得到叶面积Sl(cm2/株)(式1)。其中,全展叶的叶长(Li)是指叶片基部(从叶枕开始)至叶尖的叶片长度,如果叶尖受旱干枯,则整叶面积减去干枯部分面积;叶宽(Di)是指叶片最宽处的宽度。未展叶的叶长以从上一片叶中露出的部分为准,宽度按照其原状(不展开)进行估计。
(1)
绿叶生物量及含水量:测定每株标准株玉米全部绿叶的鲜重,然后将其装入牛皮纸袋,放入烘箱105℃杀青1h,80℃烘干24h后称取干重。叶片鲜、干重之差为叶含水量。单株叶干重与相应叶面积之比即为比叶重(g/m2)。
1.4 研究方法
1.4.1 干旱强度与干旱程度
干旱强度(I)是指某一时间的作物水分亏缺程度,在此采用FAO作物水分胁迫系数(Ks)[20]定义干旱强度:
I=1-Ks
(2)
(3)
TAW=θFC-θWP
(4)
Dr=θFC-θi
(5)
RAW=p·TAW
(6)
p=p0+0.04×(5-ETc)
(7)
式中,TAW是土壤有效水分含量(cm3/cm3),为田间持水量θFC(cm3/cm3)与凋萎系数θWP(cm3/cm3)之差,表征植物可利用的全部有效水分含量;θi是0—30 cm土层平均体积含水量(cm3/cm3);Dr是土壤水分亏缺量(cm3/cm3),为田间持水量与θi之差;RAW是土壤速效水分含量(cm3/cm3),为田间持水量θFC与毛管断裂含水量之差,表征可被植物迅速吸收的土壤水分下限,通常按照占全部有效含水量的比例p来计算;p值需要在参考值p0(0.55)的基础上,根据当地潜在蒸散量ETc进行订正,而ETc采用FAO方法计算[20]。
可知,当玉米未受干旱影响时,I等于0;当土壤水分降低至凋萎系数以下、土壤有效水分含量全部耗尽以后,I达到1。
干旱程度(D)是干旱强度(I)随干旱持续时间的累积,可定义为:
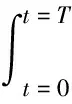
(8)
式中,It为时刻t的干旱强度,T为评估期长度;当dt= 1时,式(8)可转化为:
D=∑It
(9)
为方便比较,需要对式(9)进行标准化处理:
(10)
式中,∑T可以看成干旱强度为1,持续时间为T的干旱过程。
式(10)中,当评估期长度T一定时,干旱程度随干旱强度和持续时间(分子部分)线性变化。但是,现实中随着干旱持续时间的增加,作物对干旱的适应性会增强,而且土壤水分的下降速率会减慢,干旱程度的发展会放缓。因此,应对上式进行负指数化:
(11)
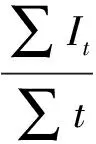
(12)
1.4.2 土壤相对湿度插值
为确定逐日的干旱强度,需要对土壤水分资料进行插值。由于随着土壤水分含量的下降,其下降速率逐渐放缓,故采用幂函数形式进行拟合得到各小区逐日土壤水分含量:
SWm(x)=a·xb
(13)
式中,x为灌水后天数;SWm为灌水后第x天的0—30cm土壤相对湿度(%);a,b为模型回归参数。
1.4.3 权衡值的计算
叶片性状A的收益BA可以概念化为性状A响应特定环境所能实现的最大收益的比例,计算如下[21]:
(14)
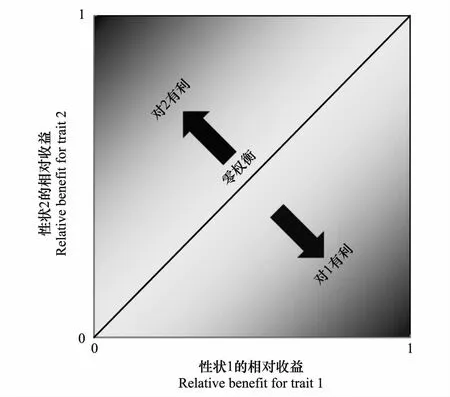
图1 成对性状的权衡值示意图[21]Fig.1 Illustration of trade-off between two leaf traits [21]
性状收益BA的变化范围在0—1之间。式中,Aobs,Amax,Amin分别为性状A的观测值、所在总体的最大值和最小值;由于后期各处理均不同程度受到干旱影响,为获得性状A的最大值,首先将各叶性状与相应的干旱程度进行二次多项式拟合,确定干旱程度为0时曲线对应的性状值即为该性状的最大值。成对性状的权衡是为了测定两个性状收益的差异,可用成对性状收益的均方根误差(Root mean square error, RMSE)表示。RMSE在二维坐标轴(图1)中可看做成对性状标准值的坐标到对角线(1∶1)的距离,距离越大,权衡值也越大,点与对角线的相对位置则表明了权衡的倾向性[21]。
2 结果与分析
2.1 不同强度干旱过程对玉米叶片性状的影响
不同水分处理的玉米叶片性状大小及其在生育期内的变化趋势因干旱程度不同而不同。7月10日,处理1—5的干旱程度在0—0.21之间,玉米各叶性状值尚无显著差异,处理6干旱程度高达0.86,各叶性状较处理1—5已明显偏低。7月18日,处理1—3、处理4—5与处理6的各性状值之间差异显著,其干旱程度分别为0—0.09,0.48—0.71和0.95。7月31日,处理1—3、处理4—6的各性状值差异显著,其干旱程度分别为0.29—0.57,0.76—0.98。8月7日,处理1—2、处理3与处理4—6的各性状值差异显著,其干旱程度分别为0.46—0.67,0.71,0.83—0.98(表1和表2)。
观测时段内,处理1—3玉米的干旱程度在0—0.71之间,其叶性状均呈持续增长趋势;处理4和5的干旱程度在0—0.91之间,其叶性状起初呈增加趋势,7月31日以后,即当干旱程度大于0.76时,其绿叶面积、有效叶片数和叶含水量均出现下降,处理5的叶干重也出现下降,这是由于干旱降低了展叶速率,且加速了老叶干枯脱落,导致新叶的生长补偿不了老叶的衰老,使得叶性状提前出现下降趋势;处理6玉米叶片性状在观测时段内变化微小。处理6玉米的干旱程度于7月10日即达到0.86,至7月18日高达0.95,各叶性状变化微小,这是由于干旱严重抑制了玉米生长,导致植株生长几乎处于停滞状态,没有新叶产生,老叶的脱落也非常缓慢(表3)。
综上,当干旱程度小于0.21时,干旱对叶片性状几乎无影响;当干旱程度低于0.76时,玉米叶片性状值会受到显著影响,但其变化趋势不会发生根本改变;当干旱程度在0.76—0.91之间时,玉米叶片受干旱影响生长速率明显下降且老叶衰老脱落加速,导致新叶的形成补偿不了老叶的脱落,其有效叶片数、叶干重、叶面积、叶含水量等性状提前出现下降;当干旱程度大于0.91时,玉米的叶片生长几乎停滞,叶片寿命也明显延长,叶性状变化微小(表1)。
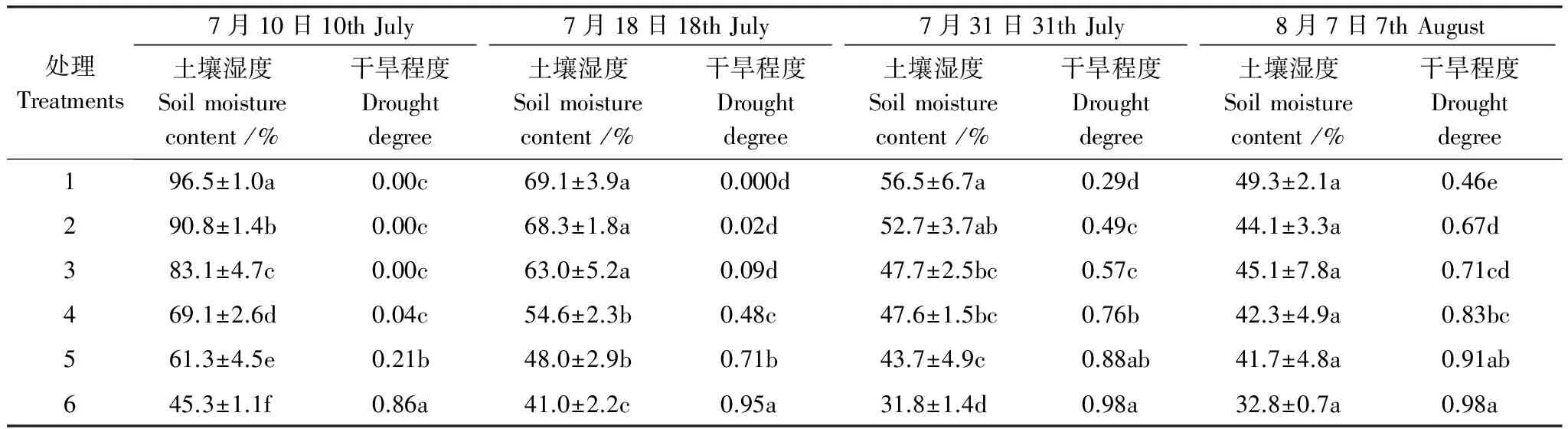
表1 各处理的0—30cm土壤相对湿度与干旱程度
同列数据无相同字母表示在0.05水平上差异显著。处理1—6是指三叶期(7月2日)分别按照150,120,90,60,30、10mm进行一次性灌水处理
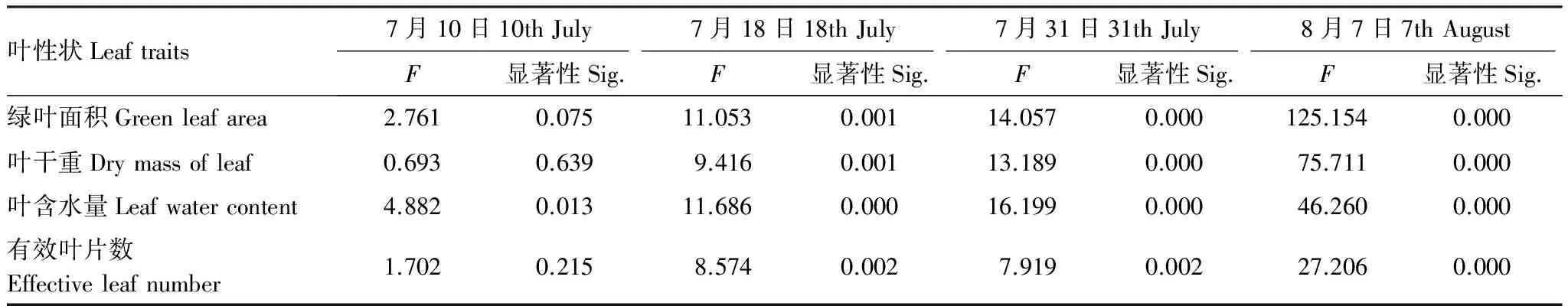
表2 不同处理叶性状的One-way ANOVA方差分析结果
同列数据无相同字母表示在0.05水平上差异显著
2.2 玉米成对叶性状的动态变化
各处理玉米的单株叶面积/叶片数随时间基本呈增加趋势,说明单叶面积逐渐增大。各次观测沿着土壤水分下降方向,单株叶面积/叶片数呈减小趋势,说明随着干旱的发展,单叶面积会减小,并且对单叶面积的影响大于叶片数(图2)。各处理玉米的叶含水量/叶干重随时间基本呈下降趋势,说明叶干重的增长幅度较叶含水量逐渐增大,叶片含水率不断降低。各次观测沿着土壤水分下降方向,叶含水量/叶干重呈下降趋势,说明干旱对叶含水量的影响大于叶干重,会降低叶片含水率(图2)。各处理玉米的叶干重/叶面积随时间基本呈上升趋势,说明比叶重逐渐增大。各次观测的叶干重/叶面积仅7月10日沿着土壤水分梯度呈减小趋势,此后没有明显的变化规律(图2)。
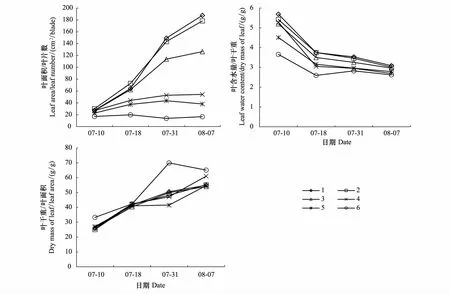
图2 成对性状比值的动态变化Fig.2 Dynamics of pair-ratios of leaf traits 1—6是指处理1—6,即三叶期(7月2日)分别按照150,120,90,60,30,10mm进行一次性灌水处理
2.3 玉米成对叶性状对不同强度干旱过程的权衡响应
叶面积与叶片数的权衡显示,7月10日处理1—4倾向于叶面积,处理5—6倾向于叶片数;7月18日处理1—5均倾向于叶片数,处理6略倾向于叶面积;7月31日处理1—2倾向于叶面积,处理3—6倾向于叶片数;8月7日除处理2略倾向于叶面积外,其余处理均倾向于叶片数(图3)。可见,随着干旱程度加剧,各处理均由叶面积向叶片数权衡,这表明未受干旱影响或受旱程度较轻时(D<0.46),玉米倾向于扩大叶片面积,获得更多的资源,以实现快速生长,为生殖生长储备能量;当受旱较严重时(D>0.46),会倾向于减小单叶面积,以较低的生长速率为代价来减少水分散失并降低生殖生长门槛。
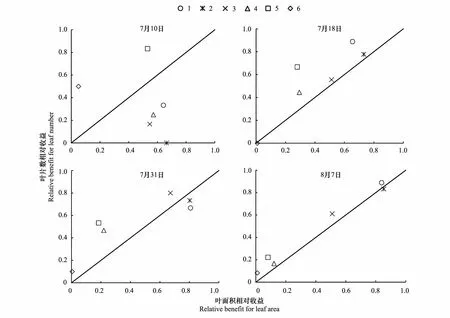
图3 各次观测叶面积与叶片数的权衡Fig.3 Trade-off between leaf area and leaf number of each observation实线为零权衡线,1—6代表处理1—6的叶面积与叶片数的权衡
叶干重与叶含水量的权衡显示,7月10日处理1—4倾向于叶含水量,处理5—6略倾向于叶干重;7月18日处理1—2略倾向于叶含水量,处理3—6略倾向于叶干重;7月31日各处理的权衡值均非常小,处理1略倾向于叶含水量,处理2—5略倾向于叶干重,处理6的权衡值几乎为零;8月7日处理1—6均倾向于叶干重(图4)。可见,一旦干旱程度大于0,玉米即开始由叶含水量向叶干重权衡,表明干旱条件下玉米会降低叶片代谢活性,减少生长消耗,而倾向于积累资源,以增强其存活机率。
图4 各次观测叶干重与叶含水量的权衡Fig.4 Trade-off between dry mass of leaf and leaf water content of each observation
叶面积与比叶重的权衡显示,7月10日处理1—5均倾向于叶面积,处理6倾向于比叶重;7月18日处理1—3倾向于叶面积,处理4—6倾向于比叶重;7月31日处理1—5倾向于叶面积,处理6倾向于比叶重;8月7日,处理1—3倾向于叶面积,处理4—6倾向于比叶重(图5)。可见,处理1—3基本倾向于叶面积,当干旱程度大于0.48时,处理4—5由叶面积向比叶重权衡,处理6基本倾向于比叶重,表明水分较充足时,玉米倾向于不断扩大叶面积,使植株接受尽可能多的能量,实现快速生长,而随着干旱影响加剧,玉米会倾向于资源贮存以提高其抵御干旱的能力。
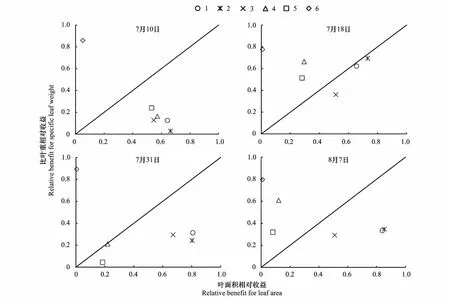
图5 各次观测叶面积与比叶重的权衡Fig.5 Trade-off between leaf area and specific leaf weight of each observation
3 讨论
3.1 干旱强度与干旱程度的定量表达
土壤水分是最常见的作物干旱指标[22-23]。但是,干旱是一个逐渐发生发展的动态过程,作物的受旱程度不仅与干旱发生时间、干旱强度和持续时间等有关,还受气象条件、土壤性质、作物根系分布和吸水能力等的影响[24],静态的土壤含水量只能反映当前的土壤水分状况,包含的干旱历史信息少,土壤含水量相同并不代表植物受旱程度相同[23,25]。例如,本研究处理3和4的初始土壤水分和土壤水分下降速率均差异显著,玉米的受旱程度明显不同,但7月31日2个处理的土壤相对湿度均达到48%,无法解释其叶片性状大小和权衡关系的显著差异(表1,表3)。陈家宙等[23]提出了基于土层贮水量和累积相对失水量的干旱强度的定量表达,可一定程度反映土壤性质、气象条件、根系吸水能力等的综合影响。但该方法是基于回归关系所得,存在回归参数的物理意义不够明确,回归关系的准确性依赖于回归模型形式、观测样本代表性等的问题。而本研究采用的FAO作物胁迫系数Ks考虑了土壤有效水分含量和能被根系迅速吸收的速效水分含量,与土壤性质、气象条件、作物生长阶段等密切相关,各参数均具有明确的物理意义,机理性更完备,能更客观地反映植物的水分亏缺强度。本研究提出的干旱程度计算方法与陈家宙等[23]的形式类似,但考虑到指数函数的收敛性,对指数部分的取值范围进行了控制,避免了因取值过大导致干旱程度值过于集中,不易区分的问题。与土壤湿度相比,本研究提出的干旱程度更能解释玉米叶片性状的处理间差异以及不同干旱过程中叶片成对性状的权衡关系。
3.2 干旱对玉米叶片性状的影响
叶片是植物对干旱响应最敏感的器官之一[26-27],受干旱影响,植物叶片面积减小,叶数减少,叶片增厚、发生卷曲等[27-28]。本研究也发现干旱会显著抑制玉米叶面积的扩张,降低叶片含水量,减缓展叶速率,加速老叶衰老脱落,导致叶面积减小,叶片干物质积累减少,叶片生长缓慢。这些改变均是为了减少叶片水分散失和提高水分利用效率[12, 29]。但是,不同干旱程度对叶片性状的影响不一致。本研究表明,当干旱程度小于0.21时,玉米叶片性状几乎不受影响;干旱程度在0.21—0.76之间时,玉米的绿叶面积、有效叶片数、叶干重和叶含水量在观测时段内均不断增大,干旱的影响主要体现在叶片性状值大小的改变,其变化趋势并无根本改变;干旱程度在0.76—0.91之间时,玉米叶片生长速率明显下降且老叶衰老脱落加速,导致新叶的形成补偿不了老叶的脱落,有效叶片数、叶干重、叶面积和叶含水量等性状提前出现下降趋势;当干旱程度大于0.91时,玉米叶片生长几乎停滞,叶片寿命也明显延长,各叶性状变化微小。这是因为植物在资源充足的环境中具有较高的资源吸收和周转速率,会通过不断产生新的组织和器官使其生长速率最大化,因为有足够的资源迅速补偿其生产组织和器官的消耗;而在资源匮乏的环境中,植物资源吸收和周转的速率较低,会通过延缓组织和器官的衰老,延长生长周期,使资源较长时间留存于植物体内来“偿还”生长消耗,避免因周转流失了必需的营养资源而死亡。较慢的周转速率增强了植物的存活率,但造成了较慢的生长速率[30]。
3.3 玉米叶片性状在干旱过程中的权衡策略
干旱对玉米各叶性状均有影响,但影响程度不一致,表现为:叶面积>叶片数,叶含水量>叶干重,反映了干旱发生发展过程中玉米叶片的权衡生长。对叶面积的影响大于对叶片数的影响,说明玉米叶面积的降低主要是单叶面积显著减小所致,体现了逆境条件下植物普遍存在的“出叶强度优势”的权衡策略,即倾向于减小单叶面积,尽量保证叶片数目不受影响[29,31-32]。这是因为较小的叶片具有较强的导热能力,可保证捕获光能的同时避免叶片过热和减少水分散失[32];而且,较小的叶片尺寸往往意味着较低的生殖生长门槛,保证了植物在干旱等不利环境导致植株体积受到严重抑制的情况下仍能进行生殖生长[29]。并且,玉米展叶数与生殖器官的分化发育具有精确的同伸关系,最大限度地维持展叶速率保证了玉米发育进程受影响较小,这对玉米在有限的适宜生长期内完成生命周期并形成产量具有重要意义[33]。对叶片含水量的影响大于对叶干重的影响,说明随着干旱的发展,玉米会降低叶片代谢活性,维持较低的生长速率,倾向于积累干物质以抵御干旱的不利影响。玉米叶片性状在干旱条件下的生长策略本质上反映了其在快速生长与维持生存之间的权衡[34]。但是不同干旱程度下,玉米会采取不同的权衡策略。本研究表明,未发生干旱时,玉米倾向于维持较高的代谢活性,一旦干旱程度大于0,玉米就会降低叶片代谢活性;当干旱程度小于0.48时,玉米倾向于通过迅速增加叶面积来吸收较多的能量,以获得较大的生长速率,为生殖器官的生长及产量形成储备能量;当干旱程度大于0.48时,玉米会减小单叶面积以减少水分散失,倾向于资源贮存以增强其抵抗干旱的能力。
4 结论
干旱会显著抑制玉米叶面积的扩张,降低叶片含水率,减缓展叶速率,加速老叶衰老脱落,导致叶面积减小、叶片干物质积累减少,生长缓慢。但是,不同干旱程度对叶片性状的影响不一致。当干旱程度小于0.21时,玉米叶片性状几乎不受影响;干旱程度在0.21—0.76之间时,玉米的绿叶面积、有效叶片数、叶干重和叶含水量均不断增大,干旱的影响主要体现在叶片性状值大小的改变,其变化趋势并未发生根本改变;干旱程度在0.76—0.91之间时,玉米叶片生长速率明显下降且老叶衰老脱落加速,导致新叶的形成补偿不了老叶的脱落,有效叶片数、叶干重、绿叶面积和叶含水量等叶性状提前出现下降趋势;干旱程度大于0.91时,玉米的叶片生长几乎停滞,叶片寿命也明显延长,各叶性状的变化微小。干旱过程中玉米叶片会采取降低叶面积来减少水分散失,降低叶片代谢和生长消耗,增加资源贮存以提高其生存能力的适应策略,本质上反映了其在快速生长与维持生存之间的权衡。但是不同干旱程度下,玉米叶片各性状间的权衡生长策略不同:未发生干旱时,玉米倾向于维持较高的代谢活性,一旦干旱程度大于0,玉米就会降低叶片代谢活性;当干旱程度小于0.48时,玉米倾向于通过迅速增加叶面积来吸收较多的能量,以获得较大的生长速率,为生殖器官的生长及产量形成储备能量;当干旱程度大于0.48时,玉米会减小单叶面积以减少水分散失,倾向于资源贮存以增强其抵抗干旱的能力。
致谢:感谢中国气象科学研究院固城农业气象与生态环境实验站提供实验环境,感谢许振柱,张峰,蒋延玲,王秋玲,王敏政,周怀林,冯晓钰,刘涛,张淑杰,刘少军在实验过程中给予的帮助。
参考文献(References):
[1] Farooq M, Wahid A, Kobayashi N, Fujita D, Basra S M A. Plant drought stress: effects, mechanisms and management. Agronomy for Sustainable Development, 2009, 29(1): 185- 212.
[2] Neumann P M. Coping mechanisms for crop plants in drought-prone environments. Annals of Botany, 2008, 101(7): 901- 907.
[3] Alam M R, Nakasathien S, Sarobol E, Vichukit V. Responses of physiological traits of maize to water deficit induced at different phenological stages. Kasetsart Journal: Natural Science, 2014, 48(2): 183- 196.
[4] Dai A G. Increasing drought under global warming in observations and models. Nature Climate Change, 2013, 3(1): 52- 58.
[5] IPCC. Climate Change 2013: the Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge, United Kingdom, New York, NY, USA: Cambridge University Press, 2013: 1535.
[6] Lobell D B, Schlenker W, Costa-Roberts J. Climate trends and global crop production since 1980. Science, 2011, 333(6042): 616- 620.
[7] Chen H, Wang J X, Huang J K. Policy support, social capital, and farmers′ adaptation to drought in China. Global Environmental Change, 2014, 24: 193- 202.
[8] Ghannoum O. C4 photosynthesis and water stress. Annals of Botany, 2009, 103(4): 635- 644.
[9] Olesen J E, Trnka M, Kersebaum K C, Skjelvåg A O, Seguin B, Peltonen-Sainio P, Rossi F, Kozyra J, Micale F. Impacts and adaptation of European crop production systems to climate change. European Journal of Agronomy, 2011, 34(2): 96- 112.
[10] Saglam A, Kadioglu A, Demiralay M, Terzi R. Leaf rolling reduces photosynthetic loss in maize under severe drought. Acta Botanica Croatica, 2014, 73(2): 315- 332.
[11] Farooq M, Kobayashi N, Ito O, Wahid A, Serraj R. Broader leaves result in better performance of indica rice under drought stress. Journal of Plant Physiology, 2010, 167(13): 1066- 1075.
[12] 潘莎. 植物叶代谢生态指数和叶性状随环境梯度变化的研究[D]. 杭州: 浙江大学, 2014.
[13] Poorter L, Bongers F. Leaf traits are good predictors of plant performance across 53 rain forest species. Ecology, 2006, 87(7): 1733- 1743.
[14] Freschet G T, Cornelissen H C C, van Logtestijn R S P, Aerts R. Evidence of the ‘plant economics spectrum’ in a subarctic flora. Journal of Ecology, 2010, 98(2): 362- 373.
[15] Wright I J, Reich P B, Westoby M, Ackerly D D, Baruch Z, Bongers F, Cavender-Bares J, Chapin T, Cornelissen J H C, Diemer M, Flexas J, Garnier E, Groom P K, Gulias J, Hikosaka K, Lamont B B, Lee T, Lee W, Lusk C, Midgley J J, Navas M L, Niinemets Ü, Oleksyn J, Osada N, Poorter H, Poot P, Prior L, Pyankov V I, Roumet C, Thomas S C, Tjoelker M G, Veneklaas E J, Villar R. The worldwide leaf economics spectrum. Nature, 2004, 428(6985): 821- 827.
[16] Bosabalidis A M, Kofidis G. Comparative effects of drought stress on leaf anatomy of two olive cultivars. Plant Science, 2002, 163(2): 375- 379.
[17] Munné-Bosch S, Alegre L. Die and let live: leaf senescence contributes to plant survival under drought stress. Functional Plant Biology, 2004, 31(3): 203- 216.
[18] Lefi E, Gulías J, Cifre J, Younes B M, Medrano H. Drought effects on the dynamics of leaf production and senescence in field-grownMedicagoarboreaandMedicagocitrina. Annals of Applied Biology, 2004, 144(2): 169- 176.
[19] 任三学, 赵花荣, 姜朝阳, 谭凯炎. 土壤水分胁迫对冬小麦旗叶光合特性的影响. 气象科技, 2010, 38(1): 114- 119.
[20] Allen R G, Pereira L S, Raes D, Smith M. Crop evapotranspiration. Guidelines for Computing Crop Water Requirements. FAO Irrigation and Drainage Paper 56. Rome, Italy: FAO, 1998.
[21] Bradford J B, D′Amato A W. Recognizing trade-offs in multi-objective land management. Frontiers in Ecology and the Environment, 2012, 10(4): 210- 216.
[22] 李柏贞, 周广胜. 干旱指标研究进展. 生态学报, 2014, 34(5): 1043- 1052.
[23] 陈家宙, 王石, 张丽丽, 吕国安. 玉米对持续干旱的反应及红壤干旱阈值. 中国农业科学, 2007, 40(3): 532- 539.
[24] Porporato A, Laio F, Ridolfi L, Rodriguez-Iturbe I. Plants in water-controlled ecosystems: active role in hydrologic processes and response to water stress: III. Vegetation water stress. Advances in Water Resources, 2001, 24(7): 725- 744.
[25] 张玉书, 米娜, 陈鹏狮, 纪瑞鹏. 土壤水分胁迫对玉米生长发育的影响研究进展. 中国农学通报, 2012, 28(3): 1- 7.
[26] Elhaak M A. Response ofPlantagoalbicansleaves of environmental drought. Feddes Repertorium, 1990, 101(11/12): 645- 650.
[27] 叶龙华, 黄香兰, 薛立. 干旱对树木叶片性状及抗旱生理的影响. 世界林业研究, 2014, 27(1): 29- 34.
[28] 石耀辉, 周广胜, 蒋延玲, 王慧, 许振柱, 麻雪艳. 贝加尔针茅响应降水变化敏感指标及关键阈值. 生态学报, 2017, 37(8): 2620- 2630.
[29] Aarssen L W. Reducing size to increase number: a hypothesis for compound leaves. Ideas in Ecology and Evolution, 2012, 5: 1- 5.
[30] Sterck F J, Poorter L, Schieving F. Leaf traits determine the growth-survival trade-off across rain forest tree species. The American Naturalist, 2006, 167(5): 758- 765.
[31] 杨冬梅, 占峰, 张宏伟. 清凉峰不同海拔木本植物小枝内叶大小-数量权衡关系. 植物生态学报, 2012, 36(4): 281- 291.
[32] Kleiman D, Aarssen L W. The leaf size/number trade-off in trees. Journal of Ecology, 2007, 95(2): 376- 382.
[33] 郑国清, 段韶芬, 阎书波, 吕冰清. 玉米叶龄与器官发育模拟模型. 玉米科学, 2003, 11(4): 63- 66.
[34] Ocheltree T W, Nippert J B, Prasad P V V. A safety vs efficiency trade-off identified in the hydraulic pathway of grass leaves is decoupled from photosynthesis, stomatal conductance and precipitation. New Phytologist, 2016, 210(1): 97- 107.

