前哨淋巴结活检阳性乳腺癌患者避免腋窝淋巴结清扫的探讨
朱军永,原晓燕,2,朱芸生,王 派,李 捷,王全胜,刘 梅,李席如
解放军总医院 普通外科,北京 100853;2北京市通州区妇幼保健院 普通外科,北京 101100;3解放军总医院 病理科,北京 100853
腋窝淋巴结转移状态是判断乳腺癌患者预后和指导治疗的最重要指标,而腋窝淋巴结清扫(axillary lymph node dissection,ALND)是评价腋窝淋巴结转移状态最准确的方法,同时也是造成上肢水肿、感觉异常和功能障碍等乳腺癌术后并发症的主要原因。前哨淋巴结活检(sentinel lymph node biopsy,SLNB)不仅可以将腋窝淋巴结手术不良反应最小化,还可以提供与ALND同等价值的信息[1-2]。2009年版St.Gallen国际乳腺癌治疗专家共识支持除炎性乳腺癌以外的所有临床腋窝淋巴结阴性乳腺癌作为SLNB的适应证[3]。随后Giuliano等[4]报道的美国外科医师学会肿瘤学组(American College of Surgeons Oncology Group,ACOSOG) Z0011试验结果显示,SLNB组和ALND组患者局部复发率和总生存率上没有差异,但SLNB组患者术后上肢并发症的发生率显著低于ALND组。很多欧美国家和学术组织也相继报道了类似结果并对Z0011试验结果进行临床验证[5-8]。国内尚无按照Z0011标准的多中心随机对照临床试验报道。考虑到种族和乳腺癌发病特征的差异,本研究拟通过分析解放军总医院2007年1月- 2016年11月行前哨淋巴结活检的乳腺癌患者的临床病理特征,找出能初步预测SLNB后腋窝淋巴结状态的相关因素,为避免进一步腋窝淋巴结清扫提供参考。
资料和方法
1 一般资料 收集2007年1月- 2016年11月于解放军总医院行前哨淋巴结活检的乳腺癌患者1 162例,筛选出前哨淋巴结活检结果阳性(均为冷冻结果回报)患者215例。这些患者符合以下条件:1)经病理证实为乳腺癌;2)未接受过新辅助化疗;3)冷冻或石蜡苏木精-伊红(hematoxylin and eosin,HE)染色证实前哨淋巴结阳性(除外免疫组织化学诊断的前哨淋巴结阳性患者);4)已行ALND。最终纳入196例患者,年龄21 ~ 76岁,中位年龄46岁。其中ALN阳性组75例,ALN阴性组121例。
2 研究方法 收集并整理入组患者的临床资料,包括患者年龄、术前影像检查结果(钼靶、B超、磁共振)、肿瘤部位、肿瘤大小、病理类型、组织学分级、肿瘤激素受体状态、肿瘤分子分型(依据2011年St.Gallen国际乳腺癌会议专家共识)、阳性SLN个数、总SLN个数、阳性腋窝淋巴结个数、总ALN个数、手术方式、辅助治疗方案。ALND后按腋窝淋巴结状态分为ALN阴性(ALN-)组和ALN阳性(ALN+)组,分析两组上述临床资料的差异以确定SLNB阳性患者避免进一步腋窝淋巴结清扫的预测因子。
3 统计学分析 所有数据采用SPSS22.0统计学软件进行分析。计量资料采用t检验,计数资料采用χ2检验或Fisher's精确检验,Logistics回归筛选预测腋窝淋巴结状态的临床病理学因素;P<0.05为差异有统计学意义。
结 果
1 ALN+组和ALN-组病理特征比较 两组组织学分级、阳性前哨淋巴结数目和病理T分期差异有统计学意义(P<0.01);年龄分布、肿瘤位置、组织学分类、激素受体状态、分子分型、SLNB淋巴结数目、ALND淋巴结数目无统计学差异。见表1。2 SLNB阳性可避免ALND的因素分析 对表1中P<0.1的因素进行Logistic回归分析,对多分类变量进行哑变量处理。单因素分析结果显示:SLNB 3枚及3枚以上阳性结果的患者相对于1枚的患者ALND出现阳性结果的风险增加4倍(P<0.05),组织学分级为SBRⅢ级的患者ALND为阳性的风险相对于SBRⅠ级的患者增加3.1倍(P<0.05)。多因素Logistic回归分析发现,SLNB前哨淋巴结数目和组织学分级是ALND阳性结果的影响因素。见表2。
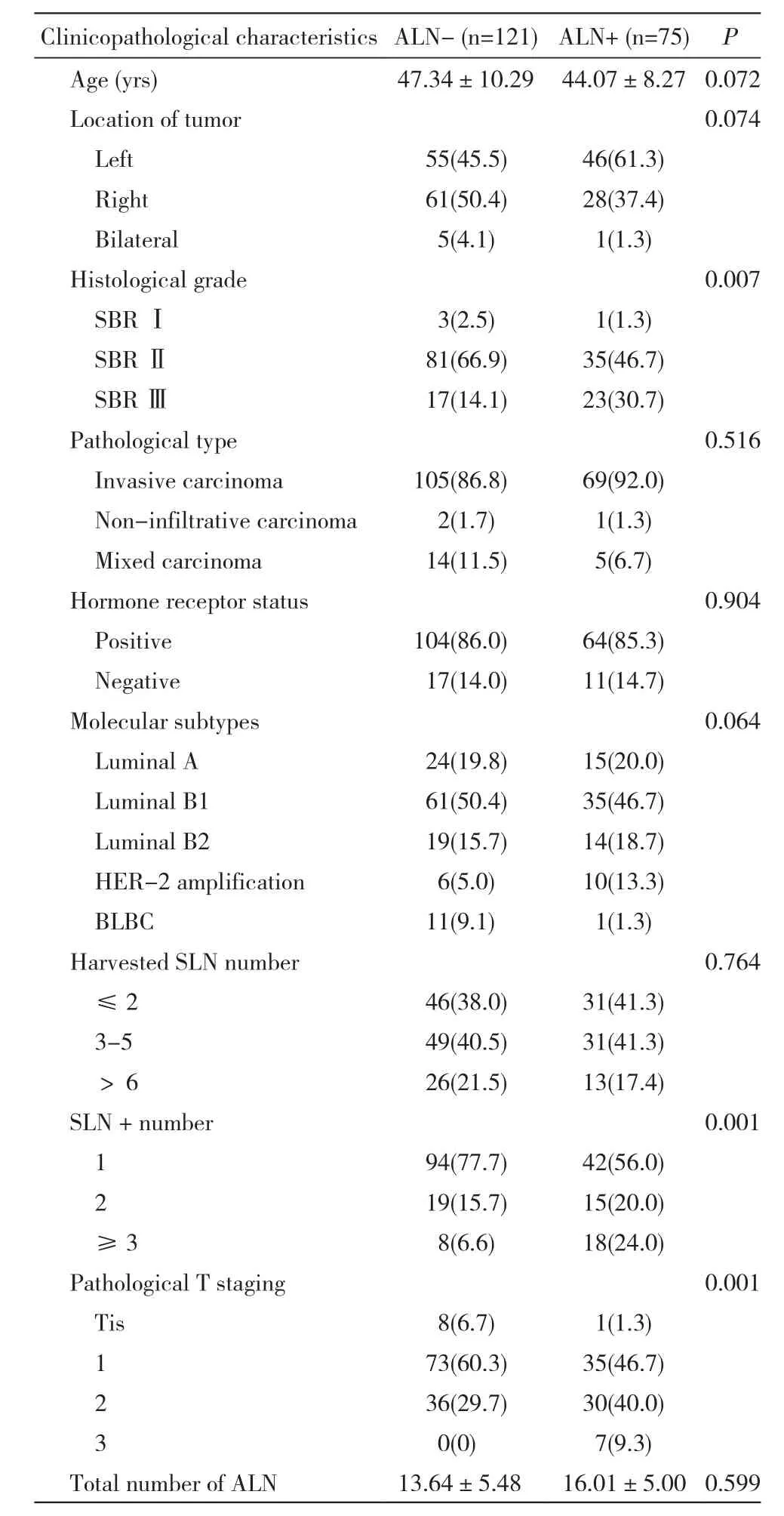
表1 ALN-和ALN+组临床病理特征比较Tab. 1 Comparison of clinicopathological characteristics between group ALN- and ALN+ (n,%)
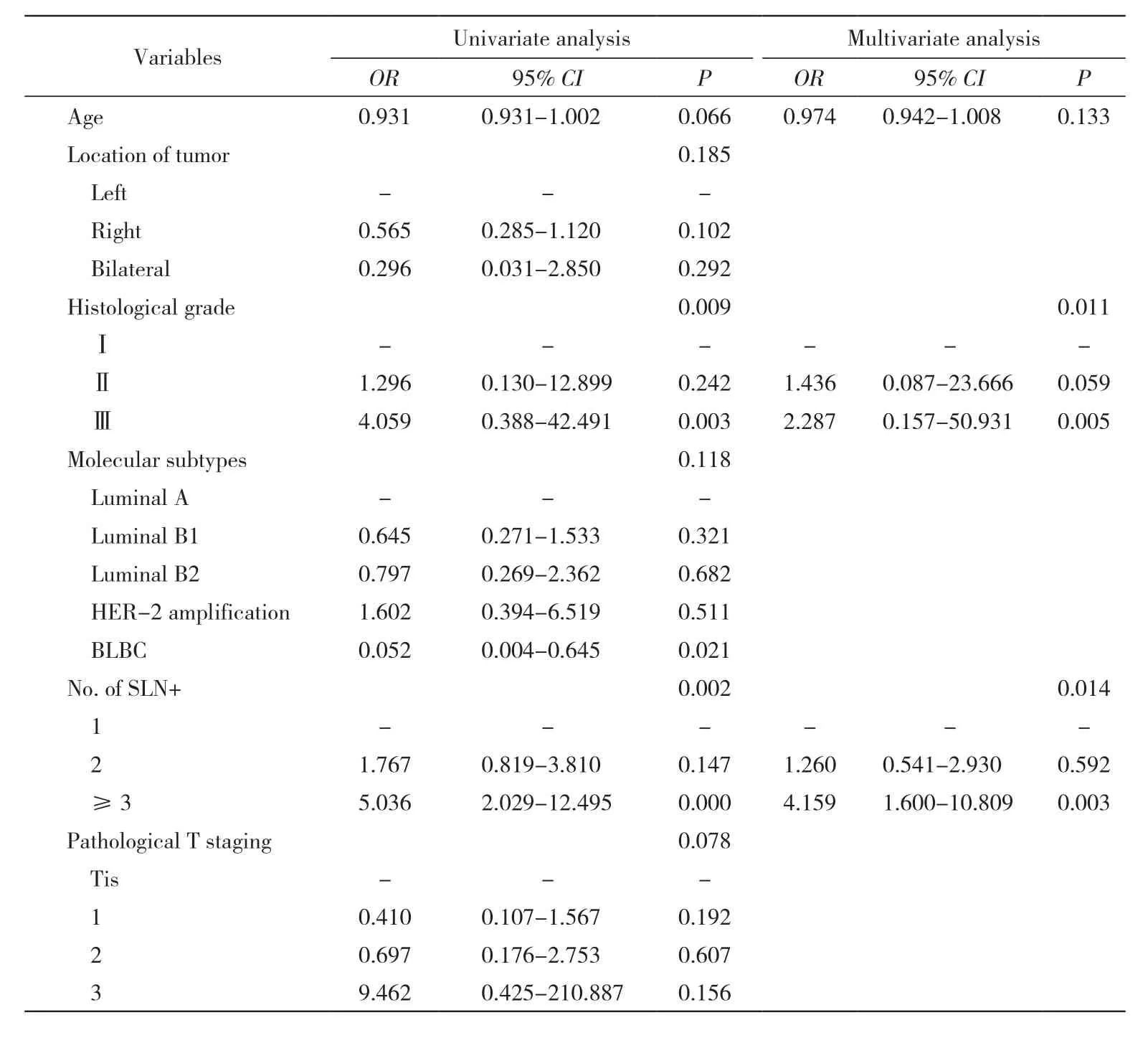
表2 预测腋窝淋巴结结果因素的Logistic回归分析Tab. 2 Logistic regression analysis of predictive factors for positive result of axillary lymph nodes
讨 论
过去的20多年里,早期乳腺癌患者的腋窝手术方法发生了巨大的变革[9]。对于腋窝淋巴结临床阴性的乳腺癌患者,前哨淋巴结活检阴性时仅行SLNB是安全有效的方案,而且SLNB结果可作为腋窝分期的参考。SLNB具有高准确率和低假阴性率。国内外许多前瞻性研究证实了对于前哨淋巴结阴性患者SLNB可以安全替代ALND[4,10-14],上肢并发症降低、生活质量提高[2,8]。对前哨淋巴结阴性患者不再行ALND也早已是国内早期乳腺癌治疗标准。然而在实际临床工作中,发现有很多前哨淋巴结阳性的早期乳腺癌患者腋窝淋巴清扫结果为阴性,这部分患者行ALND可能增加术后上肢并发症发生率。因此,如何鉴别出前哨淋巴结阳性却可以免行ALND的患者显得尤为重要。2010年ACOSOG Z0011随机试验结果显示原发肿瘤处于临床T1或者T2期、1 ~ 2个阳性SLN、准备接受保乳手术和术后全乳放疗、辅助化疗的早期乳腺癌患者可以仅行SLNB[15]。2012年版NCCN推荐某些特定的前哨淋巴结阳性患者可以免行ALND。但由于我国乳腺癌的早期筛查制度并不完善以及国人的医疗观念问题,保乳率仍低于国外。前哨淋巴结一旦发现转移选择进一步腋窝淋巴结清扫仍是常规做法。
本研究中,196例患者中腋窝淋巴清扫结果回报为阳性的有75例,这与美国乳腺和肠道外科辅助治疗研究组B-32试验报道的数据(腋窝非前哨淋巴结转移阳性率为38.6%)相似[8]。国际上就SLNB结果阳性进一步是否ALND也有很多预测模型, 如 MSKCC、Stanford、Turkish、MDAnderson、MOU和DEU模型等,其ROC曲线下面积都在80%以上[16]。2015年乳腺外科学会发布了乳腺癌腋窝转移处理方式的共识:1 ~ 2个前哨淋巴结转移的保乳手术后并做全乳放疗的T1、组织学1或2级、雌激素受体(estrogenreceptor,ER)阳性和人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)阴性的绝经后患者,不要求做腋窝淋巴结清扫。那些做了乳房切除术或者肿瘤特征满足以下至少1项(T3、3级、ER-、HER2+)的患者应行淋巴结清扫。这个共识在国内还未被认可,尽管国内也有相关研究尝试预测腋窝淋巴结转移情况[17],但目前仍缺乏大的随机对照试验结果支持。
本研究存在一些局限和不足,如入组患者较少。由于未能查询到近一半患者的术前肿瘤大小记录且早期失访率极高,因此无法分析肿瘤大小的影响和患者术后生存状态,而国内有文献报道肿瘤大小是预测腋窝淋巴结阳性的预测因子[18-19]。在国内多中心大样本量随机对照研究结果面试之前,建议对前哨淋巴结活检阳性结果1枚、SBRⅠ或者Ⅱ级的早期乳腺癌患者免行ALND,并积极接受辅助治疗。
1 Lucci A, McCall LM, Beitsch PD, et al. Surgical complications associated with sentinel lymph node dissection (SLND) plus axillary lymph node dissection compared with SLND alone in the American College of Surgeons Oncology Group Trial Z0011[J]. J Clin Oncol,2007, 25(24): 3657-3663.
2 Krag DN, Anderson SJ, Julian TB, et al. Sentinel-lymph-node resection compared with conventional axillary-lymph-node dissection in clinically node-negative patients with breast cancer: overall survival findings from the NSABP B-32 randomised phase 3 trial[J].Lancet Oncol, 2010, 11(10): 927-933.
3 Goldhirsch A, Ingle JN, Gelber RD, et al. Thresholds for therapies:highlights of the St Gallen International Expert Consensus on the primary therapy of early breast cancer 2009[J]. Ann Oncol, 2009,20(8): 1319-1329.
4 Giuliano AE, Ballman K, McCall L, et al. Locoregional Recurrence After Sentinel Lymph Node Dissection With or Without Axillary Dissection in Patients With Sentinel Lymph Node Metastases: Longterm Follow-up From the American College of Surgeons Oncology Group (Alliance) ACOSOG Z0011 Randomized Trial[J]. Ann Surg, 2016, 264(3): 413-420.
5 Galimberti V, Cole BF, Zurrida S, et al. Axillary dissection versus no axillary dissection in patients with sentinel-node micrometastases(IBCSG 23-01): a phase 3 randomised controlled trial[J]. Lancet Oncol, 2013, 14(4): 297-305.
6 Delpech Y, Bricou A, Lousquy R, et al. The exportability of the ACOSOG Z0011 criteria for omitting axillary lymph node dissection after positive sentinel lymph node biopsy findings: a multicenter study[J]. Ann Surg Oncol, 2013, 20(8): 2556-2561.
7 Morrow M, Giuliano AE. To cut is to cure: can we really apply Z11 in practice[J]. Ann Surg Oncol, 2011, 18(9): 2413-2415.
8 Krag DN, Anderson SJ, Julian TB, et al. Technical outcomes of sentinel-lymph-node resection and conventional axillary-lymphnode dissection in patients with clinically node-negative breast cancer: results from the NSABP B-32 randomised phase III trial[J].Lancet Oncol, 2007, 8(10): 881-888.
9 Mamounas EP, Kuehn T, Rutgers EJT, et al. Current approach of the axilla in patients with early-stage breast cancer[J/OL]. http://linkinghub.elsevier.com/retrieve/pii/S0140-6736(17)31451-4.
10 Chen JJ, Chen JY, Yang BL, et al. Comparison of molecular analysis and touch imprint cytology for the intraoperative evaluation of sentinel lymph nodes in primary breast cancer: results of the China Breast Cancer Clinical Study Group (CBCSG) 001c trial[J]. Eur J Surg Oncol, 2013, 39(5): 442-449.
11 Poodt IGM, Spronk PER, Vugts G, et al. Trends on Axillary Surgery in Nondistant Metastatic Breast Cancer Patients Treated Between 2011 and 2015: A Dutch Population-based Study in the ACOSOGZ0011 and AMAROS Era[J/OL]. http://insights.ovid.com/pubmed?pmid=28742702.
12 Ponzone R, Ruatta F, Gatti M, et al. Omission of axillary dissection after a positive sentinel lymph-node: Implications in the multidisciplinary treatment of operable breast cancer[J]. Cancer Treat Rev, 2016, 48 : 1-7.
13 Cyr AE, Tucker N, Ademuyiwa F, et al. Successful Completion of the Pilot Phase of a Randomized Controlled Trial Comparing Sentinel Lymph Node Biopsy to No Further Axillary Staging in Patients with Clinical T1-T2 N0 Breast Cancer and Normal Axillary Ultrasound[J].J Am Coll Surg, 2016, 223(2): 399-407.
14 Veronesi U, Viale G, Paganelli G, et al. Sentinel lymph node biopsy in breast cancer: ten-year results of a randomized controlled study[J].Ann Surg, 2010, 251(4): 595-600.
15 Giuliano AE, Hunt KK, Ballman KV, et al. Axillary dissection vs no axillary dissection in women with invasive breast cancer and sentinel node metastasis: a randomized clinical trial[J]. Jama, 2011, 305(6): 569-575.
16 Koca B, Kuru B, Ozen N, et al. A breast cancer nomogram for prediction of non-sentinel node metastasis - validation of fourteen existing models[J]. Asian Pac J Cancer Prev, 2014, 15(3):1481-1488.
17 Zhang J, Li X, Huang R, et al. A nomogram to predict the probability of axillary lymph node metastasis in female patients with breast cancer in China : A nationwide, multicenter, 10-year epidemiological study[J]. Oncotarget, 2017, 8(21): 35311-35325.
18 万舰, 王永南, 韩晓蓉, 等. 前哨淋巴结阳性乳腺癌患者的临床病理特征与非前哨淋巴结转移的关系[J]. 中华乳腺病杂志(电子版), 2015, 9(2): 25-28.
19 李涌涛, 张晨光, 王晓文, 等. 早期乳腺癌前哨淋巴结阳性腋窝进一步处理的探讨[J]. 中国普通外科杂志, 2015, 24(11):1536-1540.

