顶空气相色谱法测定兔肉中挥发性风味物质己醛和己酸
邓大川,贺稚非,2,张东,吴练军,李洪军,2*
1(西南大学食品科学学院,重庆,400715) 2(重庆市特色食品工程技术研究中心,重庆, 400715)
兔肉,以其“四高四低”的营养特点[1]在国外被视为功能性肉制品[2]。然而,中国大部分人认为兔肉有腥味[3],肉的风味很大程度上影响着消费者的购买行为[4],兔肉腥味很大程度上制约了兔肉的消费,研究兔肉腥味物质的组成和含量可以为研究脱腥提供一定的理论基础,进而提高消费者对兔肉的接受度。
兔肉腥味是指兔肉在加热后所产生的一种令人不愉快的特殊气味[1]。目前,关于兔肉腥味物质的研究非常少,国外对兔肉风味的研究几乎没有,国内学者在兔肉腥味物质的提取鉴定和主要腥味物质的确定方面进行了一些研究,提出了各自观点;姜颖等[5-7]认为中级醛类(尤其是己醛)、卤代烷烃、胺类和呋喃衍生物是兔肉腥味的重要成分;在最近的报道中,谢跃杰等[8-10]利用同时蒸馏萃取、固相微萃取和超临界CO2流体萃取3 种方式萃取兔肉腥味物质,结合气味活度值法进行分析,得出己醛、辛醛、壬醛、己酸等是兔肉腥味的主体成分。
在兔肉腥味物质的研究中,己醛等中级醛因为嗅闻阈值较低、在兔肉挥发性风味物质中含量较高的特点常被认为是兔肉的主要腥味物质。然而,谢等[11]用超临界CO2流体萃取兔肉腥味物质,发现己酸含量高于己醛,并且对兔肉腥味贡献程度高于己醛。己酸,作为一种腥味物质,可以由己醛进一步氧化而来[12],也可以通过亚油酸、油酸、硬脂酸等脂肪酸转化而成[13-15]。但是,围绕己醛和己酸含量的相关研究还未见报道。本文建立了兔肉挥发性风味物质己醛和己酸的顶空气相色谱检测方法。
1 材料与方法
1.1 材料与试剂
兔肉,购自重庆渝北阿兴记肉兔养殖基地,同一饲养环境下75日龄的伊拉兔公兔20只,统一宰杀后,用装有碎冰的保温箱带回实验室进行分割,分别取后腿、前腿、背部和腹部肌肉真空包装,于-18 ℃冻藏,待用。
己酸标品(standard for GC, ≥99.5%),己醛标品(standard for GC, ≥99.0%),正己烷(色谱级,≥98.0%)均购自上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
GC-2010 Plus气相色谱仪,日本岛津公司;HSS 86.50 Plus自动顶空进样器,意大利DANI Instruments S.p.A.公司;BSA323S电子精密天平,赛多利斯科学仪器(北京)有限公司。
1.3 实验方法
1.3.1样品的前处理
将真空包装的冷冻兔肉置于4 ℃冰箱中解冻24 h后,把兔肉切成小块,用家用搅拌机绞碎,随后取出密封,4 ℃冷藏备用。
1.3.2标准溶液的配置
参考RAMONA等[16]的方法,准确称取己醛标品0.100 g于20 mL顶空瓶中,用10 mL正己烷稀释,得到10 mg/mL的己醛标准储备溶液,-18 ℃保存备用;取250 μL标准储备溶液于20 mL顶空瓶中,加入10 mL正己烷稀释,得到浓度为250 μg/mL的己醛标准溶液A;再取100 μL己醛标准溶液A于20 mL顶空瓶中,加入10 mL正己烷稀释,得到浓度为2.50 μg/mL的己醛标准工作溶液(H),4 ℃冷藏待用。取己酸标品0.100 g,重复上述操作,可配置2.5 μg/mL的己酸标准工作溶液HA,4 ℃冷藏待用。
1.3.3顶空条件的优化
固定顶空平衡时间为 30 min, 考察平衡温度为 40、50、60、70、80、90 ℃ 时己醛和己酸响应值的变化趋势,以此确定平衡温度T;固定平衡温度T, 考察平衡时间为5、10、15、20、25、30 min对己醛和己酸峰面积的影响,以此确定平衡时间。顶空定量管温度130 ℃, 传输线温度150 ℃。
1.3.4GC条件
色谱柱:Rtx-Wax (30 m×0.25 mm×0.25 μm);进样口温度 250 ℃;升温程序:40 ℃保持 1 min, 以20 ℃/min升至115 ℃,再以6 ℃/min升至180 ℃(保持3 min),最后以20 ℃/min升至220 ℃(保持3 min);柱流量为1.5 mL/min,流速1.06 mL/min,载气为N2;自动顶空进样器进样,分流比 10∶1;
1.3.5待测样品的制备
准确称量1.3.1中的肉样1.500 g于20 mL顶空瓶中,加入1.5 mL饱和NaCl溶液,立即将顶空瓶密封,轻轻摇匀,然后将顶空瓶放到自动顶空进样器的托盘上,等待进样分析。
1.3.6定性和定量分析
定性分析:在一定的色谱条件下,先利用适宜浓度的己酸和己醛标准溶液确定其保留时间,然后参考肉样中各个挥发性风味物质的保留时间,两相比对完成定性[17]。
定量分析[18]:采用外标法定该化合物的绝对含量。
1.3.7气味活度值法分析[19]
利用气味活度值(odor active value,OAV)法鉴定兔肉主体风味物质;当OAV≥1 时,认为此物质对总体风味有重要贡献;当OAV<1 时,认为此物质对总体风味无贡献。
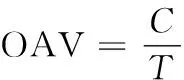
(1)
式中:C为气味物质浓度,即测得的该化合物绝对含量;T,即该化合物的嗅闻阈值。
1.3.8感官评价
制样:将解冻后的兔肉切成形状规则的小块,准确称取5 g兔肉于干净的顶空瓶中,加入5 mL饱和NaCl溶液,立即将顶空瓶密封,轻轻摇匀,放入70 ℃的恒温水浴锅内加热20 min。
感官评定:请10名食品专业硕士研究生(5男5女)对兔肉腥味强度进行感官评分,感官嗅闻时要求评定人员缓缓打开顶空瓶盖,先嗅闻顶空瓶口气体的气息,随后将顶空瓶中的兔肉和汁液倒在干净的滤纸片上,立即嗅闻其气味,然后打分,每人每个样品评价1次,具体评分标准见表1。

表1 兔肉腥味程度的感官评价标准表Table 1 Criteria for sensory evaluation of rabbit meat
1.3.9统计分析
采用SPSS 17.0对实验数据进行单因素方差分析,采用Orign 8.6软件绘图。
2 结果与分析
2.1 色谱条件的确定
由于己酸的极性相对较强,因此,本实验选用Rtx-Wax色谱柱分离己酸。在进样口温度为250 ℃、FID温度250 ℃的条件下,考察了挥发性风味物质己酸和己醛在不同升温程序下的分离效果。通过实验发现,柱箱升温程序为初始温度40 ℃(保持1 min),以20 ℃/min升至115 ℃,再以6 ℃/min升至180 ℃(保持3 min),最后以20 ℃/min升至220 ℃(保持3 min),柱流量为1.5 mL/min,分流比为10∶1时,兔肉挥发性风味物质己酸和己醛的色谱峰与杂质峰有良好的基线分离;其分离效果及出峰顺序见图1。图1-a是己酸和己醛混标的HS-GC-FID图,图1-b是兔肉样品中挥发性风味物质的HS-GC-FID图,图1中峰号1代表己醛,峰号2代表己酸。
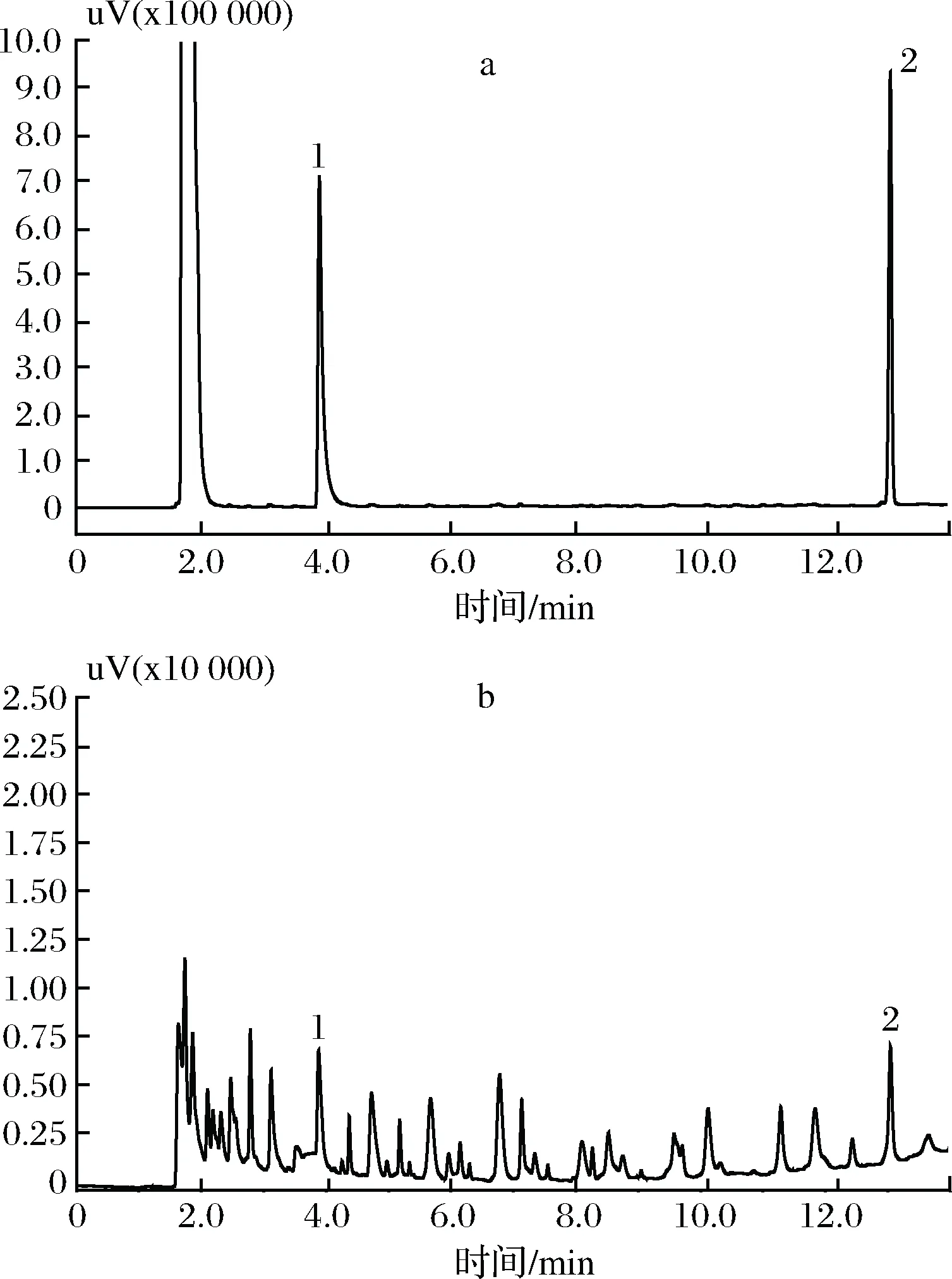
a-己醛和己酸混标的HS-GC-FID图;b-兔肉挥发性风味物质的HS-GC-FID图;1-己醛;峰号2-己酸图1 风味物质己醛和己酸的HS-GC-FID图Fig.1 Typical chromatograms of volatile compounds hexanaland hexanoic acid by HS-GC-FID
在上述色谱条件下,己酸的保留时间为13 min左右,己醛和己酸的分离可在13 min左右完成,分析时长适宜,且可得到尖锐对称的色谱峰,当然13 min后的升温程序是必要的,这能避免一些杂质组分在色谱柱内沉积,污染色谱柱。另外由于基质的不同,己醛和己酸在标液和肉样中流出的时间稍有变化,表2列出了己酸和己醛分别在混标和肉质中的保留时间,相比于两者各自的标准溶液出峰情况,己醛保留时间缩短了0.048 min,己酸保留时间缩短了0.002 min。
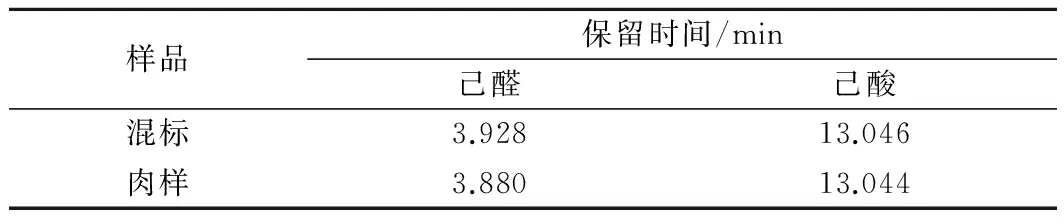
表2 己酸和己醛在混标和肉质中保留时间Table 2 Retention time of hexanal and hexanoic acid inmixed standards and raw rabbit meat
2.2 顶空条件的确定
顶空平衡温度、平衡时间、样品的性质都将影响方法最终的灵敏度[20-21]。本实验首先考察了顶空平衡时间、平衡温度对方法灵敏度的影响,实验结果见图2-a,图2-b。
随着顶空平衡温度升高 , 更多的己醛和己酸从基质中释放到顶空中,从而使顶空的目标分析物浓度增加,进而增加检测方法的灵敏度,并使达到平衡的时间缩短; 但如果平衡温度过高,则会造成蒸汽中水汽含量过高,进样后会对柱子和检测器造成损害。固定顶空平衡时间为 30 min, 分别考察了平衡温度为 40、50、60、70、80、90 ℃ 时己醛和己酸响应值的变化趋势 , 如图2-a所示,平衡温度达到70 ℃后,随着温度的升高,己酸和己醛的峰面积趋于稳定,因此平衡温度确定为70 ℃较为合适。
顶空平衡时间主要由待测组分分子从样品基质到气相的扩散速率决定。固定平衡温度70℃ , 分别考察了平衡时间为5、10、15、20、25、30 min对己醛和己酸峰面积的影响 , 图2-b表明:当平衡时间超过 20 min后,己酸和己醛的峰面积趋于平稳,因此本实验确定的顶空平衡时间为20 min。

a-不同平衡温度下己酸和己醛响应值的变化;b-不同平衡时间下己酸和己醛响应值的变化图2 平衡时间和平衡温度对己醛和己酸响应值的影响Fig.2 Effects of equilibration time and temperatures on theresponses of hexanal and hexanoic acid
盐析作用能提高顶空气相色谱法的检测灵敏度,即在待测样品中加入饱和NaCl溶液来改变挥发性组分的分配系数。在平衡时间为20 min、平衡温度为70 ℃的条件下,实验发现,添加饱和食盐水溶液能够增加检测到的己酸和己醛峰面积,因此本实验在制样时会在顶空瓶中加入适量饱和食盐水溶液。
2.3 线性关系、标准曲线以及检出限
在顶空样品瓶中加入1.5 g干净的玻璃珠和1.5 mL饱和食盐水,制成不含任何己酸和己醛的空白基质[16]。分别向空白基质中加入 3、6、15、30、60 μL己醛标准工作溶液H和己酸标准工作溶液HA,制成质量浓度为5、10、25、50、100 μg/kg的标准样品在确定的最优条件下进行测定(n=3),以目标物的峰面积与对相应的质量浓度(μg/kg)绘制标准曲线[22],如表3所示,己酸和己醛在5~100 μg/k内线性关系良好,相关系数分别为0.999 3和0.999 5。
方法的检测限(LOD)和定量限(LOQ)按照公式LOD=3.3×SDBlank/Slope和LOQ=10×SDBlank/Slope进行计算,Slope是表3中标准曲线的斜率,SDBlank代表使用本方法进行分析时背景响应值的大小,其具体的测定方法是在本实验确定的条件下分析几份空白样品(n=6),然后计算其响应值的标准差得出[23]。此方法下己酸和己醛的检出限(LOD)分别为1.49 μg/kg和2.57 μg/kg,定量限(LOQ)分别为4.5 μg/kg和7.78 μg/kg。

表3 己醛和己酸的线性范围、检测限、定量限、标准曲线方程及相关系数Table 3 Linear rang, limit of detection, limit of quantitation, equations of standard curves andcoefficient R2 of determination of the calibration curve for hexanal and hexanoic acid
2.4 方法的回收率与精密度
向2.3中空白样中添加36 μL 己醛标准工作溶液H,使己醛的最终添加含量为60 μg/kg,按相同的方式制6个平行样品,在本实验确定的最优条件下分析。测得己醛的加标回收率为89%~98%,相对标准偏差为3.81%;向空白样中添加30 μL 己酸标准工作溶液HA,使己酸的最终添加含量为50 μg/kg,重复上述分析方式,己酸的加标回收率为90%~96%,相对标准偏差为2.41%,结果见表4。

表4 方法的回收率与精密度(n=6)Table 4 Recovery and precision of the method (n=6)
2.5 实际样品测定
在本实验确定的最优条件下,使用HS-GC方法测定了兔前腿、兔后腿、背最长和腹部肌肉中挥发性风味物质己醛和己酸的含量,其结果如表5所示。
从表5中可以看出,兔肉中己醛检出量为49.62~ 67.73 μg/kg,腹部和前腿己醛含量并无明显差异,前腿、背部和后腿3个部位己醛含量差异显著;己醛含量由高到低分别是:腹部>前腿>背部>后腿。己酸检出量为10.32~14.92 μg/kg,前腿和后腿己酸含量并无明显差异,后腿、背部和腹部3个部位己酸含量差异显著;己酸含量由高到低分别是:腹部>背部>前腿>后腿。

表5 不同部位兔肉挥发性风味物质己酸和己醛的含量及OAV分析
注:表5中浓度列的肩标字母相同表示差异不显著,不同则表示差异显著(p<0.05)。化合物的嗅闻阈值参考相关文献得出。
表5中列出了不同部位兔肉中挥发性风味物质己酸和己醛的OAV分析,在既定条件下:OAV > 1,说明该组分可能对总体气味有直接影响;且在一定范围内,OAV 值越大说明该组分对总体气味贡献越大。尽管不同部位兔肉中己酸和己醛含量不同,但己醛的OAV值为11.02到15.05之间,己酸的OAV值为9.38到13.5之间,这说明己醛和己酸对兔肉腥味有直接影响,与谢跃杰[10-11]研究结果较为一致。
2.6 不同部位兔肉腥味的感官评价
兔肉腥味是指兔肉在加热后所产生的一种令人不愉快的特殊气味,本实验通过感官评价的方式对基于HS-GC方法的测定结果进行了验证。在图3中,感官得分越高,代表腥味越强,因此从感官嗅闻的角度来说,腥味强度从大到小分别是:腹部>前腿>背部>后腿。值得注意的是,图3中腹部和前腿腥味强度的感官得分并无显著差异,背部和后腿的感官评分差异也不显著,但背部和后腿的感官评分显著低于腹部和前腿,这说明腹部和前腿的腥味明显强于后腿和背部,并且可以通过感官嗅闻的方式分辨出来。

图3 不同部位兔肉腥味程度的感官评价结果Fig.3 Sensory evaluation results of rabbit meat odor indifferent parts of rabbit meat注:图中误差线上方字母相同表示差异不显著,不同则表示差异显著(p<0.05)。
在HS-GC方法的测定结果中,己醛含量由高到低分别是:腹部>前腿>背部>后腿,这和感官实验中腥味强度从大到小的顺序完全吻合。己酸含量由高到低分别是:腹部>背部>前腿>后腿,这和感官嗅闻的结果稍有出入,但是兔肉腥味是由多种挥发性风味物质共同贡献的结果;并且在一定条件下,OAV 值越大说明该组分对总体气味贡献越大[19],表5中的OAV分析表明己醛对兔肉背部和前腿腥味的贡献比己酸更大,因此尽管实际测量中背部的己酸含量高于前腿,但因为前腿的己醛含量高于背部,所以感官嗅闻得出前腿腥味显著强于背部也是有可能的。总的来说,感官评价的结果和HS-GC方法的测定结果是较为一致的。
3 结论
本研究建立了基于HS-GC-FID的同时测定兔肉中挥发性风味物质己酸和己醛的方法。实验表明该方法前处理简单易行,测定结果准确,能达到所需要的检测目的,此法也适用于其他食品中挥发性风味物质己酸和己醛的检测。
作为挥发性风味物质,兔肉中己醛检出量为49.62~67.73 μg/kg;己酸检出量为10.32~14.92 μg/kg。OAV分析表明己酸和己醛对兔肉腥味有直接影响。
[1]朱成林, 李诚, 付刚,等. 兔肉腥味物质的研究进展[J]. 食品安全质量检测学报, 2015(1):165-169.
[2]DALLE Z A, SZENDRO Z. The role of rabbit meat as functional food.[J]. Meat Science, 2011, 88(3):319.
[3]杨佳艺, 李洪军. 我国兔肉加工现状分析[J]. 食品科学, 2010, 31(17):429-432.
[4]JAYASENA D D, AHN D U, NAM K C, et al. Flavour chemistry of chicken meat: a review.[J]. Asian Australasian Journal of Animal Sciences, 2013, 26(5):732-742.
[5]姜颖, 张振华, 张益民,等. 兔肉腥味物质的提取与鉴定[J]. 分析科学学报, 2002, 18(4):300-302.
[6]张振华, 翟频, 沈幼章,等. 兔肉腥味来源的初步分析[J]. 中国养兔杂志, 1997(5):3-4.
[7]张益民, 张振华, 周培根. 兔肉腥味物质的提取和鉴定[J]. 分析化学, 2001, 29(7):859-859.
[8]XIE Y J, HE Z H, LV J Z, et al. Identification the key odorants in different parts of hyla rabbit meat via solid phase microextraction using gas chromatography mass spectrometry [J]. Korean Journal for Food Science of Animal Resources, 2016, 36(6):719-728.
[9]XIE Y J, HE Z F, ZHANG E, et al. Technical note: Characterization of key volatile odorants in rabbit meat using gas chromatography mass spectrometry with simultaneous distillation extraction[J]. World Rabbit Science, 2016, 24(4):313.
[10]谢跃杰, 贺稚非, 李洪军. 兔肉挥发性风味成分提取效果的比较[J]. 食品科学, 2015, 36(24):147-151.
[11]谢跃杰, 贺稚非, 李洪军. 超临界CO2流体萃取兔肉腥味物质[J]. 中国农业科学, 2016, 49(16):3 208-3 218.
[12]KRUSE A, DAHMEN N, DINJUS E, et al. Oxidation of hexanal to hexanoic acid in supercritical carbon dioxide : 1. Experiments in a tubular reactor and modeling[J]. Journal of Supercritical Fluids, 2006, 39(2):211-219.
[13]AL-HIJAZEEN M, LEE E J, MENDONCA A, et al. Effects of tannic acid on lipid and protein oxidation, color, and volatiles of raw and cooked chicken breast meat during storage[J]. Antioxidants, 2016, 5(2):19.
[14]LAMPI A M, DAMERAU A, LI J, et al. Changes in lipids and volatile compounds of oat flours and extrudates during processing and storage[J]. Journal of Cereal Science, 2015, 62:102-109.
[15]ROWAN D D, ALLEN J M, FIELDER S, et al. Biosynthesis of straight-chain ester volatiles in red delicious and granny smith apples using deuterium-labeled precursors.[J]. Journal of Agricultural & Food Chemistry, 1999, 47(7):2 553-2 562.
[16]BOSSE N D R, WIRTH M, KONSTANZ A, et al. Determination of volatile marker compounds in raw ham using headspace-trap gas chromatography[J]. Food Chemistry, 2017, 219:249-259.
[17]TIAN J Y, YU J, CHEN X G, et al. Determination and quantitative analysis of acetoin in beer with headspace sampling-gas chromatography.[J]. Food Chemistry, 2009, 112(4):1 079-1 083.
[18]杨牢记, 宾艳南, 徐敏锐,等. 内标法和外标法在测定己酸菌发酵液己酸含量中的应用[J]. 酿酒科技, 2016(6):78-81.
[19]刘登勇, 周光宏, 徐幸莲. 确定食品关键风味化合物的一种新方法:“ROAV”法[J]. 食品科学, 2008, 29(7):370-374.
[20]钟金锋. 顶空气相色谱检测技术在乳液聚合和纤维素改性研究中的应用[D]. 广州:华南理工大学, 2012.
[21]BARANI F, DELL'AMICO N, GRIFFONE L, et al. Determination of volatile organic compounds by headspace trap.[J]. Journal of Chromatographic Science, 2006, 44(10):625-630.
[22]ZHANG C Y, LIN N B, CHAI X S, et al. A rapid method for simultaneously determining ethanol and methanol content in wines by full evaporation headspace gas chromatography[J]. Food Chemistry, 2015, 183:169-172.
[23]SHRIVASTAVA A. Methods for the determination of limit of detection and limit of quantitation of the analytical methods[J]. Chronicles of Young Scientists, 2011, 2(1):21-25.
[24]ZHU J, CHEN F, WANG L, et al. Comparison of Aroma-Active Volatiles in Oolong Tea Infusions Using GC-Olfactometry, GC-FPD, and GC-MS.[J]. Journal of Agricultural & Food Chemistry, 2015, 63(34):7 499-7 510.
[26]CALKINS C R, HODGEN J M. A fresh look at meat flavor[J]. Meat Science, 2007, 77(1):63-80.

