皱皮木瓜总酚酸分离纯化工艺及生物活性研究△
肖敏,舒佳为,覃瑞,刘虹,杨光忠
(1.中南民族大学 生命科学学院,湖北 武汉 430074;2.大连民族大学 环境与资源学院,辽宁 大连 116600;3.中南民族大学 药学院,湖北 武汉 430074;4.中南民族大学 民族药学国家级实验教学示范中心,湖北 武汉 430074)
木瓜的正品皱皮木瓜Chaenomelesspeciosa(Sweet)Nakai为蔷薇科贴梗海棠的果实,植物资源丰富,其主要的化学成分包括鞣质类、黄酮类、皂苷类、有机酸、三萜等结构类型,具有抑菌、抗氧化、保肝和抗炎镇痛等药理活性,酚酸类为其主要的活性成分[1-3]。基于此,本文利用大孔树脂对酚酸类分离纯化工艺进行研究,富集总酚酸的含量达到50%以上,并对其抗氧化和抗糖尿病活性进行研究,旨在为后续开发该植物资源,创制新药打下基础[4-5]。
1 仪器与材料
1.1 仪器
可见分光光度计UV1800C(上海美谱达仪器有限公司);旋转蒸发仪RE-200A(上海亚荣生化仪器厂);电子分析天平CP224C(上海奥豪斯仪器有限公司);循环水式多用真空泵SHB-111A(上海卫凯仪器设备有限公司);台式恒温振荡器THZ-B(太仓市实验设备厂);蠕动泵驱动器BT100-2J(保定兰格恒流泵有限公司);Multiskan酶标仪(美国热电Thermo公司);真空冷冻干燥机(丹麦Labogene公司);玻璃层析柱2×30 cm。
1.2 材料
树脂D101、AB-8(上海摩速科学器材有限公司);NKA-9、S-8、HPD750、D1400(郑州华溢科技新材料股份有限公司);超纯水(自制);福林酚、对照品没食子酸、DPPH(1,1-二苯基-2-苦基肼)、ABTS[2-2-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺]、α-葡萄糖苷酶、PNPG(对硝基苯基-α-吡喃葡萄糖苷)、阿卡波糖(上海源叶生物科技有限公司);α-淀粉酶、starch azure(SIGMA);甲醇、乙醇、乙酸、Na2CO3、铁氰化钾、三氯乙酸、FeCl3、K2S2O8、AR(国药集团化学试剂有限公司);DMSO(Sigma-aldrich VETEC试剂)。
皱皮木瓜产地湖北长阳,经中南民族大学生命科学学院刘虹博士鉴定为Chaenomelesspeciosa(Sweet)Nakai。
2 方法与结果
2.1 大孔树脂纯化工艺
2.1.1 总酚酸含量的测定福林酚法[6-7]测定总酚酸含量,标准品没食子酸及待测物全波长扫描见图1。精密称取干燥至恒重的没食子酸对照品100 mg,置于100 mL容量瓶中,加入甲醇溶解并稀释至刻度。量取没食子酸对照品溶液1、2、3、4、5 mL,分别置于100 mL容量瓶中,各加入甲醇定容至刻度,摇匀,分别取1 mL至比色管,加入5 mL体积分数为10%福林酚试剂,反应10 min后加入5 mL质量浓度为2%Na2CO3溶液摇匀,25 ℃条件下静置1 h后在760 nm处测定各标准溶液的吸光度,以没食子酸质量浓度(X))对其吸光度(Y)作曲线,得回归方程Y=0.013 2X-0.000 4,r=0.999 6,总酚含量测定的线性范围为0~50 μg·mL-1。待测样品按照此方法测定。
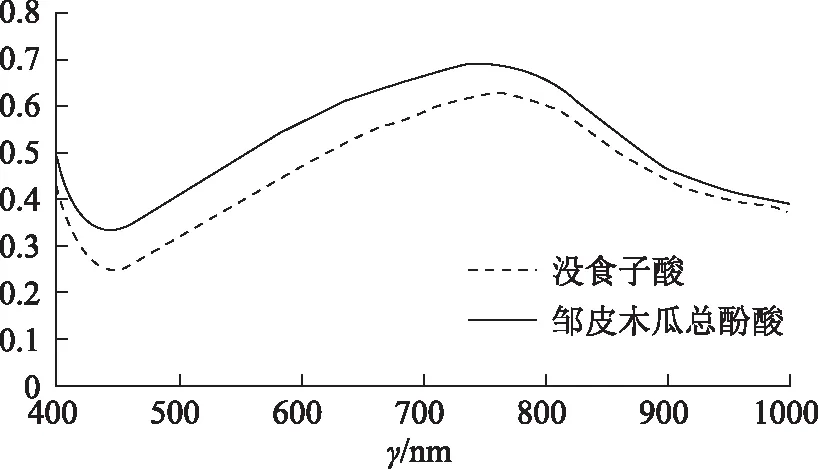
图1 全波长扫描
2.1.2 上样液的制备精确称取一定量皱皮木瓜原药材粉末,以体积分数60%乙醇溶液、1∶40料液比、90 ℃、回流提取5 h为条件,抽滤后弃药渣得到提取液,浓缩至恒重,超纯水溶解,冷冻后用真空冷冻干燥机干燥成粉末,备用。其中皱皮木瓜总酚酸浸膏得率为38.9%(浸膏得率=浸膏质量/原药材质量×100%),总酚酸含量为30.3%(总酚酸含量=总酚酸质量/浸膏质量×100%)。
2.1.3 树脂的筛选将预处理的6种不同型号规格的大孔树脂烘干备用。分别称取上述各型号树脂约2 g,置于150 mL锥形瓶,向其中加入25 mL一定浓度总酚酸溶液,封口膜封口,置于恒温振荡器中,25 ℃、120 r·min-1,振荡24 h,达到吸附平衡后过滤,福林酚法测定滤液总酚酸浓度。将上述过滤的树脂水洗后吸干水分,加入25 mL 60%的乙醇溶液,封口膜封口,置于恒温振荡器,25 ℃、120 r·min-1,振荡24 h,充分解吸后过滤,福林酚法测定滤液总酚酸浓度,结果见表1。可见,D101大孔树脂对皱皮木瓜总酚酸的吸附和解吸能力都很强,最终选用D101。
吸附量=(m0-m1)/G
(1)
吸附率=(m0-m1)/m0
(2)
解吸率=m2/(m0-m1)
(3)
注:m0:吸附前酚酸质量(mg);m1:吸附后酚酸质量(mg);m2:解吸的酚酸质量(mg);G:大孔树脂质量(g)。
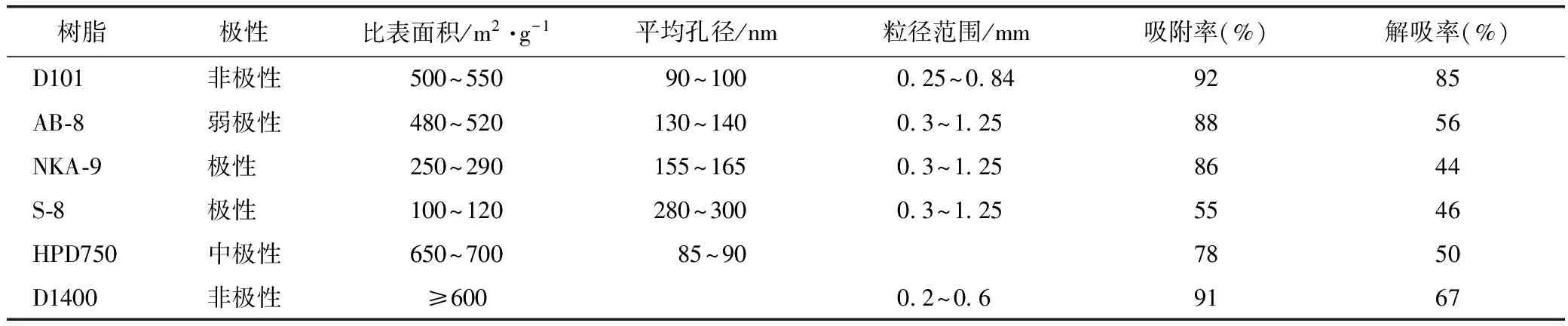
表1 各大孔树脂的静态吸附和解吸性能
2.1.4 动态上样流速、浓度及体积考察取约5 g大孔树脂装柱,将浓度为1 mg·mL-1的总酚酸溶液分别以1、2、3、4、5 BV·h-1的流速进行树脂柱的上样,10 BV后停止上样,测定流出液的酚酸含量。结果见图2,可见随着上样流速的增加,吸附率逐渐下降,考虑到工艺成本和时间效率,确定最佳上样流速为2 BV·h-1。
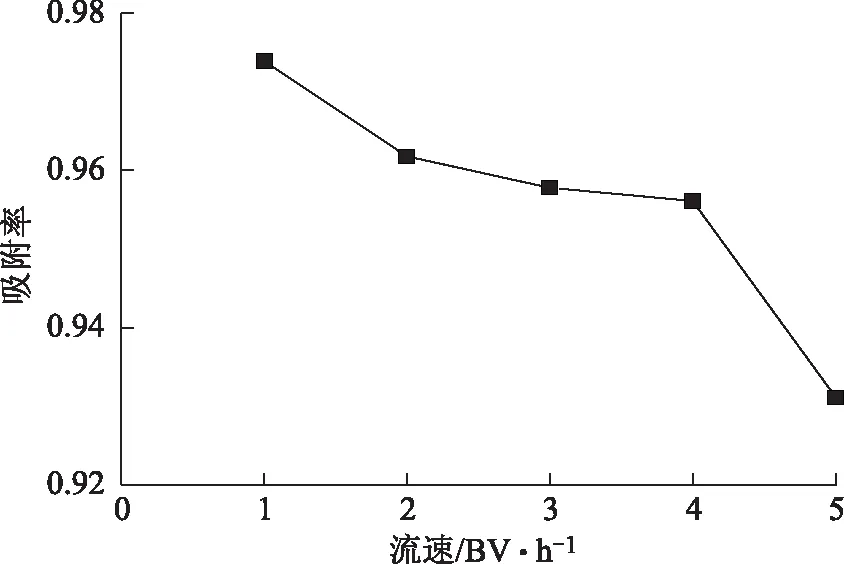
图2 上样流速对D101大孔树脂吸附率的影响
取约5 g大孔树脂装柱,将上样浓度设置为0.5、1.0、1.5、2.0 mg·mL-1的总酚酸溶液以最佳流速上样(2 BV·h-1),收集10 BV后,测定收集液的酚酸含量,结果见图3,可见随着上样浓度的增加,吸附率呈现一个先上升后下降的趋势,说明以D101的特性,不是浓度越大越好,而是在某个区域有很好的吸附能力,最终确定为上样浓度为1.0 mg·mL-1。
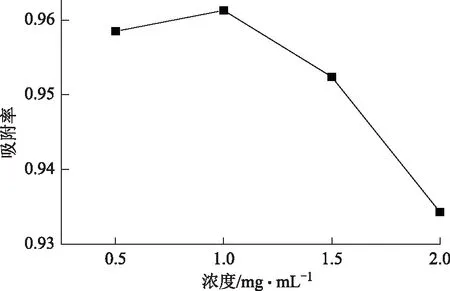
图3 上样浓度对D101大孔树脂吸附率的影响
取约5 g树脂装柱,以最佳浓度及流速上样40 BV,以1 BV为单位收集流出液,测定每个BV的酚酸浓度,结果见图4,可见随着收集液的逐渐流出,到第20个柱体积酚酸含量有明显的渗漏,说明此时达到了D101的饱和吸附量,再上样吸附效果会变差,超过载荷,最终确定上样体积为20 BV,即树脂的饱和吸附量为100 mg·g-1。
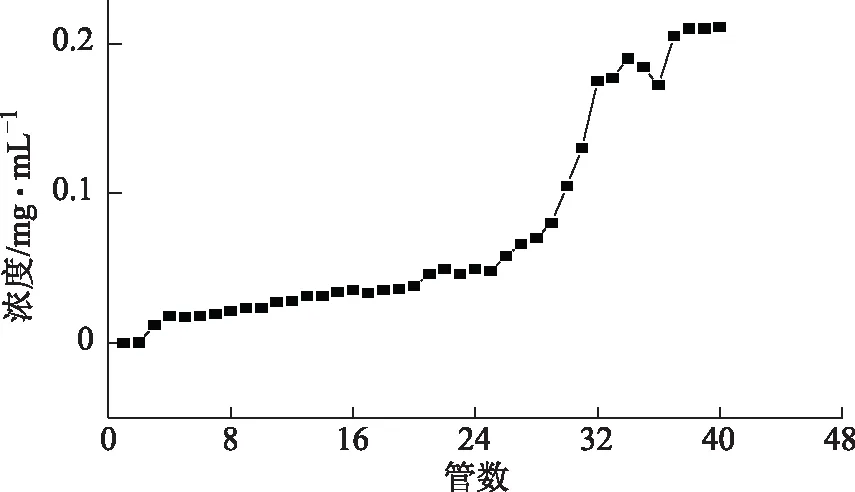
图4 泄露曲线
2.1.5 水洗流速及体积考察上样结束后,树脂表面以及层析柱内壁会附着一些水溶性多糖及皂苷等,此时需要用水将这些未被大孔树脂吸附的物质除去。
取约5 g树脂装柱,以浓度近似1.0 mg·mL-1,2 BV·h-1的流速上样10 BV,不同的水洗流速洗脱,以1 BV为单位收集流出液,合并相同流速收集的洗脱液,测定酚酸浓度,见图5。结果显示,随着洗脱流速增加,流出的酚酸量也随之增加,最后确定为2 BV·h-1进行超纯水洗脱。
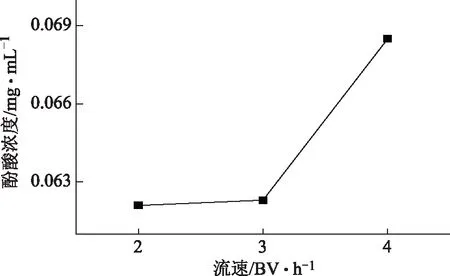
图5 除杂用水流速的选择
取约5 g树脂装柱,以浓度近似1.0 mg·mL-1,2 BV·h-1的流速上样20 BV,2 BV·h-1水洗流速洗脱,以1 BV为单位收集流出液,以酚酸浓度为检测指标,测定每个BV的酚酸浓度,结果见图6,发现直至第5 BV酚酸泄漏量明显减少,确定进行超纯水洗脱的体积为4 BV。
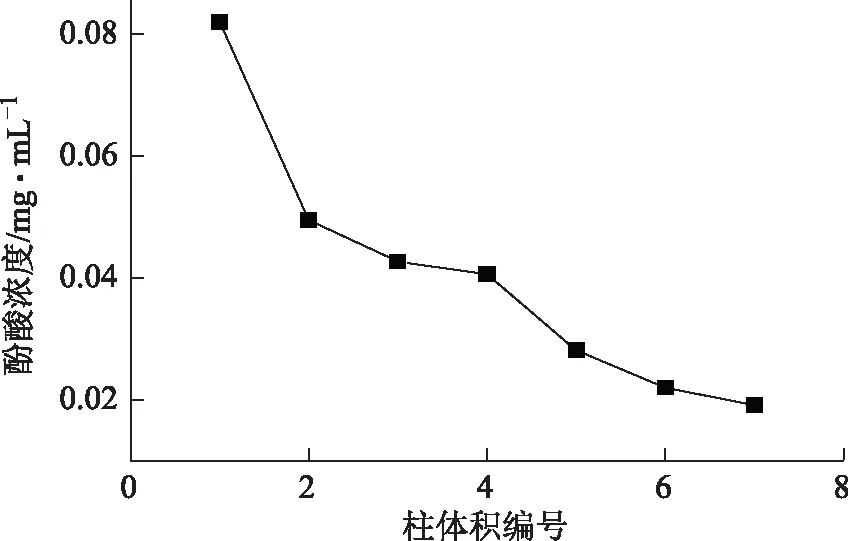
图6 除杂用水量的选择
2.1.6 乙醇洗脱浓度、流速及体积考察由皱皮木瓜原药材提取工艺可见,60%的乙醇对总酚酸具有很好的溶解能力,待树脂吸附样品,超纯水除杂后,使用乙醇溶液进行解吸。
取约5 g树脂装柱,以浓度近似1.0 mg·mL-1,2 BV·h-1的流速上样10 BV,收集流出液1,用2 BV·h-1的流速的超纯水洗脱4 BV,收集洗脱液2,将乙醇浓度设置为20%、40%、60%、80%为上样洗脱浓度,流速为2 BV·h-1,结果见图7。可见当乙醇浓度为60%时洗出酚酸量最多,确定60%的乙醇进行洗脱。
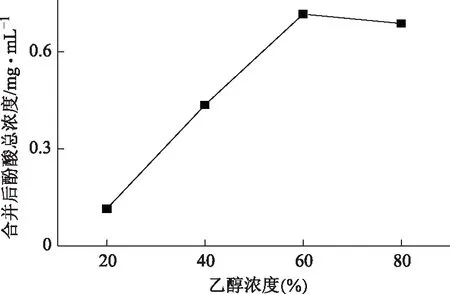
图7 不同浓度乙醇洗脱对D101大孔树脂吸附的影响
取约5 g树脂装柱,以浓度近似1.0 mg·mL-1,2 BV·h-1的流速上样10 BV,收集流出液1,用2 BV·h-1的流速的超纯水洗脱4 BV,收集洗脱液2,用浓度为60%乙醇用不同流速上样,测定酚酸浓度,结果见图8,改变洗脱流速对开始酚酸流出浓度影响较小,然而随着流速的增大,洗脱率降低,最后确定最佳的洗脱流速为4 BV·h-1。
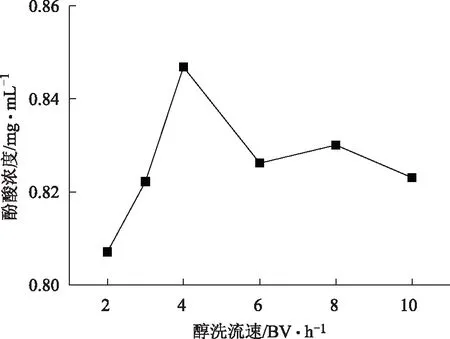
图8 洗脱剂的流速对D101大孔树脂吸附的影响
取约5 g树脂装柱,以浓度近似1.0 mg·mL-1,2 BV·h-1的流速上样20 BV,收集流出液1,用2 BV·h-1的流速的超纯水洗脱4 BV,收集洗脱液2,用浓度为60%乙醇4 BV·h-1流速洗脱,测定每个BV的酚酸浓度,结果见图9,随着洗脱体积的增加,酚酸含量逐渐减少至无,确定洗脱剂的体积4 BV。
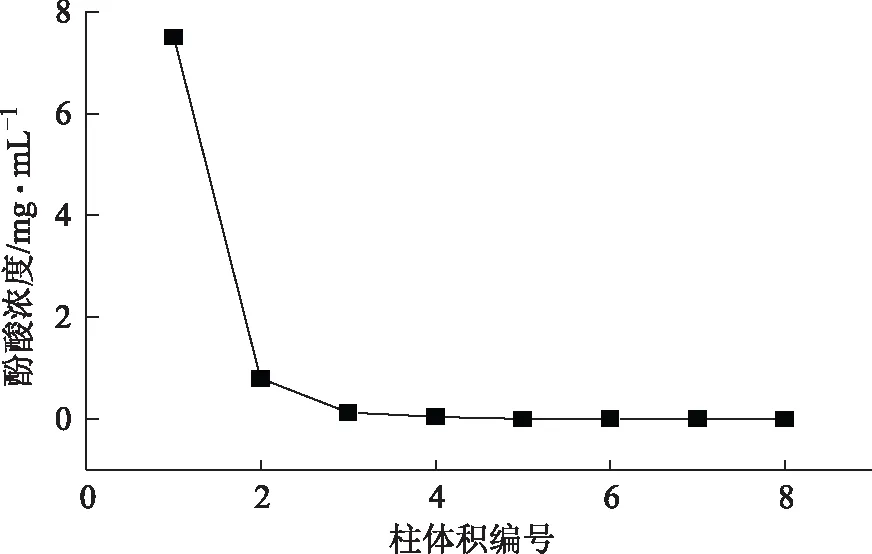
图9 洗脱体积的考察
2.1.7 最佳纯化工艺验证取约5 g D101大孔树脂,装柱,浓度近似1.0 mg·mL-1的皱皮木瓜总酚酸溶液上样,上样流速2 BV·h-1,上样量20 BV,收集流出液1,超纯水除杂,洗脱流速2 BV·h-1,用量4 BV,收集流出液2,60%乙醇溶液解吸,洗脱流速4 BV·h-1,用量4 BV,收集流出液3,分别测定3次流出液的酚酸浓度,获得流出液3的质量。重复3次此实验,获得吸附率和洗脱率及纯化后皱皮木瓜总酚酸的含量。
结果见表2,纯化后总酚酸的含量由30.3%提高到71.1%,相比纯化前提高了2.3倍。
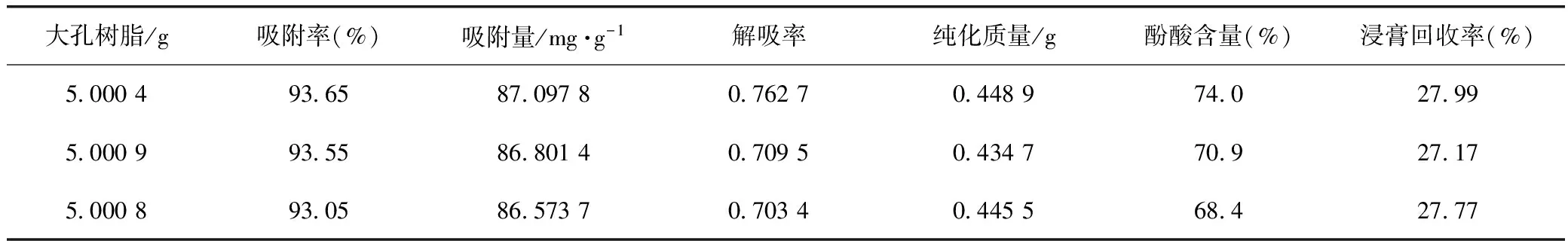
表2 D101大孔树脂纯化皱皮木瓜总酚酸验证试验
注:浸膏的回收率指纯化前后浸膏质量比。
2.2 纯化后待测样品的抗氧化活性初步研究
2.2.1 DPPH自由基清除率测定DPPH(1,1-Diphenyl-2-picrylhydrazyl radical)是稳定的自由基,为清除自由基活性的检测提供了一个理想而又简单的模型。配制不同浓度的样品溶液,加入浓度为0.025 mg·mL-1的DPPH乙醇溶液2 mL,加入等体积的样品溶液,混匀,静置在37 ℃恒温箱20 min,于519 nm处测定溶液吸光度[5]。结果见图10~12,没食子酸IC50=(0.049±0.003)mg·mL-1,抗坏血酸IC50=(0.101±0.011)mg·mL-1,纯化后总酚酸IC50=(0.038±0.006)mg·mL-1。总酚酸清除DPPH自由基能力强于没食子酸和抗坏血酸。
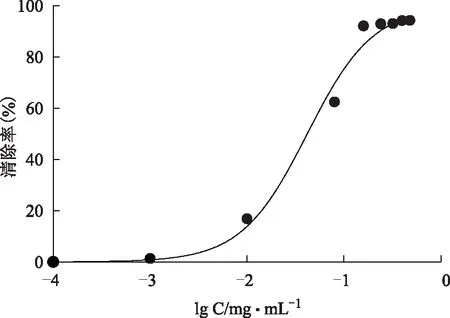
图10 纯化后样品对DPPH·清除率的影响
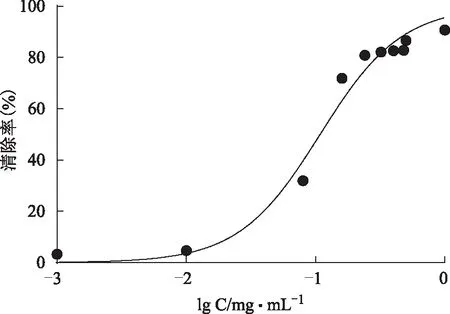
图11 抗坏血酸对DPPH·清除率的影响
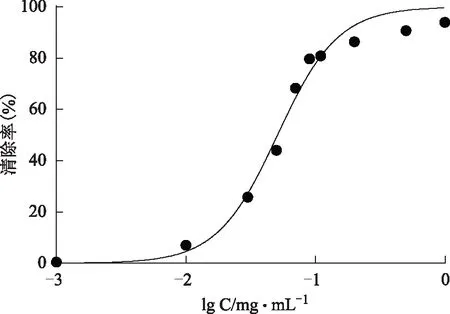
图12 没食子酸对DPPH·清除率的影响
2.2.2 ABTS+·自由基清除能力7.4 mmol·L-1的ABTS 0.2 mL与2.6 mmol·L-1的K2S2O80.2 mL混合均匀,在黑暗条件下,室温静置12~16 h,稀释一定倍数,让A734nm在0.7附近,作为ABTS+·工作液,取0.8 mL工作液与0.2 mL样品溶液,振摇10 s以充分混合,静置6 min后于734 nm处测定吸光度。结果见图13~15,纯化后的总酚酸IC50=(5.428±0.163)mg·L-1,没食子酸IC50=(1.929±0.07)mg·L-1,抗坏血酸IC50=(9.741±0.064)mg·L-1。总酚酸清除ABTS的能力强于抗坏血酸,但小于没食子酸。
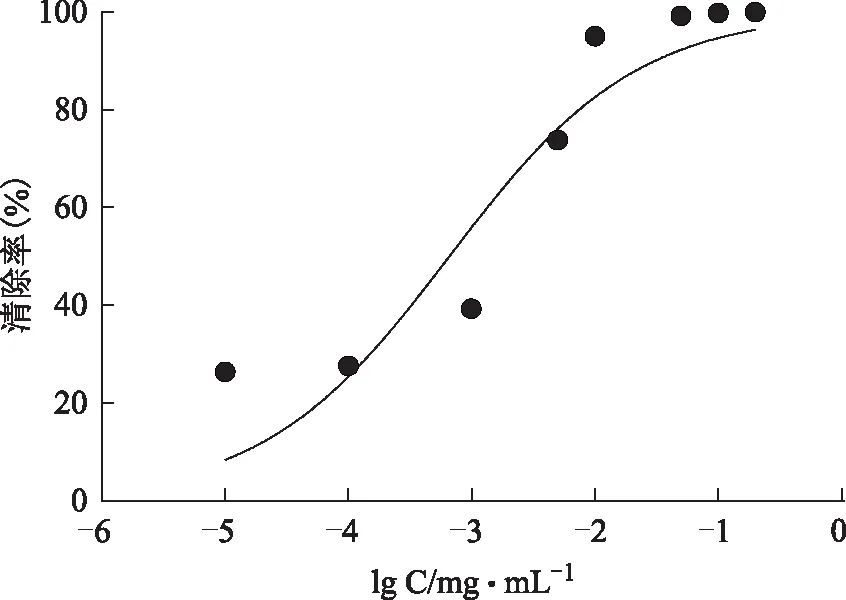
图13 纯化后样品对ABTS+·清除率的影响
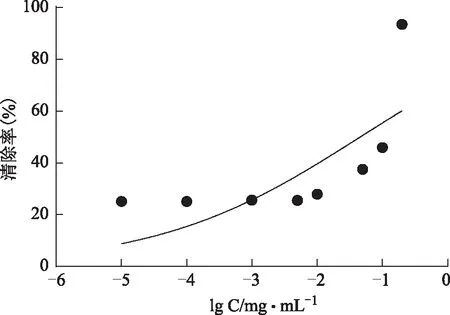
图14 抗坏血酸对ABTS+·清除率的影响
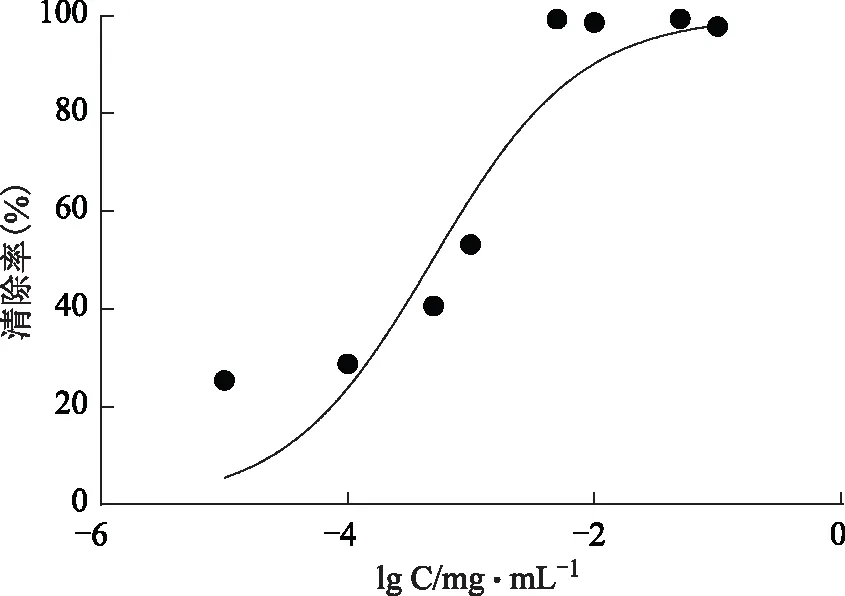
图15 没食子酸对ABTS+·清除率的影响
2.3 纯化后待测样品的抗糖尿病活性的初步研究[8]
2.3.1 ɑ-淀粉酶抑制活性测定ɑ-淀粉酶抑制剂是一种糖苷键水解酶抑制剂,临床上用于防治葡萄糖耐量缺损引起的餐后高血糖及早期糖尿病、高血脂、肥胖等症[8-9]。本实验探究纯化后样品是否具有α-淀粉酶抑制剂的功能。
取100 μL Tris-HCl-CaCl2缓冲液至EP管,加100 μL 50% DMSO溶解的样品溶液,加100 μL 6 μg·mL-1ɑ-淀粉酶溶液,37 ℃恒温箱静置,同时制备底物,100 mg溶解于10 mL Tris-HCl-CaCl2缓冲液,煮沸5 min后转移至恒温箱,37 ℃静置5 min,向EP管中加入200 μL底物(将煮沸过程中损失的水分补足至刻度),37 ℃静置20 min后,加500 μL 50%乙酸停止反应,3000 r·min-1,4 ℃离心5 min,取上清液200 μL至96孔板,酶标仪测定吸光度。
I%=1-(A样品组-A样品对照组)/(A空白组-A空白对照组)×100%
(4)
结果见图16~17,阿卡波糖抑制α-淀粉酶活性的IC50值为(0.229±0.007)mg·mL-1,总酚酸的IC50值为(0.34±0.001)g·mL-1。其活性同阳性药物阿卡波糖相当。
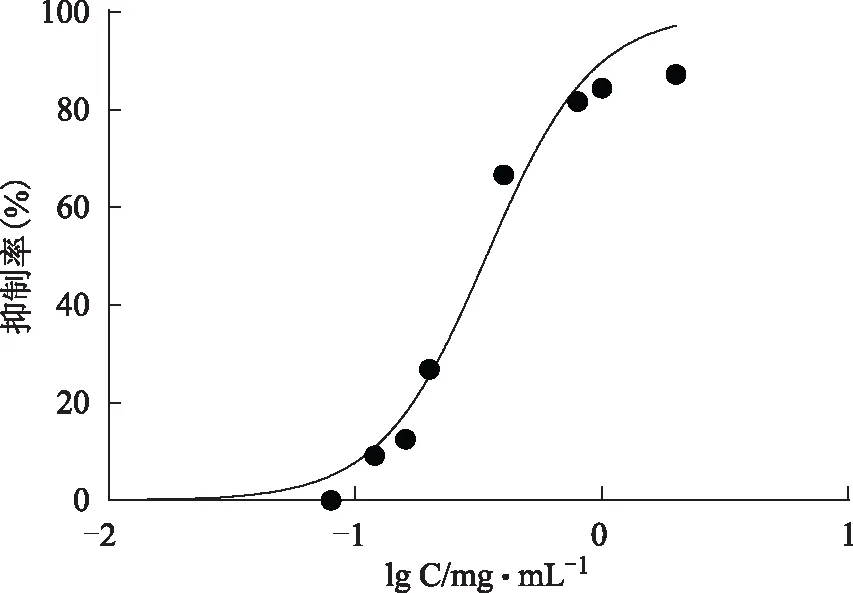
图16 纯化后样品的ɑ-淀粉酶抑制活性曲线
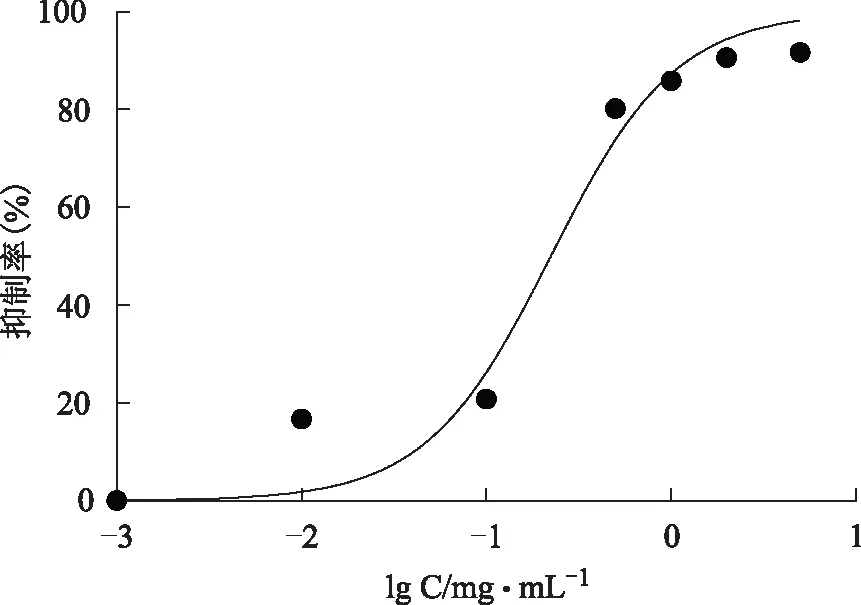
图17 阿卡波糖的ɑ-淀粉酶抑制活性曲线
2.3.2 ɑ-葡萄糖苷酶抑制活性测定α-葡萄糖苷酶抑制剂的研究一直是抗糖尿病机制研究中很活跃的方面[10]。实验探究纯化后样品是否具有ɑ-葡萄糖苷酶抑制剂的功能。
取80 μL磷酸缓冲液于96孔板,加入4 U·mL-1酶液30 μL,15 μL DMSO溶解的样品,37 ℃反应5 min,加入3 mmol·L-1PNPG 30 μL于37 ℃静置15 min后于405 nm处测定吸光度。
I%=1-(A样品组-A样品对照组)/A空白组×100%
(5)
结果见图18~19,阿卡波糖抑制α-葡萄糖苷酶的活性IC50值为(0.426±0.262)g·mL-1,总酚酸IC50值为(0.071±0.024)mg·mL-1,说明总酚酸具有一定的α-葡萄糖苷酶抑制活性。
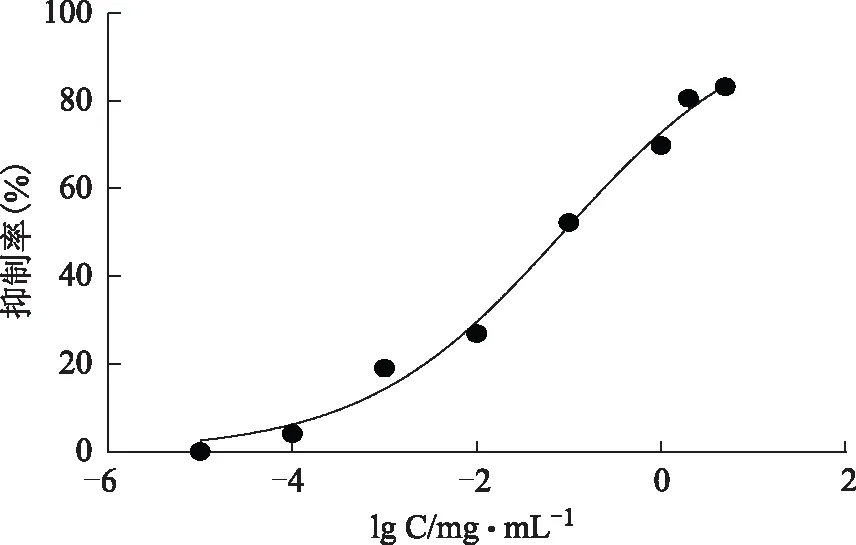
图18 纯化后样品的α-葡萄糖苷酶抑制活性曲线
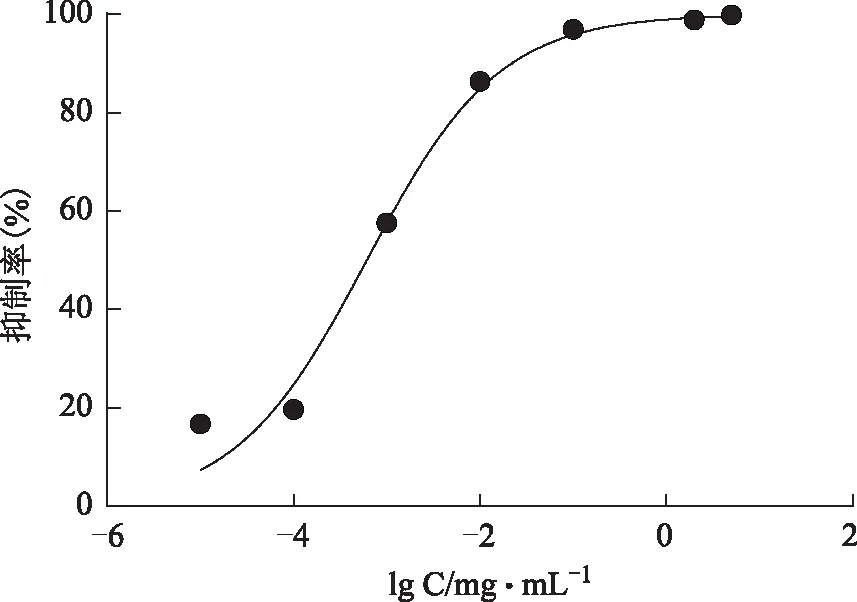
图19 阿卡波糖的α-葡萄糖苷酶抑制活性曲线
2.4 数据处理
使用Origin 8.5、Prism 6.01、SPSS对数据进行图表制作及分析。
3 讨论
本实验通过对皱皮木瓜原药材进行粉碎,乙醇回流加热提取,获得初提物。测定总酚酸含量后,将初提物以水溶解,通过初提液上样吸附→水洗除杂→乙醇洗脱的步骤,得到纯化后的总酚酸,同初提物相比含量提高2.3倍,且工艺稳定可靠。纯化后的总酚酸具有很好的清除DPPH、ABTS+的能力,且与阳性对照药物阿卡波糖相比,总酚酸具有一定的抑制α-淀粉酶和α-葡萄糖苷酶的活性。从相关文献的报道的氧化应激与糖尿病及并发症的关系可以推测,本课题经过纯化的总酚酸在抗糖尿病领域具有潜在的应用前景[11-12]。本课题的研究不仅为皱皮木瓜种质资源的开发利用提供了参考,同时也为后续提升皱皮木瓜产品附加值提供了理论基础。
[1]王云亮,张芬,张华.药用木瓜综合开发利用[J].河北农业科学,2010,14(6):120-122.
[2]刘世尧,白世川,李加纳.皱皮木瓜与光皮木瓜药材品质多性状指标综合评价研究[J].中国中药杂志,2012,38(5):426-430.
[3]刘世尧.不同产区皱皮木瓜有机酸组成及主要成分分离纯化研究[D].重庆:西南大学,2012.
[4]吴立军.实用天然有机化学[M].北京:人民卫生出版社,2007.
[5]付蒙.人面果抗氧化与抗糖尿病活性的初步研究[D].武汉:中南民族大学,2012.
[6]王国军,唐辉,张淑兰.大孔树脂纯化核桃隔膜总黄酮的工艺研究[J].中草药,2013,44(19):2688-2692.
[7]文冰杰,夏厚林,李瑞煜.UV法测定叠鞘石斛中总酚含量方法研究[J].辽宁中医药大学学报,2016,18(1):44-46.
[8]刘流,李芸芳,甘飞.人面果叶子的化学成分研究[J].中国中药杂志,2016,41(11):2098-2104.
[9]Bhandari M R,Nilubon J A,Gao H,et al.α-Glucosidase and α-amylase inhibitory activities of Nepalese medicinal herb Pakhanbhed(Bergenia ciliata Haw.)[J].Food Chemistry,2008,106(1):247-252.
[10] 季芳,肖国春,董莉.药用植物来源的α-葡萄糖苷酶抑制剂研究进展[J].中国中药杂志,2010,35(12):1633-1640.
[11] Shi C C,Wu Y W,Lin W C,et al.Antihyperglycemic and antioxidant properties of Anoectochilus Formosanus in diabetic rats[J].Clin Exp pharmacol,2002,29(8):684-688.
[12] 金雷,薛宏宇,金礼吉.抗氧化剂在糖尿病中的应用研究进展[J].现代生物医学进展,2008,8(2):383-385.

