肺部恶性小结节危险因素分析及恶性预测模型建立
近年来,随着人们健康意识的提高以及高分辨率CT体检的普及,肺部小结节的检出率逐年上升。肺结节被定义为肺内直径≤3 cm的类圆形或不规则形病灶,影像学表现为密度增高的阴影,可单发或多发,边界清晰或不清晰。其中≤2 cm的称为小结节[1]。研究[2]发现,直径>1 cm的肺部小结节恶性概率高达50%~60%。因此肺部恶性小结节的早诊断、早治疗对预后具有重要意义。常规的诊断方法,如纤支镜检查、EBUS、TBNA、经皮肺穿刺及痰脱落细胞学检查等对肺部恶性小结节诊断假阴性率较高[3]。部分患者需通过手术的方式获取病理组织进行良恶性鉴别,诊断率较高,但创伤较大。为减少“不必要的手术”,对于肺小结节良恶性鉴别需综合多项因素分析。因此本研究回顾性分析本院收治的100例肺部小结节患者的临床资料,探讨恶性病变预测数据模型。现报道如下。
1 资料与方法
1.1一般资料随机选取2017年1月至2017年6月南京市胸科医院胸外科手术治疗例肺部小结节病例的100例,其中,男性43例,女性57例;年龄24~75岁,平均(55.98±11.01)岁。肿瘤指标异常者16例,正常者84例。纳入标准:①肺内病灶最大径<2 cm;②术前均在我院行高分辨率CT检查;③术前诊断不明或诊断倾向为恶性病变,术后病理诊断明确。所有患者均行胸部高分辨率CT检查,层厚1 mm。根据我院胸部CT肺窗设定(窗位-650 HU,窗宽800 HU)对肺部结节进行测量,最大径0.4~2 cm,平均为(1.28±0.69)cm。胸部CT示实性结节(solid nodules,SN)30例、部分实性结节(partial solid nodule,PSN) 27例、磨玻璃结节(ground glass nodule,GGN) 43例。病灶位于上叶63例、中心高密度征32例、毛刺征36例、分叶征22例、空泡征7例、胸膜牵拉征21例、血管穿行征35例、纵隔淋巴结肿大5例。依据术后病理学检查结果分为两组,病理显示癌前病变及肺癌纳入研究组,共76例,平均年龄(57.34±11.37)岁,其中非典型腺瘤样增生5例、原位腺癌11例、原位腺癌伴微浸润12例、微浸润腺癌4例、N0腺癌39例(包含3例转移瘤,其中2例乳腺癌转移,1例考虑胃肠癌转移),N1+N2腺癌3例、小细胞肺癌2例(其中1例N0,1例N1)。病理显示良性病变为对照组,共24例,平均年龄(51.67±8.65)岁。其中肺内淋巴结5例、错构瘤4例、机化性肺炎4例、硬化性血管瘤3例、结核2例,弹力斑块形成伴腺样化生2例、胶原结节伴碳末沉积1例、真菌感染1例、纤维组织增生伴胶原化1例、平滑肌瘤样增生1例。
1.2研究方法所有入组患者术前均行高分辨率胸部CT检查,分析患者胸部CT影像学特征,包括小结节的位置、类型及最大径,有无毛刺征、分叶征、空泡征、胸膜牵拉征、血管穿行征,纵隔淋巴结有无肿大(>1 cm)。完善肿瘤指标测定(癌胚抗原、细胞角蛋白19片段、鳞状细胞癌相关抗原、神经元特异烯醇化酶)。对患者的性别、年龄、肿瘤指标、以及胸部CT影像学特征等进行单因素分析。将单因素分析结果中有意义的变量纳入多因素logistic回归分析,计算出风险预测模型,代入恶性预测值(P)=ez/(1+ez),e为自然对数,通过ROC曲线评价其预测价值。
1.3手术方法全组患者均采用胸腔镜手术治疗,对于拟行楔形切除或肺段切除的病例,术前均行CT引导Hookwire系统与亚甲蓝染色联合定位[4]。如病灶位置距离脏层胸膜较近,则先行楔形切除,送检术中冰冻病理。对病灶位置较深,或靠近肺门大血管者,则直接行肺叶切除术。如冰冻病理提示为良性病变、非典型腺瘤样增生、原位腺癌或微浸润腺癌则手术结束。若冰冻病理提示为肺癌,则行肺叶切除及系统性纵隔淋巴结清扫。
1.4观察指标所有患者术前均检测肺癌相关指标(癌胚抗原、细胞角蛋白19片段、鳞癌相关抗原、神经特异烯醇化酶),胸部CT评估GGN、PSN、SN、中心高密度征(病灶中心区域CT值高于病灶周围区域)、毛刺征、分叶征、胸膜牵拉征、血管穿行征。
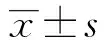
2 结果
2.1单因素分析结果单因素分析表明观察组的平均年龄高于对照组,差异有统计学意义(P<0.05);肿瘤指标异常、病灶位于上叶、病灶类型表现为PSN、有中心高密度征、毛刺征、分叶征、胸膜牵拉征、血管穿行征的患者患有恶性小结节的比例较高,观察组均高于对照组,差异有统计学意义。详见表1。
2.2多因素分析多因素非条件logistic回归分析结果显示病灶位置、GGN、PSN、血管穿行征、分叶征及毛刺征为肺部恶性小结节的独立危险因素。数学预测模型为:恶性预测值(P)=ez/(1+ez),Z=-2.761+(3.204×GGN)+(1.829×PSN)+(1.439×位置)+(2.086×毛刺征)+(2.899×分叶征)+(2.365×血管穿行征)。其中e为自然对数。以术后病理良恶性作为因变量(良性=0,恶性=1),如病灶表现为SN,则GGN和PSN均取值为0,如病灶表现为GGN,则GGN取值为1,否则为0,如病灶表现为PSN,则PSN取值为1,否则为0;病灶位置为上叶,则取值为1,否则为0;毛刺、分叶、血管穿行征均为影像学特征(有为1,无为0)。详见表2。
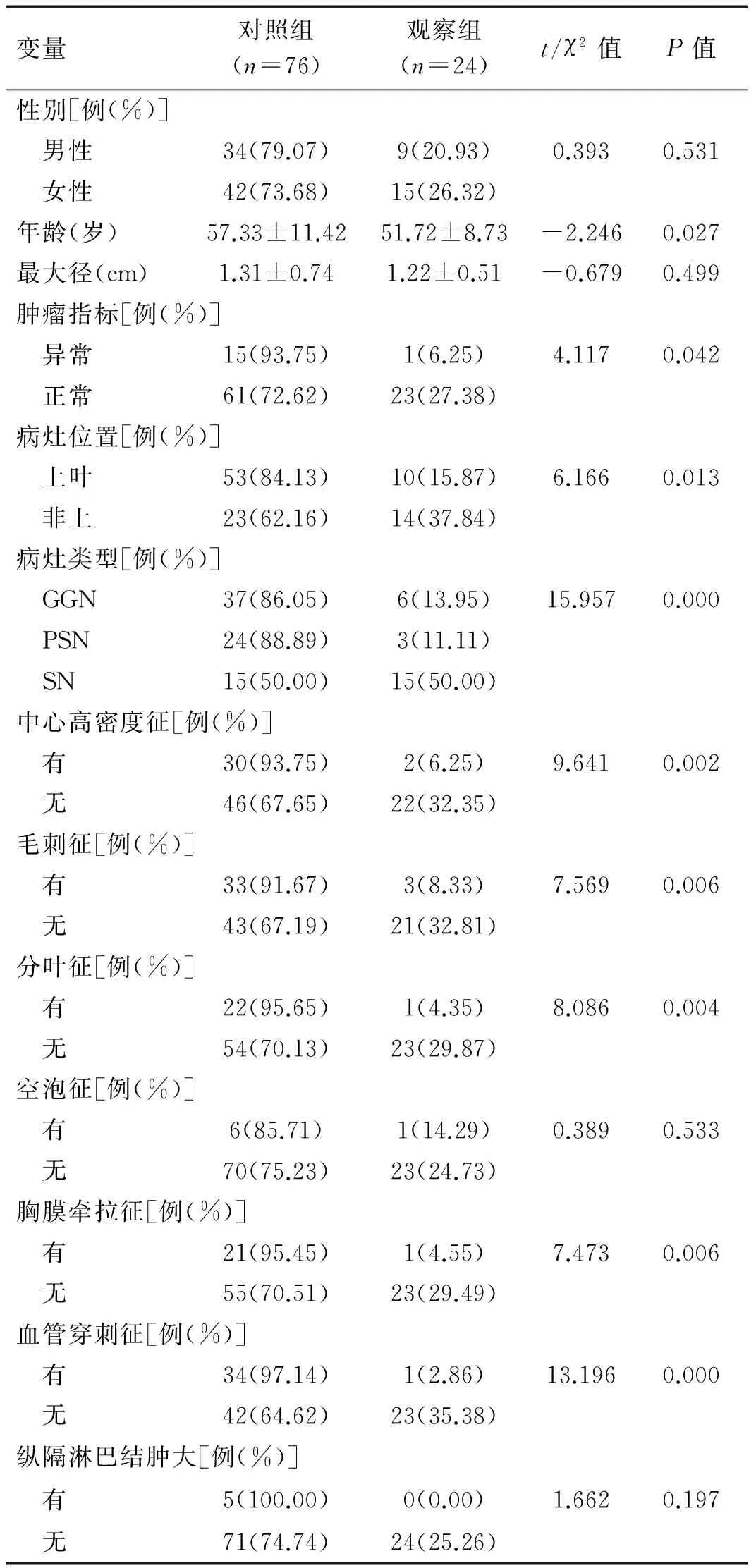
表1 观察组与对照组的临床资料
2.3验证数学预测模型并绘制ROC曲线模型系数的混合检验(χ2=48.927,P=0.000)示模型通过Omnibus检验。最大似然比检验显示最大似然对数值为61.2892,Cox-Snell拟合优度值R2=0.387,Nagelkerke拟合优度值R2=0.579,R2值均小于1;上述结果均说明模型拟合效果很好。Hosmer-Lemeshow检验示(χ2=2.692,P=0.952)模型通过Hosmer-Lemeshow检验。利用Graphpad Prism 6绘制ROC曲线(图1),通过反复计算,最终选取预测概率0.64作为良恶性判断的临界值,模型预测的准确率为87%,敏感性为97.4%,特异性为54.2%,阳性预测值87.1%,阴性预测值为86.7%,示模型效果良好。
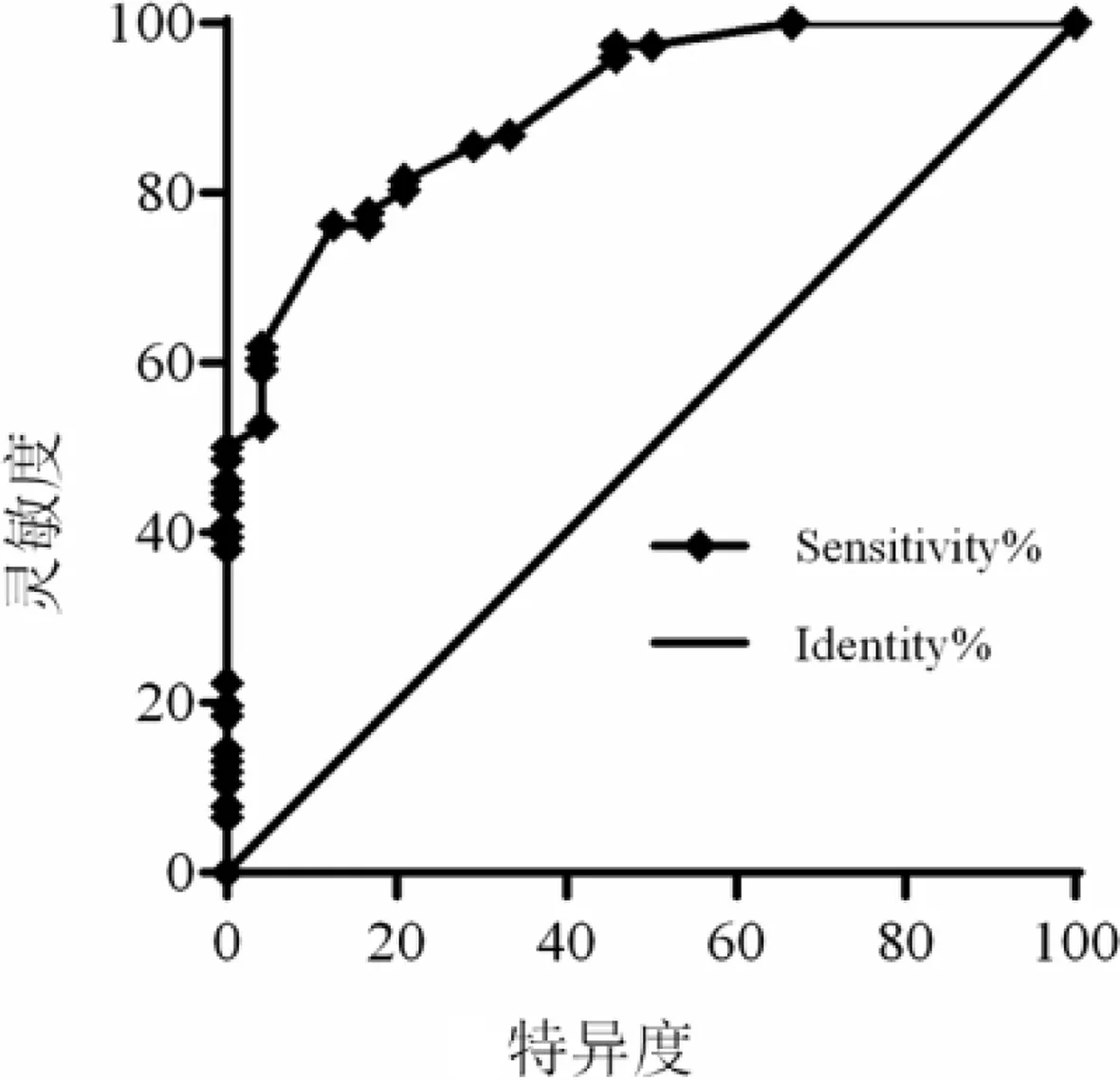
图1 肺小结节恶性概率预测ROC曲线图
表2logistic回归分析结果
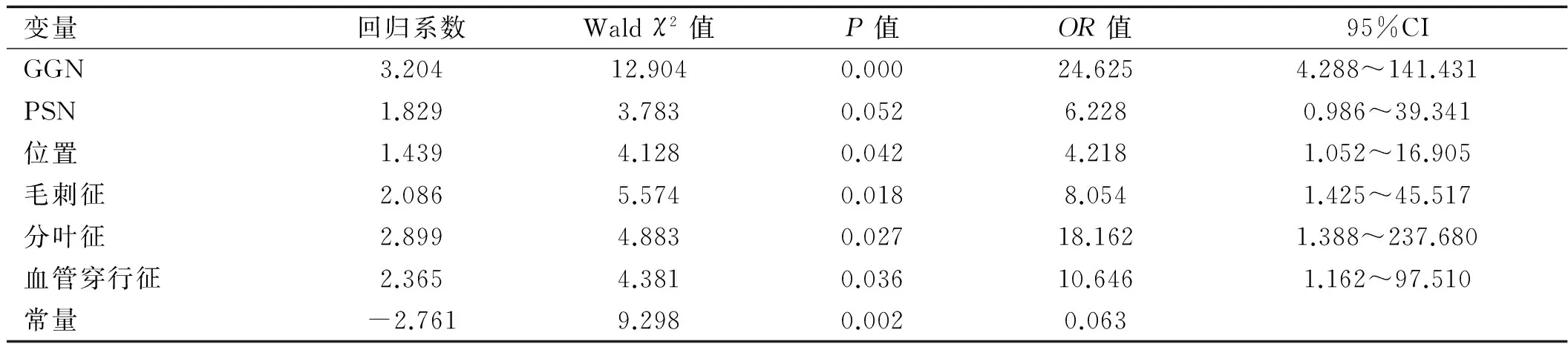
变量回归系数Waldχ2值P值OR值95%CIGGN3.20412.9040.00024.6254.288~141.431PSN1.8293.7830.0526.2280.986~39.341位置1.4394.1280.0424.2181.052~16.905毛刺征2.0865.5740.0188.0541.425~45.517分叶征2.8994.8830.02718.1621.388~237.680血管穿行征2.3654.3810.03610.6461.162~97.510常量-2.7619.2980.0020.063
3 讨论
肺部小结节良恶性判断无明确标准,近年来有多项研究采用数学模型来协助判断肺部小结节良恶性。严四军等[5]的一项研究中建立的肺小结节良恶性预测数学方程为:恶性预测值(P)=ez/(1+ez),Z=-6.657+(0.104×年龄)+(0.718×结节最大直径)+(0.720×分叶征)+(0.514×毛刺征)+(1.409×胸膜脐凹征)。梅奥临床肺癌预测模型[6]被广泛应用于肺小结节恶性程度的评估。其预测模型公式为:恶性概率(P)=ez/(1+ez),Z=6.8272 +(0.0391×年龄)+(0.7917×吸烟史)+(1.3388×恶性肿瘤)+(0.1274×直径)+(1.0407×毛刺征)+(2.365×血管穿行征)。但各种模型中给出的自变量并非完全一致,存在较大出入。但主要集中在患者发病年龄,性别,吸烟史,恶性肿瘤病史,病灶位置,形态(GGN、PSN、SN)、恶性影像学特征(分叶征、毛刺征、胸膜牵拉征、血管穿行征),本次研究重新考量了各个自变量。单因素分析结果显示,恶性小结节其发病年龄较良性组高,符合一般事实,在相同的生活环境下,高龄人群接受到的暴露因素较低龄人群多,免疫机能退化,易患恶性肿瘤。病灶位于上叶者,其恶性几率较高,与梅奥临床肺癌预测模型结果一致[6]。GGN是近年来研究的热点,术后病理多表现为早期肺癌或癌前病变,其影像特点与肺癌的发生及发展存在密切关联。近年来女性患恶性小结节的比例较以往有提高,尤其是表现为肺部小结节的病灶。性别在两组间无显著差异,考虑样本量较小,存在系统误差,无法准确的反应肺癌发病率人群在性别上的分布。即使两组间无明显差异,也有别于既往报道,即男性患肺部肿瘤比例高。在病灶最大径研究上,因为存在结核及机化性肺炎的影响,导致两组间数据无明显差异,与严四军[5]的报道不符。
多因素非条件logistic回归分析建立的结果显示病灶位置(OR=4.218,P=0.042)、GGN(OR=24.625,P=0.000)、PSN(OR=6.228,P=0.052)、血管穿行征(OR=10.646,P=0.036)、分叶征(OR=18.162,P=0.027)及毛刺征(OR=8.054,P=0.018)为肺部恶性小结节的独立危险因素。对比严四军及梅奥临床的两种数学预测模型,毛刺征和分叶征是共有的恶性独立危险因素,而年龄和结节最大直径却不在本次研究所建立的数学模型中,考虑样本量较小。比较OR值及P值,其中病灶类型表现为GGN时,其OR值最大,P值最小,说明在肺结节恶性预测模型中,病灶表现为GGN时,与恶性的相关性最显著。而严四军所建立的模型中,年龄的OR值最大,但本研究模型其诊断灵敏度极高,当计算概率P≥0.64时,提示恶性结节的可能性为87.1%,应积极手术治疗,当计算概率P<0.64时,提示良性病变的可能性为86.7%,可继续予以观察,但存在一定的假阴性率,不能认为肺部结节为良性病灶,不需要手术治疗。因此胸外科医师在面对GGN的诊断时,应提高自身认识,正确对待,合理选择诊疗方式,GGN经皮肺穿刺多不能明确诊断,肿瘤指标常不升高,但不能因此武断认为GGN为良性病变,在不能确定GGN的良恶性时,可参照多种数学预测模型,并做好随访工作,减少肺恶性小结节的漏诊率,做到早期肺癌的早诊断与早治疗。GGN手术治疗预后效果极佳,当考虑为恶性结节时应鼓励患者行手术治疗。
[1]周清华, 范亚光, 王颖, 等. 中国肺部结节分类、诊断与治疗指南(2016年版)[J].中国肺癌杂志, 2016, 19(12):793-798.
[2]SU T H, FAN Y F, JIN L, et al. CT-guided localization of small pulmonary nodules using adjacent microcoil implantation prior to video-assisted thoracoscopic surgical resection[J].Eur Radiol, 2015, 25(9):2627-2633.
[3]LI M, SHEN G, GAO F, et al. CT-guided fine-needle localization of ground-glass nodules in re-aerated lung specimens:localization of solitary small nodules or multiple nodules within the same lobe[J].Diagn Interv Radiol, 2015, 21(5):391.
[4]邵丰, 杨如松, 邹卫, 等. 术前CT引导穿刺定位并亚甲蓝染色在胸腔镜治疗肺部小结节中的应用[J].临床肺科杂志, 2012, 17(10):1840-1841.
[5]严四军, 曹祥, 邓波荣, 等. 恶性肺小结节的危险因素分析及预测模型的建立[J].中国胸心血管外科临床杂志, 2013,(4):441-445.
[6]SWENSEN S J, SILVERSTEIN M D, ILSTRUP D M, et al. The Probability of malignancy in solitary pulmonary nodules:application to small radiologically indeterminate nodules[J].Arch Intern Med, 1997, 157(8):849.

