初诊多囊卵巢综合征患者血清betatrophin水平及其影响因素
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄期女性常见的生殖代谢内分泌疾病,患病率高达5%~10%[1],临床常表现为月经异常、不孕、高雄激素征,卵巢多囊样改变,可同时伴有肥胖、胰岛素抵抗(insulin resistance,IR)、血脂代谢紊乱等代谢异常[2]。虽然目前其发病机制仍不完全明确,但IR以及随之而来的代偿性高胰岛素血症是其确切的发病机制之一,且占PCOS患者发病原因的70%[3]。近期发现的一种由肝脏和脂肪组织分泌的betatrophin,被认为有调节脂代谢、改善糖耐量的双重作用[4]。资料[5-7]显示,在IR的代谢性疾病(糖尿病、肥胖、妊娠期糖尿病等)患者中,均发现血清betatrophin水平较高,目前,国内外对PCOS患者血清betatrophin水平的研究甚少,本研究旨在观察初诊PCOS患者血清中betatrophin的水平,分析其影响因素,探讨其与PCOS的关系。
1 资料与方法
1.1一般资料根据2003年ESHRE/ASRM提出的鹿特丹诊断标准[8],选择2016年8月至2017年3月就诊于安徽医科大学第一附属医院的初诊PCOS患者81例,设为PCOS组,选择同期本院体检中心就诊的30例健康女性为正常对照组。所有受试者均充分知情并自愿参加本研究。
1.2纳入与排除标准PCOS组纳入标准(符合以下3项中的2项,同时排除其他导致高雄激素血症的疾病):①稀发排卵或无排卵(闭经指停经时间≥6个月或3个以上月经周期;月经稀发指月经周期≥35天及每年≥3个月不排卵);②高雄激素的临床或生化表现(面部、前胸及后背等处连续3个月以上多发痤疮,多毛,脂溢性皮炎,总睾酮或雄烯二酮高于实验室正常参考值);③超声检查发现卵巢多囊样改变(一侧或双侧卵巢内直径在2~9 mm的卵泡数量≥12个和/或卵巢体积≥10 mL)。NC组纳入标准:月经周期规律(28~35 d),无高雄激素的临床及生化表现,超声下未发现卵巢多囊样改变。排除标准:①35岁<年龄<18岁;②存在其他引起雄激素升高的疾病,如先天性肾上腺皮质增生、库兴综合征、分泌雄激素的肿瘤等,以及其他引起排卵障碍的疾病,如高泌乳素血症、甲状腺功能异常、卵巢早衰和垂体或下丘脑性闭经等;③存在中、重度肝肾功能不全,或自身免疫性疾病;④存在急慢性感染性疾病;⑤近3个月内服用激素等影响糖脂代谢药物者。
1.3方法
1.3.1一般资料采集由同一人采集所有受试者出生年月、初潮年龄、月经周期、月经开始紊乱的年龄、毛发变化情况等基本信息;同时测量两组受试者身高(m)、体质量(kg)、腰围(cm)、臀围(cm)。计算体质指数(body mass index,BMI);腰臀比(waist to hip,WHR),WHR=腰围/臀围。
1.3.2生化指标测定所有受试者均于清晨空腹(至少禁食8 h)经肘静脉采血(月经规律者于月经周期第2~5天采血,月经不规律或闭经者任意时间)。所有血标本均于室温下静置30 min后以3 600 r/min离心6 min,取血清保存于-80℃冰箱,待统一检测betatrophin。检测指标包括:空腹血糖(fasting blood glucose,FBG)、空腹胰岛素(fasting insulin,FINS)、促黄体生成素(luteinizing,LH)、促卵泡刺激素(follicle stimulating hormone,FSH)、总睾酮(total testostrone,TT)、雄烯二酮(androstendion,AND)、性激素结合球蛋白(sex hormone-binding globulin,SHBG)、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白(high-ddensity lipoprotein,HDL)、低密度脂蛋白(low-ddensity lipoprotein,LDL)。计算稳态模式IR指数(homeostatic model assessment insulin resistance,HOMA-IR):HOMA-IR=(FBG×FINS)/22.5。游离睾酮指数(free testosterone index,FAI)=总睾酮(total testosterone,TT)/SHBG×100。
1.3.3血清betatrophin水平测定采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)(试剂盒购自湖北武汉EIAab公司)测定血清betatrophin水平。
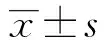
2 结果
2.1两组对象基本临床指标及实验室结果比较两组对象年龄方面差异无统计学意义(P>0.05),PCOS组BMI、WHR、LH、LH/FSH、T、FAI、AND、FBG、FINS、HOMA-IR、TC、TG、HDL、LDL水平高于对照组,SHBG、FSH水平低于对照组,差异均有统计学意义(P<0.01);PCOS组betatrophin水平高于对照组,差异有统计学意义(P<0.05)。详见表1。根据BMI将PCOS组分为非超重组(PCOS-NW,BMI<24 kg/m2),超重或肥胖组(PCOS-OW/OB,BMI≥24 kg/m2)。比较两组betatrophin水平,结果发现PCOS-OW/OB组血清betatrophin水平(166.55±123.75) pg/mL高于PCOS-NW组(112.60±67.92) pg/mL,差异有统计学意义(P<0.05)。
表1PCOS组与对照组临床指标比较
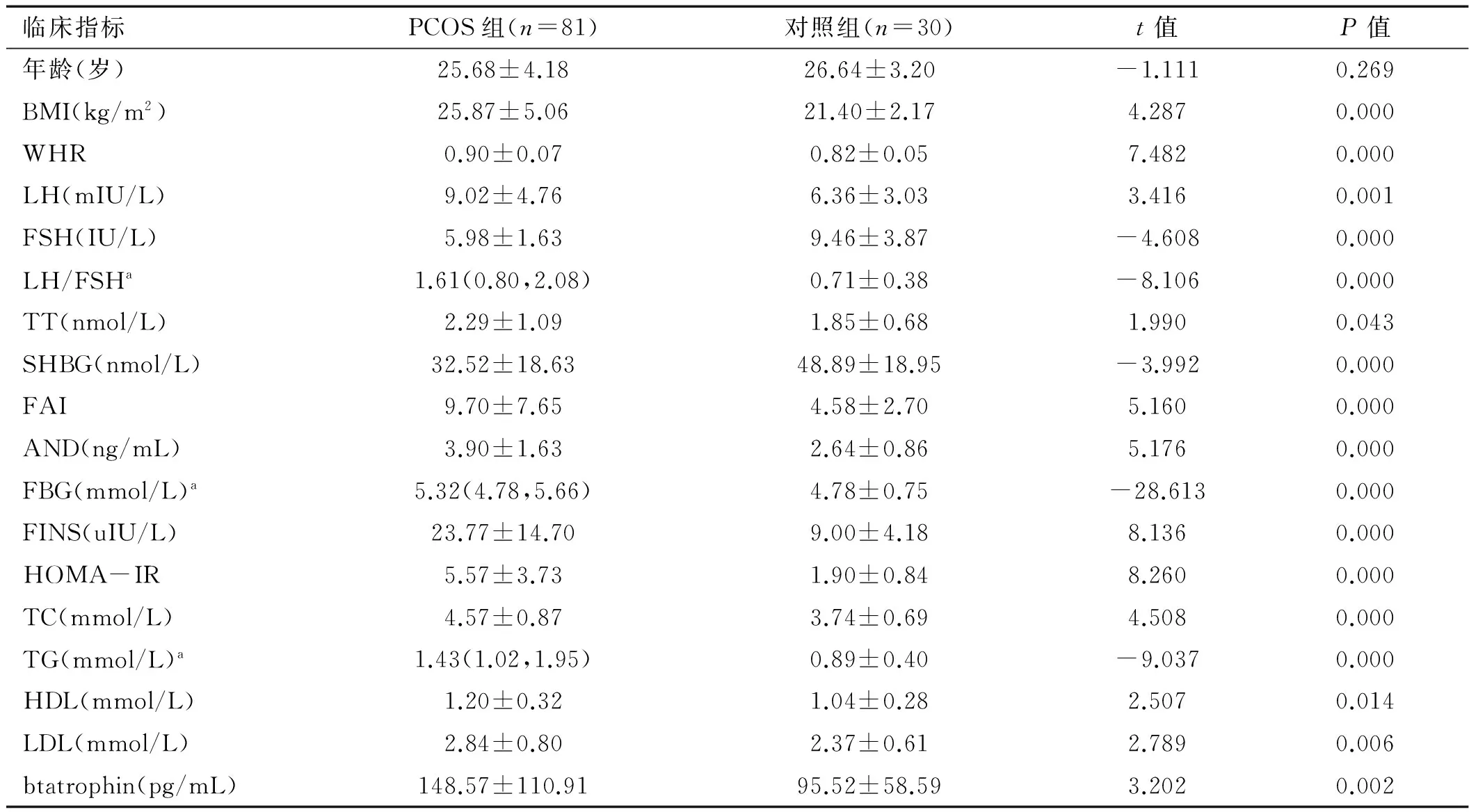
临床指标PCOS组(n=81)对照组(n=30)t值P值年龄(岁)25.68±4.1826.64±3.20-1.1110.269BMI(kg/m2)25.87±5.0621.40±2.174.2870.000WHR0.90±0.070.82±0.057.4820.000LH(mIU/L)9.02±4.766.36±3.033.4160.001FSH(IU/L)5.98±1.639.46±3.87-4.6080.000LH/FSHa1.61(0.80,2.08)0.71±0.38-8.1060.000TT(nmol/L)2.29±1.091.85±0.681.9900.043SHBG(nmol/L)32.52±18.6348.89±18.95-3.9920.000FAI9.70±7.654.58±2.705.1600.000AND(ng/mL)3.90±1.632.64±0.865.1760.000FBG(mmol/L)a5.32(4.78,5.66)4.78±0.75-28.6130.000FINS(uIU/L)23.77±14.709.00±4.188.1360.000HOMA-IR5.57±3.731.90±0.848.2600.000TC(mmol/L)4.57±0.873.74±0.694.5080.000TG(mmol/L)a1.43(1.02,1.95)0.89±0.40-9.0370.000HDL(mmol/L)1.20±0.321.04±0.282.5070.014LDL(mmol/L)2.84±0.802.37±0.612.7890.006btatrophin(pg/mL)148.57±110.9195.52±58.593.2020.002
注:a为非正态分布资料,以中位数(四分位间距)表示,经log转化后进行比较
2.2betatrophin水平与各指标相关性分析以betatrophin水平为因变量,将PCOS组和对照组的基本临床指标及实验室结果比较中差异有统计学意义的指标为自变量,进行Pearson相关分析,结果显示PCOS患者血清betatrophin水平与BMI(r=0.314,P=0.004)、WHR(r=0.339,P=0.002)、FBG(r=0.246,P=0.027)、TG(r=0.336,P=0.002)呈正相关,与其他临床指标均无相关性(P>0.05)。
2.3多元逐步回归分析以血清betatrophin为因变量,以FBG、TG、BMI、WHR为自变量行多元逐步回归分析,结果显示,TG是影响血清betatrophin水平的主要因素。详见表2。
表2PCOS组多元逐步回归分析

项目偏回归系数标准偏回归系数95%CIt值P值常量-242.908--540.266~54.45-1.6270.108BMI1.7150.078-4.263~7.6930.5710.570WHR266.1980.177-121.628~654.0241.3670.176FBG14.5540.128-11.252~40.3611.1230.265TG16.5000.2340.980~32.0202.1170.037
2 讨论
Espes等[9]研究发现,健康人群中betatrophin浓度与年龄呈正相关,本文选择的PCOS组患者与对照组患者年龄差异无统计学意义(P>0.05),排除了年龄因素对试验结果的影响。2013年Yi等[4]在IR小鼠模型中首次发现并命名betatrophin,认为IR可以诱使肝脏分泌betatrophin增加,且有研究[9]表明,高血糖本身不会导致betatrophin水平升高;同时有资料[5-7]显示,在IR的代谢性疾病中,均可发现血清betatrophin水平是升高的,因此推测IR患者体内betatrophin水平较高。本研究中,PCOS组HOMA-IR及betatrophin水平均高于对照组(P<0.05),支持IR导致betatrophin升高的观点;但线性相关分析发现,PCOS组血清betatrophin浓度虽与FBG呈正相关(P<0.05),但与FINS、HOMA-IR并不相关,多元逐步相关分析未发现与二者相关,表明PCOS患者IR与血清betatrophin水平不存在独立相关性。因此,推测betatrophin可能只是代谢性疾病本身引起的一种生化改变,并不是对IR的代偿性反应指标。既往研究[10-15]对血清betatrophin水平与IR间关系存在较大争议,各研究结果间的差异可能与种族差异及样本量等相关,betatrophin与IR之间的关系有待进一步证实。
研究[4]表明,betatrophin在小鼠体内主要由肝脏和脂肪组织表达,在人体内主要由肝脏分泌,动物实验[16-19]证实,betatrophin过度表达的小鼠中,血TG水平大幅度升高,在betatrophin基因敲除的小鼠体内,血TG浓度下降,脂肪酶活性升高,认为betatrophin可能通过抑制脂肪酶活性,调节脂代谢。推测其可能参与了PCOS患者体内的脂代谢紊乱。本研究结果显示,PCOS患者血清betatrophin浓度与TG呈正相关(r=0.336,P<0.01),进一步多元线性相关分析表明TG是betatrophin的独立影响因素,故认为此结果符合推测。
Ren等[20]通过动物实验,推测小鼠betatrophin血清浓度可能与脂肪组织含量相关。资料[5,11]显示,目前对血清betatrophin浓度与超重/肥胖之间的关系研究有较大争议,本研究结果显示,PCOS-OW/OB组血清betatrophin水平高于PCOS-NW组(P<0.05);血清betatrophin水平与BMI、WHR呈正相关(P<0.01),均提示血清betatrophin水平与PCOS患者体内脂肪量呈正相关,故认为betatrophin可能通过增加PCOS患者体质量及腹部脂肪沉积参与PCOS的发生。
本研究结果显示TT、FAI与betatrophin均不相关,Calan等[14]研究表明血清游离睾酮是betatrophin的独立影响因素,与本研究结果不符,可能与本次试验对象处于疾病早期,睾酮水平升高不明显有关。
本研究的优势在于病例组均为初诊患者,无严重的糖脂代谢紊乱,且避免了药物对betatrophin水平的影响,因此,可能更真实地反映PCOS患者血清betatrophin水平。本研究的缺陷在于只单一检测了初诊患者空腹血清betatrophin水平,不能反应其动态变化,今后可检测不同疾病阶段患者的血清水平,进一步探讨其与PCOS的关系。
综上,PCOS患者体内betatrophin水平高于健康人群,TG是其独立的影响因素,betartophin可能与PCOS患者体内的糖、脂代谢紊乱有关,但其与激素间的关系有待进一步研究。
[1]OZDEMIR O, SARI M E, KALKAN D, et al. Comprasion of ovarian stromal blood flow measured by color Doppler ultrasonography in polycystic ovary syndrome patients and healthy women with ultrasonographic evidence of polycystic[J].Gynecol Endocrinol, 2015, 31(4):322-326.
[2]NORMAN R J, DEWAILLY D, LEGRO R S, et al. Polycystic ovary syndrome[J].Lancet, 2007, 370(9588):685-697.
[3]OVALLE F, AZZIZ R. Insulin resistance, polycystic ovary syndrome, and type 2 diabetes mellitus[J].Fertil Steri, 2002, 77(6):1095-1105.
[4]YI P, PARK J S, MELTON D A. betatrophin:a hormone that controls pancreatic β cell proliferation[J].Cell, 2013, 153(4):747-758.
[5]FU Z, BERHANE F, FITE A, et al. Elevated circulating lipasin/betatrophin in human type 2 diabetes and obesity[J].Sci Rep,2014,4:5013.
[6]YAMADA H, SAITO T, AOKI A, et al. Circulating betatrophin is elevated in patients with type 1 and type 2 diabetes[J].Endocr, 2015, 62(5):417-421.
[7]EBERT T, KRALISCH S, WURST U, et al. betatrophin levels are increased in women with gestational diabetes mellitus compared to healthy pregnant controls[J].Eur J Endocrinol, 2015, 173(1):1-7.
[8]Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group.Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS)[J].Hum Reprod,2004,19(1):41-47.
[9]ESPES D, LAU J, CARLSSON P O. Increased circulating levels of betatrophin in individuals with long-standing type 1 diabetes[J].Diabetologia, 2014, 57(1):50-53.
[10]HU H, SUN W, YU S, et al. Increased circulating levels of betatrophin in newly diagnosed type 2 diabetic patients[J].Diabetes care, 2014, 37(10):2718-2722.
[12]ABU-FARHA M, ABUBAKER J, AL-KHAIRI I, et al.
Higher plasma betatrophin/ANGPTL8 level in Type 2 Diabetes subjects does not correlate with blood glucose or insulin resistance[J].Sci Rep,2015,5:10949.
[13]QU Q, ZHAO D, ZHANG F, et al. Serum betatrophin levels are increased and associated with insulin resistance in patients with polycystic ovary syndrome[J].J Int Med Res, 2017, 45(1):193-202.
[14]CALAN M, YILMAZ O, KUME T, et al. Elevated circulating levels of betatrophin are associated with polycystic ovary syndrome[J].Endocr, 2016, 53(1):271-279.
[15]DUAN Y, LIU D, QU H, et al. Decreased circulating levels of betatrophin in Chinese women with polycystic ovary syndrome[J].Int J Cli Exp Med, 2017,10(3):5196-5202.
[16]ZHANG R. Lipasin, a novel nutritionally-regulated liver-enriched factor that regulates serum triglyceride levels[J].Biochem Bioph Res Co, 2012, 424(4):786-792.
[17]QUAGLIARINI F, WANG Y, KOZLITINA J, et al. Atypical angiopoietin-like protein that regulates ANGPTL3[J].P Natl Sci USA, 2012, 109(48):19751-19756.
[18]WANG Y, QUAGLIARINI F, GUSAROVA V, et al. Mice lacking ANGPTL8 (betatrophin) manifest disrupted triglyceride metabolism without impaired glucose homeostasis[J].P Natl Sci USA, 2013, 110(40):16109-16114.
[19]ZHANG R, ABOU-SAMRA A B. Emerging roles of Lipasin as a critical lipid regulator[J].Biochem Bioph Res Co, 2013, 432(3):401-405.
[20]REN G, KIM J Y, SMAS C M. Identification of RIFL, a novel adipocyte-enriched insulin target gene with a role in lipid metabolism[J].Am J Physiol Endocrinol Metab,2012,303(3):E334-E351.

