IL-17BR在炎症性肠病中的表达及其临床意义*
苏婧玲 谢晨曦 范燕云 胡益群 王 琳 任建林
厦门大学附属中山医院消化内科 厦门大学消化疾病研究所 厦门市消化疾病诊治中心(361004)
炎症性肠病(inflammatory bowel disease, IBD)是一种病因不明的肠道非特异性炎症性病变,主要包括克罗恩病(Crohn’s disease, CD)和溃疡性结肠炎(ulcerative colitis, UC)。IBD的病因和发病机制目前仍不甚清楚,与基因易感性、黏膜免疫紊乱、肠道微生态改变以及环境作用均有一定关系[1-2]。大量研究已证实,细胞因子及其相关受体在IBD的发生、发展中发挥重要的免疫效应[3]。白细胞介素17B受体(interleukin-17B receptor, IL-17BR)是一种相对分子质量为56 kDa(1 Da=0.992 1 u)的Ⅰ型单链跨膜蛋白,主要表达于肠道、气管、肾脏等多种组织器官[4-5]。白细胞介素25(interleukin-25, IL-25)可与IL-17BR结合,两者的亲和力高于IL-17B。IL-25属于Th2型细胞因子,在部分自身免疫性疾病模型中可通过启动Th2型免疫应答,同时抑制Th1/Th17型免疫反应,发挥重要的炎症调节功能[6]。有研究发现,IBD患者肠黏膜和血清中存在系统性IL-25表达降低[7],但其受体IL-17BR与IBD患者肠黏膜损伤和全身炎症活动度的关系尚不明确。本研究通过检测IBD患者结肠黏膜和外周血单个核细胞(PBMC)中IL-17BR的表达情况,并分析其与临床炎症活动度和治疗方案的相关性,旨在探讨IL-17BR在IBD发病机制中的作用和临床意义。
材料与方法
一、标本来源
结肠黏膜标本收集自2014年12月—2016年12月厦门大学附属中山医院行结肠镜检查的CD患者40例(其中男25例,女15例;年龄19~52岁;活动期28例,缓解期12例)和UC患者32例(其中男20例,女12例;年龄22~61岁;活动期25例,缓解期7例)。选取同期25例结肠镜检查无明显异常者的结肠黏膜标本作为对照,其中男15例,女10例,年龄23~60岁。PBMC标本选自同期活动期CD患者30例(其中男17例,女13例,年龄21~54岁)、UC患者27例(其中男16例,女11例,年龄23~62岁),对照组为同期健康体检者25例(其中男14例,女11例,年龄24~61岁)。IBD的诊断符合《炎症性肠病诊断与治疗的共识意见(2012年·广州)》[8]。IBD患者入组前1个月均未用过水杨酸制剂、糖皮质激素、免疫抑制剂、生物制剂等。所有UC和CD患者性别、年龄与正常对照组相比差异无统计学意义(P>0.05),入选者留取标本前均签署知情同意书,本研究方案通过厦门大学附属中山医院伦理委员会审核。
二、主要试剂
鼠抗人IL-17BR单克隆抗体购于Novus公司,PE标记的鼠抗人IL-17BR、人TNF-α ELISA试剂盒均购于R&D公司,人淋巴细胞分离液购于GE公司。
三、研究方法
1. 免疫组化法:取入选者内镜活检标本2块,石蜡包埋,5 μm厚连续切片,常规脱蜡,去除内源性过氧化氢酶,微波抗原修复,山羊血清封闭,滴加鼠抗人IL-17BR单克隆抗体(工作浓度1∶100)4 ℃过夜,同时以PBS代替一抗作为空白对照,滴加羊抗鼠IgG二抗(工作浓度1∶200)37 ℃孵育30 min,DAB显色,苏木素复染,中性树胶封片,镜检。
结果判定:以细胞质染色呈棕黄色为阳性细胞,每个样本随机选取5个高倍(×400)视野,计数IL-17BR阳性细胞数,计算IL-17BR阳性细胞占总细胞数的百分比,取均值。
2. PBMC分离和流式细胞仪分析:收集外周静脉血5 mL,用等体积PBS稀释,加入预先装有淋巴细胞分离液的离心管中,2 000×g离心15 min,吸取中间云雾层置于新离心管内;加入适量PBS清洗离心,弃上清液获得PBMC。将分离好的PBMC置于PBS溶液中重悬,调整细胞浓度至1×108/mL,取100 μL PBMC悬液加至实验管和对照管中,然后分别加入10 μL IL-17BR抗体和10 μL同型对照抗体,吹打混匀后于室温避光反应15 min,PBS洗涤后去上清,加入500 μL PBS重悬后上机检测。
3. ELISA法:抽取15例CD患者英夫利西单抗(IFX)治疗前后清晨空腹肘静脉血2 mL,1 500×g离心15 min,提取血清,-80 ℃保存待检。严格按照ELISA试剂盒说明书步骤,测定血清TNF-α浓度。
4. 其他指标:检测并记录IBD患者的CRP和ESR,同时对CD和UC患者分别行克罗恩病活动指数(CDAI)[9]和Mayo评分[10]。
四、统计学分析
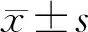
结 果
一、IL-17BR在结肠黏膜中的表达
免疫组化染色显示,IL-17BR主要表达于结肠黏膜固有层单个核细胞内,胞质中可见棕黄色颗粒(图1)。活动期CD、活动期UC、缓解期CD、缓解期UC和正常对照组结肠黏膜IL-17BR阳性表达率分别为26.4%±7.2%、28.2%±8.5%、11.3%±2.5%、15.6%±2.3%和4.3%±1.8%。活动期、缓解期CD和UC组IL-17BR表达均显著高于正常对照组,差异均有统计学意义(P<0.05);活动期CD、UC组均高于缓解期CD、UC组,差异均有统计学意义(P<0.05)。缓解期CD与UC以及活动期CD与UC患者相比差异均无统计学意义(P>0.05)。
二、IL-17BR在PBMC中的表达
流式细胞仪结果显示,CD、UC患者和正常对照组PBMC中IL-17BR阳性表达率分别为23.6%±6.1%、20.6%±7.2%和19.5%±5.8%,组间相比差异无统计学意义(P>0.05)。
三、结肠黏膜IL-17BR表达与CRP、ESR、炎症评分之间的相关性
Spearman相关性分析显示,CD患者结肠黏膜IL-17BR表达与CRP、ESR、CDAI评分呈正相关(r分别为0.70、0.62、0.54,P<0.01),UC患者结肠黏膜IL-17BR表达与CRP、ESR、Mayo评分呈正相关(r分别为0.59、0.52、0.50,P<0.01)(图2)。
四、IFX治疗前后CD患者结肠黏膜IL-17BR和血清TNF-α浓度
免疫组化染色结果表明,IFX治疗后,15例CD患者结肠黏膜IL-17BR阳性率较治疗前显著降低(17.6%±7.0%对30.2%±8.2%),差异有统计学意义(P<0.05)。ELISA结果表明,IFX治疗后,15例CD患者血清TNF-α浓度亦显著降低[(85.9±13.4) pg/mL 对(138.7±26.7) pg/mL],差异有统计学意义(P<0.05)(图3)。
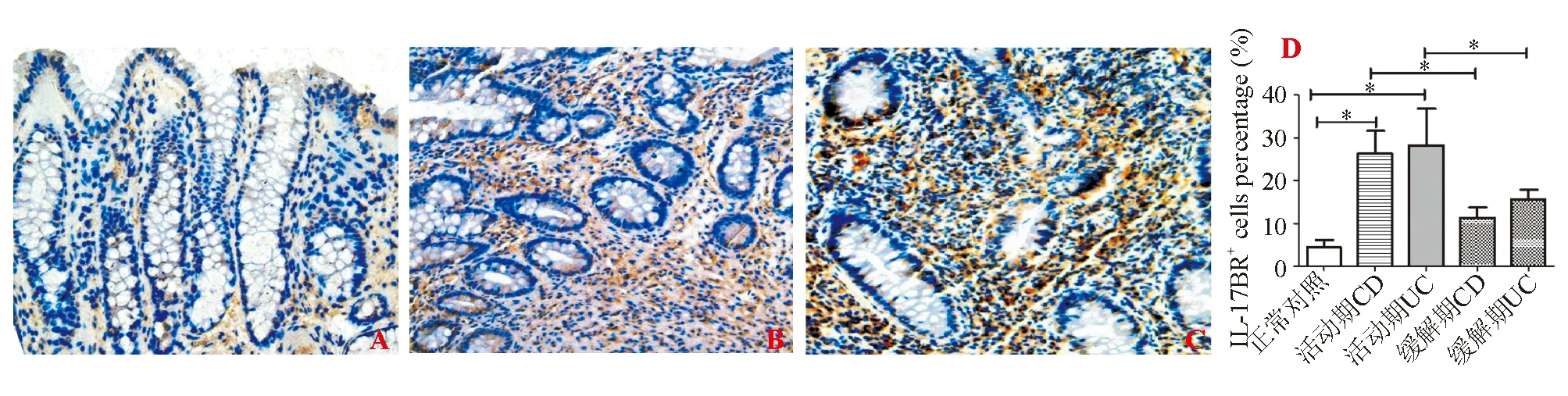
A:正常对照者(免疫组化染色,×200);B:活动期CD患者(免疫组化染色,×200);C:活动期UC患者(免疫组化染色,×200);D:各组IL-17BR表达比较
图1IL-17BR在正常对照者、CD和UC患者结肠黏膜中的表达

A:CD患者结肠黏膜IL-17BR表达与CRP的相关性分析;B:CD患者结肠黏膜IL-17BR表达与ESR的相关性分析;C:CD患者结肠黏膜IL-17BR表达与CDAI评分的相关性分析;D:UC患者结肠黏膜IL-17BR表达与CRP的相关性分析;E:UC患者结肠黏膜IL-17BR表达与ESR的相关性分析;F:UC患者结肠黏膜IL-17BR表达与Mayo评分的相关性分析
图2IBD患者结肠黏膜IL-17BR表达与临床炎症指标和炎症评分的相关性分析
五、IFX治疗前后CD患者血清TNF-α与结肠黏膜IL-17BR表达的相关性分析
IFX治疗前,血清TNF-α浓度与结肠黏膜IL-17BR表达呈正相关(r=0.55,P<0.05);IFX治疗后,血清TNF-α浓度与结肠黏膜IL-17BR表达仍呈正相关(r=0.52,P<0.05)(图4)。
讨 论
作为一种自身免疫性疾病,IBD的病因极其复杂,具体发病机制目前仍不清楚,但细胞免疫在其中占据关键地位。传统观点认为,CD发病过程是一种典型的Th1型免疫反应,而UC倾向于一种非典型的Th2型免疫反应,Th17细胞则在CD和UC发病中均具有重要的促炎效应[11]。各种因素诱发的Th细胞亚群之间的平衡失调,可导致与其相关的一系列细胞因子及其受体的表达发生改变,最终引起IBD炎症应答的启动激活,破坏肠道黏膜。
IL-25属于IL-17家族的细胞因子,广泛表达于人体多种细胞和组织中,如盲肠淋巴结的CD4+T细胞、骨髓来源的肥大细胞、过敏原刺激后的肺上皮细胞和肺泡巨噬细胞等[12],IL-25是IL-17家族中惟一可诱发Th2型免疫反应的成员。相关研究显示,IL-25通过与IL-17BR结合,激活下游一系列转录因子,如NF-κB、STAT6、GATA3、NF-ATC1、JUNNB、MAPK、JNK等,从而导致免疫炎症反应的逐级放大[13-14]。在Th2细胞相关的免疫性病变中,IL-25表达变化通常伴随IL-17BR的相应改变,最终共同起促炎或免疫调节的作用。Corrigan等[15]的研究表明,随着气管炎症的进展,哮喘患者气管黏膜IL-25和IL-17BR表达均显著升高。在胶原诱导的关节炎小鼠模型中,关节组织中IL-17BR mRNA表达明显升高[16]。此外,Grave病患者外周血IL-17BR表达明显升高,且与IL-13表达呈正相关[17]。
IBD作为发生于肠道的自身免疫性疾病,炎症的发生、发展与细胞因子网络及其相关受体的相互作用密切相关。前期研究[7]表明,IBD患者肠黏膜和血清中存在系统性IL-25表达降低,且与炎症指标(CRP、ESR)和内镜评分呈负相关,提示IL-25减少可能是IBD炎症发生的重要因素之一,但其受体IL-17BR与IBD患者肠黏膜损伤和全身炎症活动度的关系尚不明确。Caruso等[18]检测了IBD患者结肠黏膜CD14+细胞的IL-25受体含量,发现IBD患者与正常人之间无明显差异。本研究结果显示,IL-17BR在CD和UC患者结肠黏膜中的表达显著高于正常对照者,尤其是活动期IBD患者,提示在IBD炎症进展过程中,IL-17BR可在结肠黏膜组织炎症部位发挥重要的免疫效应功能,结合其主要效应因子IL-25表达降低,不排除IL-17BR表达升高存在反馈性调节机制。但PBMC中IL-17BR表达在IBD患者和正常对照者间无明显差异,表明IL-17BR的免疫效应可能仅存在于局部炎症肠黏膜而非整体循环。同时本研究发现结肠黏膜IL-17BR表达与临床炎症指标和CDAI、Mayo评分均呈明显正相关,提示肠黏膜IL-17BR浸润情况可反映IBD疾病活动度,再次验证了IL-17BR表达与肠道炎症进展放大密不可分。
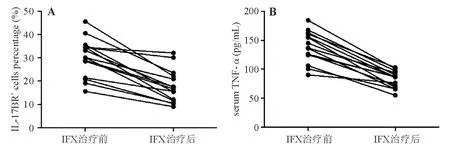
A:IL-17BR表达;B:血清TNF-α浓度
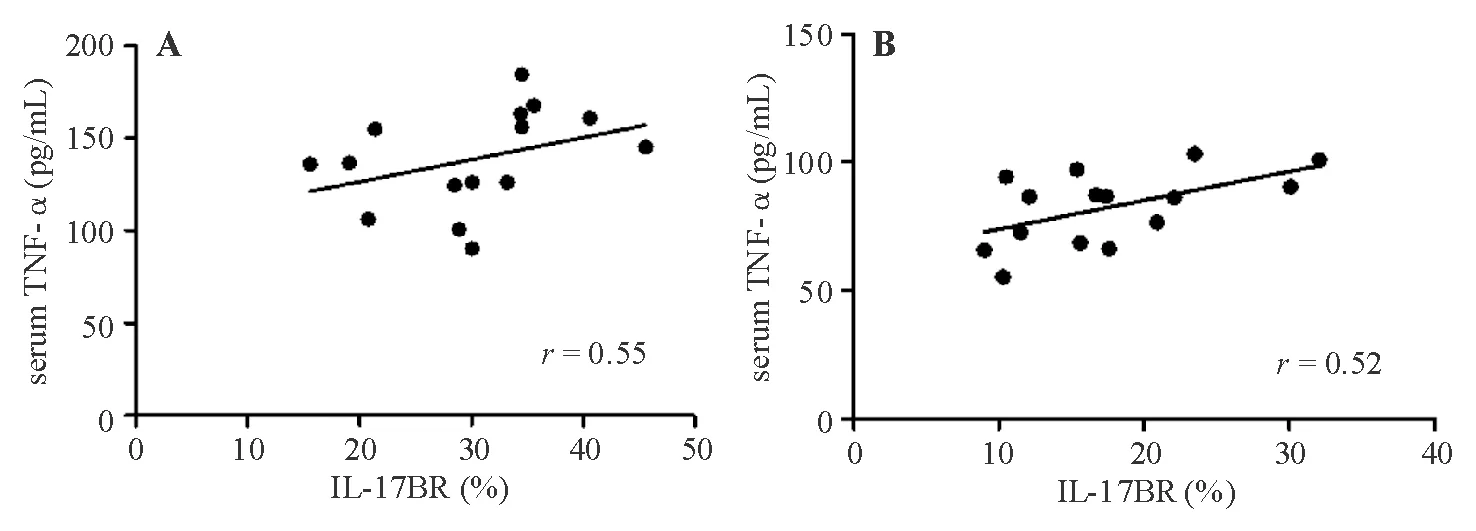
A:IFX治疗前;B:IFX治疗后
TNF-α与其他细胞因子共同参与了IBD炎症的发生,IFX已广泛应用于临床治疗中,对中-重度CD具有良好的疗效。本研究进一步比较发现,CD患者IFX治疗后结肠黏膜IL-17BR表达较治疗前显著下降,血清TNF-α浓度亦降低,且治疗前后均与IL-17BR表达呈正相关。提示结肠黏膜IL-17BR表达升高与TNF-α高水平相关,TNF-α在IL-17BR相关信号通路中可能具有重要作用。但本研究CD患者的蒙特利尔分型不同,不排除在统计中可能出现偏倚,需在后续研究中进一步分类验证。
综上所述,结肠黏膜IL-17BR表达与IBD炎症程度变化密切相关,同时与TNF-α水平存在关联,IL-17BR可能参与了IBD肠黏膜炎症应答,因此可作为反映IBD疾病活动度的指标之一。
1 Chu H. Host gene-microbiome interactions: molecular mechanisms in inflammatory bowel disease[J]. Genome Med, 2017, 9 (1): 69.
2 Loddo I, Romano C. Inflammatory Bowel Disease: Genetics, Epigenetics, and Pathogenesis[J]. Front Immunol, 2015, 6: 551.
3 Fonseca-Camarillo G, Yamamoto-Furusho JK. Immunoregulatory Pathways Involved in Inflammatory Bowel Disease[J]. Inflamm Bowel Dis, 2015, 21 (9): 2188-2193.
4 Chang SH, Dong C. Signaling of interleukin-17 family cytokines in immunity and inflammation[J]. Cell Signal, 2011, 23 (7): 1069-1075.
5 Petersen BC, Dolgachev V, Rasky A, et al. IL-17E (IL-25) and IL-17RB promote respiratory syncytial virus-induced pulmonary disease[J]. J Leukoc Biol, 2014, 95 (5): 809-815.
6 Bredo G, Storie J, Shrestha Palikhe N, et al. Interleukin-25 initiates Th2 differentiation of human CD4(+) T cells and influences expression of its own receptor[J]. Immun Inflamm Dis, 2015, 3 (4): 455-468.
7 Su J, Chen T, Ji XY, et al. IL-25 downregulates Th1/Th17 immune response in an IL-10-dependent manner in inflammatory bowel disease[J]. Inflamm Bowel Dis, 2013, 19 (4): 720-728.
8 中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见(2012年·广州)[J]. 胃肠病学, 2012, 17 (12): 763-781.
9 Best WR, Becktel JM, Singleton JW, et al. Development of a Crohn’s disease activity index. National Cooperative Crohn’s Disease Study[J]. Gastroenterology, 1976, 70 (3): 439-444.
10D’Haens G, Sandborn WJ, Feagan BG, et al. A review of activity indices and efficacy end points for clinical trials of medical therapy in adults with ulcerative colitis[J]. Gastroenterology, 2007, 132 (2): 763-786.
11Geremia A, Biancheri P, Allan P, et al. Innate and adaptive immunity in inflammatory bowel disease[J]. Autoimmun Rev, 2014, 13 (1): 3-10.
12Saadoun D, Terrier B, Cacoub P. Interleukin-25: key regulator of inflammatory and autoimmune diseases[J]. Curr Pharm Des, 2011, 17 (34): 3781-3785.
13Monteleone G, Pallone F, Macdonald TT. Interleukin-25: a two-edged sword in the control of immune-inflammatory responses[J]. Cytokine Growth Factor Rev, 2010, 21 (6): 471-475.
14Valizadeh A, Khosravi A, Zadeh LJ, et al. Role of IL-25 in Immunity[J]. J Clin Diagn Res, 2015, 9 (4): OE01-OE04.
15Corrigan CJ, Wang W, Meng Q, et al. Allergen-induced expression of IL-25 and IL-25 receptor in atopic asthmatic airways and late-phase cutaneous responses[J]. J Allergy Clin Immunol, 2011, 128 (1): 116-124.
16Yamaguchi Y, Fujio K, Shoda H, et al. IL-17B and IL-17C are associated with TNF-alpha production and contribute to the exacerbation of inflammatory arthritis[J]. J Immunol, 2007, 179 (10): 7128-7136.
17Ji X, Bie Q, Liu Y, et al. Increased frequencies of nuocytes in peripheral blood from patients with Graves’ hyperthyroidism[J]. Int J Clin Exp Pathol, 2014, 7 (11): 7554-7562.
18Caruso R, Sarra M, Stolfi C, et al. Interleukin-25 inhibits interleukin-12 production and Th1 cell-driven inflammation in the gut[J]. Gastroenterology, 2009, 136 (7): 2270-2279.

