DHPS在胃癌转移中的作用及其机制研究*
苏文雨 王吉林 熊 华 房静远
上海交通大学医学院附属仁济医院消化内科 上海市消化疾病研究所(200001)
胃癌在全世界常见癌症发病中排名第四,其死亡率在全世界癌症死因中排名第三[1]。胃癌也是我国最常见的恶性肿瘤之一。胃癌的组织病理学类型和患者的临床特征均与其治疗效果密切相关,发生转移的患者预后较差。多胺是广泛存在于真核细胞中的一类低分子脂肪族阳离子化合物,是细胞生长的必需组分[2]。多胺和多胺合成酶含量在肿瘤细胞中异常升高,多胺代谢功能紊乱与癌症发生密切相关[3]。脱氧羧腐胺赖氨酸合酶(deoxy-hypusine synthase, DHPS)是多胺代谢的限速酶之一,并可催化真核生物翻译起始因子5A(eukaryotic initiation factor 5A, eIF-5A)前体的特定赖氨酸残基发生翻译后修饰[4]。目前研究认为,eIF-5A作为DHPS的底物,在调节细胞增殖、分化、凋亡等方面起有重要作用[5-6]。本课题组前期研究[7]发现,DHPS在胃癌中表达上调,并可影响胃癌细胞增殖,促进胃癌发生。本研究通过分析DHPS在胃癌中的表达及其与胃癌临床病理特征的相关性,并在体外实验中观察抑制DHPS表达和活性对胃癌细胞侵袭力和转移相关蛋白表达的影响,探讨DHPS在胃癌转移中的作用及其可能机制,旨在为胃癌的诊断、治疗和预后评估提供新的靶点。
材料与方法
一、组织芯片、细胞株和主要试剂
组织芯片购自上海芯超生物科技有限公司,芯片含92例胃癌组织及其相应癌旁组织,标本来源中男性42例,女性50例,年龄42~76岁,平均62.4岁,诊断均经手术标本病理结果证实,临床病理资料完整。
人胃癌细胞株MGC803购自中国科学院上海生命科学研究院细胞资源中心,由上海市消化疾病研究所保存。DHPS抗体(Abcam plc.);RPMI1640培养基、胎牛血清(Thermo Fisher Scientific);HiPerFect转染试剂(QIAGEN);DHPS抑制剂GC7(Sigma-Aldrich Co.);Matrigel基质胶、Transwell小室(BD Biosciences);血管内皮生长因子(VEGF)、基质金属蛋 白酶2(MMP2)、MMP9 ELISA试剂盒(R&D Systems)。DHPS-siRNA由上海吉玛制药技术有限公司设计、合成,正义链序列:5’- GGA UCA AUA GGA UCG GAA ATT -3’,反义链序列:5’- UUU CCG AUC CUA UUG AUC CCG -3’。
二、方法
1. 组织芯片免疫组化染色:组织芯片以3% H2O2处理15 min以消除内源性过氧化物酶活性,以柠檬酸盐缓冲液微波加热修复抗原15 min后自然冷 却至室温;滴加非免疫性羊血清,室温封闭30 min;滴加DHPS抗体(工作浓度为1∶100),4 ℃湿盒过夜后复温30 min,PBS漂洗3次;滴加辣根过氧化物酶(HRP)标记二抗,DAB显色,苏木精复染,自然晾干后中性树胶封片。
结果判断:光学显微镜下观察细胞核呈棕褐色者为DHPS阳性细胞。随机选取5个400倍视野,计数DHPS阳性细胞,计算每视野阳性细胞均值。根据阳性细胞均值将DHPS表达强度分为0~3级:0级,0个;1级,1~5个;2级,6~15个;3级,>15个。1级为低表达,2~3级为高表达。
2. 细胞培养和干预:将MGC803细胞培养于含5%胎牛血清的RPMI1640完全培养基中,培养至对数生长期后,以2.0×105/孔的密度接种于6孔板,待细胞贴壁后进行干预。以无血清培养基清洗细胞 后,先后加入无血清培养基(2 mL/孔)以及DHPS-siRNA(5 μL/孔)或GC7(20 μL/孔),DHPS-siRNA具体转染步骤参照HiPerFect转染试剂说明书。37 ℃培养6 h后更换为含血清RPMI1640完全培养基,继续培养24~72 h。
3. 细胞侵袭实验:取40~50 μL已稀释的基质胶加至Transwell小室膜上,37 ℃孵育4~5 h。将对数生长期MGC803细胞接种于25 cm2培养瓶(1×104/mL, 5 mL),培养24 h后,细胞密度达70%,予DHPS-siRNA(终浓度5 nmol/L)或GC7(终浓度10 μmol/L)干预24 h,消化、重悬细胞至2.5×104/100 μL,加入Transwell小室上室;37 ℃、5% CO2、95%湿度培养箱内培养24 h后,以棉签擦拭干净上室细胞和基质胶,以PBS清洗侵袭至下室的细胞,4%多聚甲醛固定15 min,0.1%结晶紫常温染色30 min,PBS洗涤;将小室晾干后置于载玻片上,倒置显微镜下拍照,观察并计数穿膜细胞,每小室膜计数10个视野,计算均值。
4. ELISA法检测转移相关蛋白表达:将对数生长期MGC803细胞接种于25 cm2培养瓶(1×104/mL, 5 mL),培养 24 h后,细胞密度达70%,予DHPS-siRNA(终浓度5 nmol/L)或GC7(终浓度10 μmol/L)干预48 h,收集细胞培养基。各组培养基加入反应板(100 μL/孔),37 ℃孵育2 h;洗涤 4~6次,印干;反应板中加入一抗工作液(50 μL/孔),37 ℃孵育1 h;洗涤4~6次,印干;加入二抗工作液(100 μL/孔),37 ℃孵育 30 min;洗涤4~6次,印干;加入底物工作液(100 μL/孔),37 ℃避光孵育15 min;加入终止液(1滴/孔),使用酶标仪读取450 nm 波长处吸光度值(A值),以空白孔A值进行校正。根据标准品浓度和A值绘制标准曲线,查得样品VEGF、MMP2、MMP9浓度。每组设3个复孔,实验重复3次。
三、统计学分析
结 果
一、胃癌中DHPS的表达及其与肿瘤临床病理特征的关系
在92例胃癌组织中,62例(67.4%)DHPS呈高表达,DHPS表达强度与肿瘤直径、TNM分期、浸润深度密切相关(P<0.05),与患者性别、年龄、淋巴结转移和远处转移则无明显相关性(P>0.05)(表1)。
二、DHPS对胃癌细胞侵袭力的影响
分别以DHPS-siRNA和DHPS抑制剂GC7干预MGC803细胞,以细胞侵袭实验检测其侵袭力变化,结果发现与对照组相比,DHPS-siRNA和GC7均可显著下调MGC803细胞侵袭力(P<0.05)(图1、图2)。
三、DHPS对胃癌细胞转移相关蛋白的影响
分别以DHPS-siRNA和DHPS抑制剂GC7干预MGC803细胞,以ELISA法检测其转移相关蛋白表达变化,结果发现与对照组相比,DHPS-siRNA可显著 下调VEGF、MMP2和MMP9蛋白表达(P<0.05),而GC7对这些蛋白表达的影响不明显(P>0.05)(图3、图4)。
表1胃癌组织中DHPS表达与肿瘤临床病理特征的关系
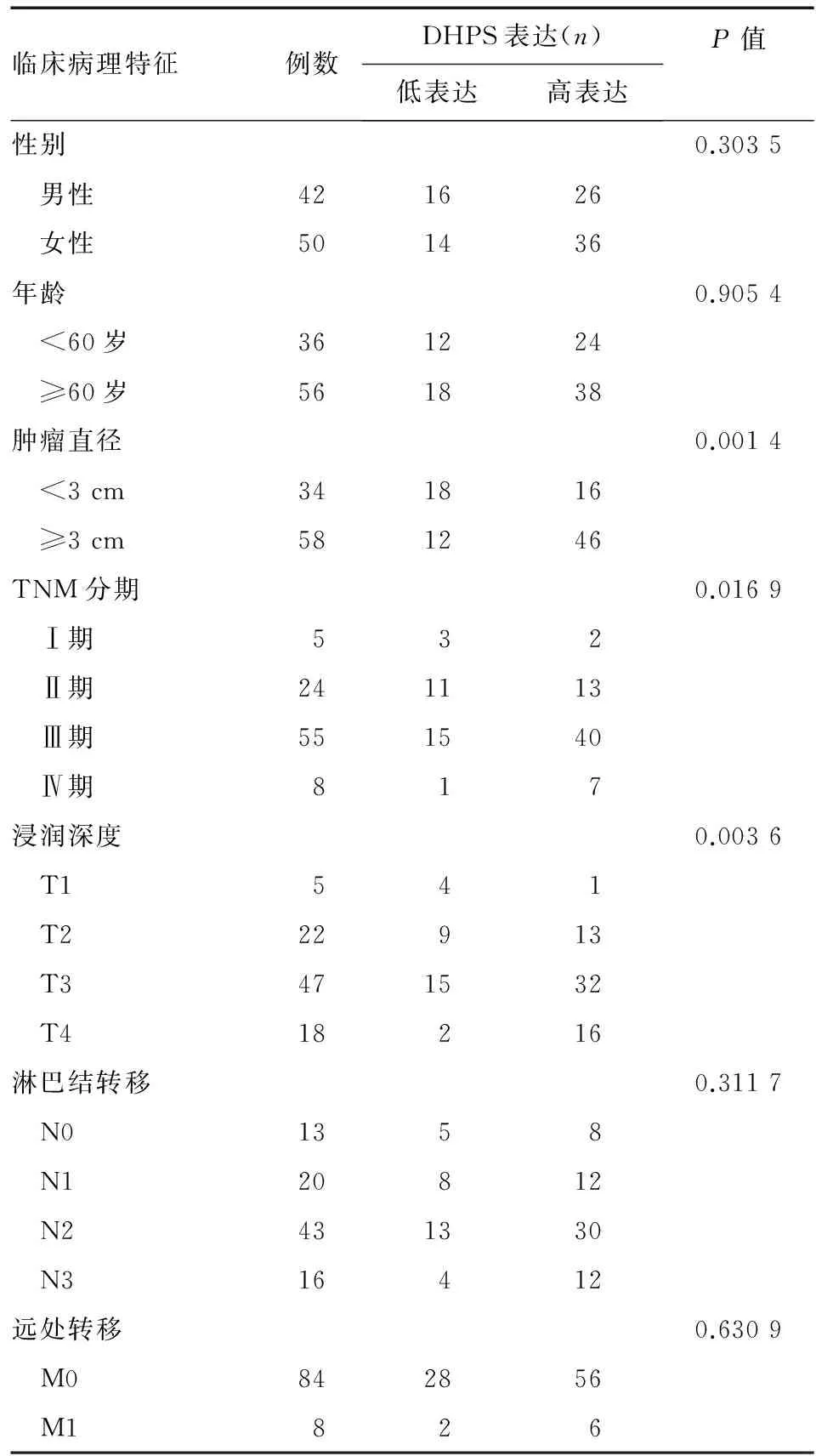
临床病理特征例数DHPS表达(n)低表达高表达P值性别0.3035 男性421626 女性501436年龄0.9054 <60岁361224 ≥60岁561838肿瘤直径0.0014 <3cm341816 ≥3cm581246TNM分期0.0169 Ⅰ期532 Ⅱ期241113 Ⅲ期551540 Ⅳ期817浸润深度0.0036 T1541 T222913 T3471532 T418216淋巴结转移0.3117 N01358 N120812 N2431330 N316412远处转移0.6309 M0842856 M1826
讨 论
DHPS是催化eIF-5A前体特定赖氨酸残基翻译后修饰的关键因子。eIF-5A与多种肿瘤细胞增殖、侵袭、凋亡的调控密切相关[8],因此DHPS可能通过调节eIF-5A活性,参与调控肿瘤发生和转移[9-10],如神经母细胞瘤发生[11]、肝细胞癌转移[12]等。本课题组前期研究[7]发现胃癌组织中DHPS mRNA和蛋白表达均明显上调。本研究进一步分析发现胃癌组织中DHPS的异常高表达与肿瘤直径、TNM分期、浸润深度显著相关,表明DHPS可能参与了胃癌的发生、发展。
转移是恶性肿瘤的主要特征,恶性肿瘤发生转移是治疗失败的主要原因。DHPS是调控肿瘤转移的重要基因之一[13]。为进一步探讨DHPS在胃癌转移中的调控机制,本研究利用DHPS-siRNA和DHPS抑制剂GC7分别对人胃癌细胞株MGC803进行干预,结果显示通过下调DHPS表达或抑制其活性均可有效减弱胃癌细胞的侵袭力。VEGF是刺激肿瘤血管生长的重要因子,MMP2和MMP9是降解细胞外基质的关键酶,三者在肿瘤侵袭 和转移过程中均起有重要作用。本研究发现以DHPS-siRNA干预MGC803细胞可致VEGF、MMP2和MMP9蛋白表达显著下调,但这些蛋白在经GC7干预的MGC803细胞中表达下调不明显,提示DHPS对胃癌转移的调控可能存在多种不同机制。
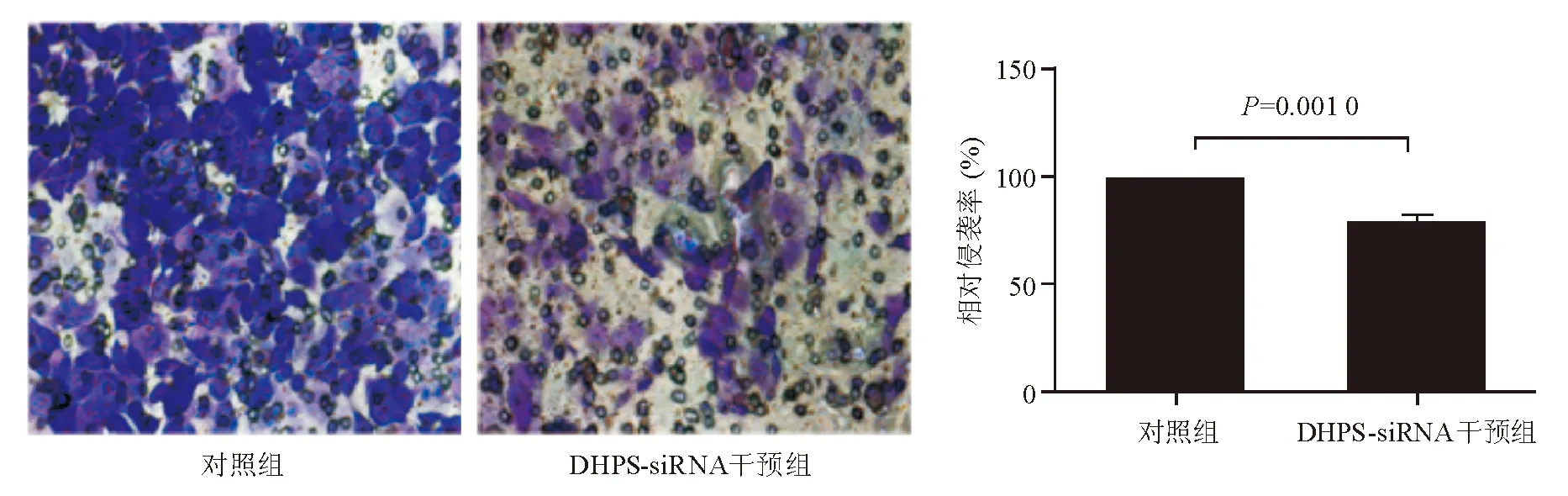
图1 DHPS-siRNA对MGC803细胞侵袭力的影响
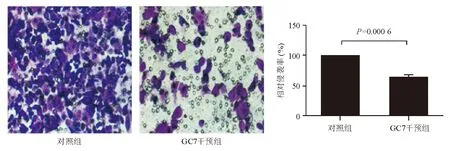
图2 GC7对MGC803细胞侵袭力的影响

图3 DHPS-siRNA对MGC803细胞转移相关蛋白的影响

图4 GC7对MGC803细胞转移相关蛋白的影响
本课题组前期研究[7]发现,以DHPS-siRNA抑制DHPS表达可下调ERK信号通路活性,抑制胃癌细胞增殖,而本研究结果显示DHPS-siRNA可下调胃癌细胞侵袭力。鉴于ERK通路参与调控多种肿瘤细胞的增殖、转移、凋亡等生物学行为,推测DHPS对胃癌转移的调控作用亦可能与ERK通路有关。DHPS活性变化可直接影响eIF-5A活化,而后者在调节肿瘤细胞的增殖、侵袭、分化等方面起有重要作用。Muramatsu等[5]发现DHPS可通过影响eIF-5A活性,参与食管鳞状细胞癌的进展和转移。由此推测DHPS对胃癌转移的调控可能存在两条途径:一方面通过影响ERK通路,另一方面通过调节下游eIF-5A活性发挥调控作用。
综上所述,胃癌组织中DHPS表达升高,并与肿瘤浸润和进展密切相关。DHPS参与调控胃癌细胞的侵袭、转移,一方面可能是通过调节ERK通路活性影响胃癌细胞的生物学行为,另一方面则与其自身酶活性,即影响eIF-5A活性有关。随着对DHPS在胃癌转移中作用研究的进一步深入,该分子有望成为胃癌诊断和治疗的新靶点。
1 Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65 (2): 87-108.
2 Dai Z, Wu Z, Wang J, et al. Analysis of polyamines in biological samples by HPLC involving pre-column derivatization with o-phthalaldehyde and N-acetyl-L-cysteine[J]. Amino Acids, 2014, 46 (6): 1557-1564.
3 马容, 陈咨余, 姜冬梅, 等. 多胺在癌症治疗中的作用及机制[J]. 生物技术通报, 2016, 32 (2): 46-50.
4 Park MH, Nishimura K, Zanelli CF, et al. Functional significance of eIF5A and its hypusine modification in eukaryotes[J]. Amino Acids, 2010, 38 (2): 491-500.
5 Muramatsu T, Kozaki KI, Imoto S, et al. The hypusine cascade promotes cancer progression and metastasis through the regulation of RhoA in squamous cell carcinoma[J]. Oncogene, 2016, 35 (40): 5304-5316.
6 Nakanishi S, Cleveland JL. Targeting the polyamine-hypusine circuit for the prevention and treatment of cancer[J]. Amino Acids, 2016, 48 (10): 2353-2362.
7 Su WY, Li JT, Cui Y, et al. Bidirectional regulation between WDR83 and its natural antisense transcript DHPS in gastric cancer[J]. Cell Res, 2012, 22 (9): 1374-1389.
8 Strnadel J, Choi S, Fujimura K, et al. eIF5A-PEAK1 Signaling Regulates YAP1/TAZ Protein Expression and Pancreatic Cancer Cell Growth[J]. Cancer Res, 2017, 77 (8): 1997-2007.
9 Lee SK, Lee J, Lee SI, et al. N(1)-guanyl-1,7,-diamineoheptane, an inhibitor of deoxyhypusine synthase, suppresses differentiation and induces apoptosis via mitochondrial and AMPK pathways in immortalized and malignant human oral keratinocytes[J]. J Oral Pathol Med, 2009, 38 (10): 792-800.
10Lee Y, Kim HK, Park HE, et al. Effect of N1-guanyl-1,7-diaminoheptane, an inhibitor of deoxyhypusine synthase, on endothelial cell growth, differentiation and apoptosis[J]. Mol Cell Biochem, 2002, 237 (1-2): 69-76.
11Bandino A, Geerts D, Koster J, et al. Deoxyhypusine synthase (DHPS) inhibitor GC7 induces p21/Rb-mediated inhibition of tumor cell growth and DHPS expression correlates with poor prognosis in neuroblastoma patients[J]. Cell Oncol (Dordr), 2014, 37 (6): 387-398.
12Tang DJ, Dong SS, Ma NF, et al. Overexpression of eukaryotic initiation factor 5A2 enhances cell motility and promotes tumor metastasis in hepatocellular carcinoma[J]. Hepatology, 2010, 51 (4): 1255-1263.
13Scuoppo C, Miething C, Lindqvist L, et al. A tumour suppressor network relying on the polyamine-hypusine axis[J]. Nature, 2012, 487 (7406): 244-248.

