氯丙烯直接环氧化工艺反应物料危险性研究*
朱红伟,姜 杰,孙 冰,石 宁
(1.中国石油化工股份有限公司青岛安全工程研究院,山东 青岛 266071;2.化学品安全控制国家重点实验室,山东 青岛 266071)
0 引 言
环氧氯丙烷是1种应用很广的有机化工原料,主要用途是合成环氧树脂,此外还可用于合成甘油、氯醇橡胶、硝化甘油炸药以及医药、农药、涂料、胶料、离子交换树脂等多种产品[1]。目前,环氧氯丙烷的工业化生产方法主要有3种:丙烯高温氯化法、醋酸烯丙酯法和甘油法,其中,前2种方法都有排放废水废渣、工艺复杂的缺点;甘油法三废排放减少,但有设备腐蚀严重,催化剂利用率低等缺点。近年来随着双氧水的开发使用,研究人员开发了使用双氧水直接环氧化氯丙烯制备环氧氯丙烷的新技术[2-6]。
在钛硅分子筛催化体系下,双氧水氧化3-氯丙烯(简称氯丙烯)直接环氧化一步合成环氧氯丙烷,具有环境友好、原子经济利用率高的优点。此环氧氯丙烷洁净生产工艺优势明显,双氧水环氧化反应后转变为水,没有难处理的副产物,环境友好,符合绿色发展理念,但体系涉及双氧水、低沸点有机物料等,危险性较高。
新工艺的出现促进了化工工业的发展,但同时带来了未知的危险,因化学物质认识不足导致的化工事故层出不穷[7],研究人员在此方面也做了大量工作[8-9],针对双氧水的安全研究已有大量成果[10-13],但储存、使用双氧水导致的事故还是时有发生[14-15],尤其是高浓度双氧水危险性较高,此工艺中为保证催化剂的选择性使用氨水调节混合物料的pH值,更是增加了危险因素,安全的使用混合物料是保障工艺安全的基础条件。刘小琴[10]利用C600和VSP2测试了不同浓度的双氧水的分解曲线,并得到不同浓度双氧水的分解特性参数;孙峰等[11]研究了pH值对27.5%双氧水分解的影响,该研究指出pH值对双氧水分解影响较大,当pH值增加到7时,27.5%双氧水会发生热失控;石宁等[12]研究了27.5%双氧水分解特性曲线,定量研究了双氧水分解过程。值得注意的是,以上研究主要关注于双氧水的热特性参数,利用热特性参数评判双氧水的安全使用条件,对于得到的双氧水分解动力学参数没有应用于指导实际安全生产。针对此工艺使用的物料,本文利用pH计和C80量热仪对混合物料热危险性进行研究,获得了混合物料的物理性质和热特性参数,并利用模拟软件HYSIS结合双氧水的分解进行预防气相燃爆方面的安全计算,为安全控制提供参考。
1 实验
1.1 试剂
氯丙烯,分析纯,国药集团化学试剂有限公司制。25%氨水,分析纯,国药集团化学试剂有限公司制。丙酮,分析纯,国药集团化学试剂有限公司制。H2O2,工业级,质量分数50%,无锡市双林化工有限公司制。
1.2 仪器
混合物料的pH值测定使用梅特勒Seven Easy S20K pH计。
物料热稳定性测试使用C80微量量热仪,该仪器是法国SETARAM公司开发的热分析仪,其测试原理是在程序温度控制下,测量处于同一温度区域的样品和参比物之间单位时间的能量差或功率差随温度的变化。该仪器测量温度范围为室温至300℃,恒温控制精度为±0.001℃,升温速度为0.01~2.00℃/min,分辨率为0.1 μW,感度极限为1 μW。
1.3 分析测试方法
按配比将4种物料混合,利用pH计按照时间间隔测试混合物料pH值。
热稳定性测试则是将约0.5 g混合物料装入高压池,参比端高压池加入同等质量的活性氧化铝。分别将高压池和参比池装入C80量热仪中。设定升温程序,设定升温速率分别为1.0,0.8,0.6 K/min。通过测试获得样品在特定扫描速率下的放热曲线,通过分析放热曲线获得样品的热特性参数和其他安全参数。
2 实验结果与讨论
2.1 混合物料pH值变化
双氧水的稳定性对pH值较为敏感,高pH值会引起双氧水的分解释放出氧气,孙峰等[10]研究了pH值对双氧水绝热分解的影响,认为27.5%双氧水在pH值高于7时处于不稳定状态,十分危险。此工艺使用50%双氧水,在混合物料中双氧水浓度约为7%,为保证催化剂选择性要求混合物料pH值调节在8左右,因此,需要添加氨水调节pH值。按照物料配比,利用pH计对混合物料进行了连续测试,如图1所示。

图1 混合溶液pH值随放置时间变化Fig.1 pH of mixed materials changed with extension of time
由图1可知,物料混合瞬间溶液pH为8左右,随着时间推移,pH值下降,最终稳定在2.3左右。混合物料pH值变化原因是氨水与双氧水中的酸性稳定剂缓慢反应,导致pH值持续下降。双氧水在碱性条件下极易分解,混合物料在碱性条件下维持时间2 h左右,能满足反应要求,同时也防止了未反应物料的分解。建议严格控制pH值,防止氨水进料量增加造成pH值瞬间升高导致双氧水分解爆炸。实际工况中会出现紧急情况下混合物料临时排放问题,因此,对即配混合物料和放置16 h后的混合物料分别进行了热稳定性测试。
2.2 物料的热稳定性
2.2.1即配混合物料热稳定性
混合物料的热扫描曲线如图2所示。对混合物料不同升温速率下得到的热扫描曲线利用Friedman等转化率法进行分析计算,得到了起始放热温度、最大放热温度、放热量等热特征参数,见表1。

图2 混合物料多速率C80扫描曲线Fig.2 C80 scanning curves of mixed materials under different heating rates
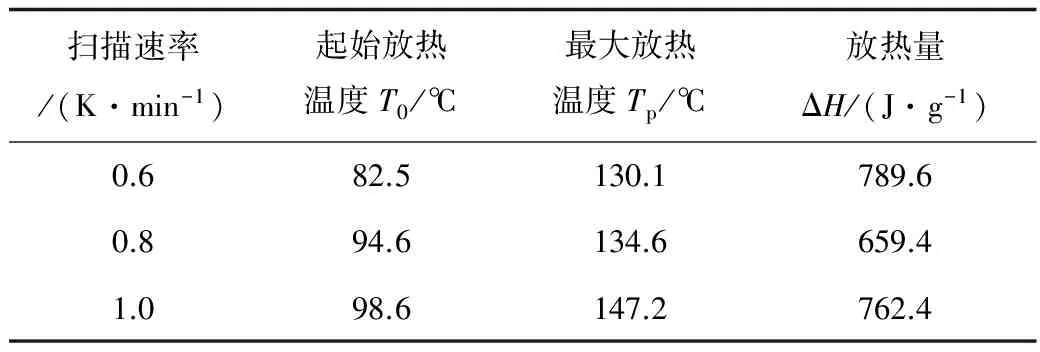
表1 实验设定与结果
由表1可以看出,混合物物料的放热峰在80~150℃之间,放热量约为737 J·g-1。混合物料中双氧水浓度约为7%,与刘小琴[10]不同浓度双氧水热特征参数比较发现,混合物料放热量高于27.5%双氧水,说明失控后果较27.5%双氧水更严重。
绝热条件下到达最大反应速率所需时间(TMRad)为判据物质热失控危险性非常重要的参数,其危险性判据规则见表2[16]。

表2 失控反应可能性评估标准
利用高级动力学及技术解决方法(AKTS,advanced kinetics and technology solutions)软件对热扫描曲线进行动力学参数计算,进而求得混合物料在绝热条件下到达最大反应速率所需时间(TMRad)随初始温度的变化情况,见表3和图3。TMRad为24 h时对应的温度可表示为TD24,由图3可知,TD24=21.3℃。与刘小琴[10]测试的27.5%双氧水的TMRad比较,发现其小于刘小琴相同温度下的TMRad,说明其失控可能性高于27.5%的双氧水。

图3 混合物料TD24Fig.3 TD24 of mixed materials

表3 混合物料初始温度与TMRad的关系
2.2.2放置16 h混合物料热稳定性
混合物料放置16 h后,利用C80进行热扫描,其热扫描曲线如图4所示。

图4 混合物料放置16 h 后的多速率C80热扫描曲线Fig.4 C80 scanning curves of placed after 16 hours mixed materials under different heating rates
对放置16 h后的混合物料在不同升温速率下得到的热扫描曲线利用Friedman等转化率法进行处理计算,得到了起始放热温度、最大放热温度、放热量等热特征参数,见表4。

表4 实验设定与结果
利用AKTS软件对热扫描曲线进行动力学参数计算,进而求得混合物料在绝热条件下到达最大反应速率所需时间(TMRad)随初始温度的变化情况,见表5,可知TD24=22.4℃。

表5 放置16 h后混合物料初始温度与TMRad的关系
2.3 物料安全使用分析
放置16 h后的混合物料所得数据与即配即测所得数据进行比较,可以看出,混合物料放置一段时间后,起始放热温度、最大放热温度、TD24升高,相对危险性降低,但升高温度值很小,危险性下降幅度有限。原因之一是使用C80进行测试时需要进行热流稳定,一般为2 h。溶液的pH值在此期间一直下降,开始升温阶段溶液pH值也是一直下降,导致物料混完后立即测试与放置16 h后测试所得结果相差不大;原因之二是双氧水浓度在混合物中浓度低,对pH值敏感度低。
物料混合瞬间pH为8左右,碱性条件下双氧水极易分解。建议严格控制pH值,防止氨水进料错误造成pH值瞬间升高导致双氧水分解爆炸。为保证物料的安全使用防止进料错误,建议进料系统设置比例联锁。即配即测混合物料的TD24=21.3℃,按照表2危险性判据规则,混合物料的储存温度应低于21.3℃,因此,建议物料不得提前混合,即用即混。
紧急停车工况下,物料会滞留反应器。反应器运行温度35~60℃高于TD24,尤其在反应器内部,催化剂会加快双氧水分解,更增加了物料危险性。因此,紧急停车时物料应紧急排出装置。反应器运行温度35~60℃,排出的混合物料温度为35℃时,TMRad为12.1 h;温度为60℃时,TMRad为4.0 h。根据表2危险性判据,混合物料发生失控的可能性为高。
特殊工况下反应器内有物料滞留时,双氧水分解氧气会造成气相空间氧气含量升高。根据混合物料热扫描曲线,得到混合物料中双氧水分解动力学数据,计算得到的双氧水等温分解曲线如图5所示。
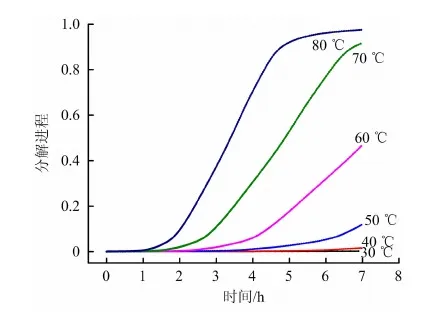
图5 双氧水等温分解曲线Fig.5 Hydroxide isothermal decomposition curve
由图5可以看出,温度对双氧水分解的影响较大。高温下双氧水分解较快,低温下分解较慢。利用HYSIS软件计算可以得到不同温度、压力以及双氧水分解率下体系的气相组成,如表6所示。
由表6可以看出,相同压力、转化率下,温度对气相组成影响很大,这主要是因为温度对氯丙烯、丙酮等易挥发物质的饱和蒸气压影响较大。工艺氧含量要求控制在3%以下,结合图5中不同温度下双氧水的分解速率曲线可以得到不到温度下混合物料的安全储存时间。在60℃下,双氧水分解0.06%氧气含量即达到3%,所需时间为0.8 h;在30℃下,双氧水分解0.01%氧气含量即达到3%,所需时间1.3 h。因此,混合物料的滞留或存放是很危险的,物料气相很容易进入爆炸极限。需要注意的是,催化剂对双氧水分解有促进作用,残余双氧水会分解产生氧气引起气相燃爆,故此,严禁双氧水停留在反应器中。停车期间,建议清空管线与反应器,不得使用混合物料浸泡反应器。在停车再开车时,需先用氮气吹扫管线,防止催化剂吸附的H2O2分解生成氧气引起爆炸。

表6 不同条件下气相组成
3 结论
1)物料混合瞬间溶液pH值为8左右,混合物料的TD24=21.3℃,反应温度高于TD24,失控风险较高,建议物料不得提前混合,即用即混,进料系统设置比例联锁。非计划停车时,建议立即将混合物料从反应器中排出到敞开空间或进行氮气吹扫的密闭容器内,保证未反应的混合物料在装置中流动时间低于0.8 h,并用丙酮冲洗管线,排出的混合物料储存温度低于21℃。
2)混合物料中双氧水会持续分解,在密闭体系中氧含量易超标,使气相空间进入爆炸极限,故此,建议停车期间,清空管线与反应器不得使用混合物料浸泡反应器。在停车后再次开车时,需先用氮气吹扫管线,防止催化剂吸附的H2O2分解生成氧气引起爆炸。
3)利用HYSIS结合量热仪器得到的双氧水分解速率,进行了预防气相空间燃爆计算,得到不同条件下为保证安全未反应的混合物料在装置其他设备及管线中的流动时间。对于含双氧水体系以及含其他缓慢分解物质体系的安全操作时间计算具有指导意义。
[1]李玉芳,伍小明.国内外环氧氯丙烷生产消费现状及市场前景[J].中国氯碱,2005(1):1-6.
LI Yufang,WU Xiaoming.Consumption status of epichlorohydrin at home and abroad and its market prospect[J].China Chlor-Alkali,2005(1):1-6.
[2]徐大伟,郜广玲,李玮,等.环氧氯丙烷的洁净生产[J].石油化工,2000,29(10):794-797.
XU Dawei,GAO Guanglin,LI Wei,et al. Clean production of epichlorohydrin[J].Petrochemical Technology,2000,29(10):794-797.
[3]张宇,熊勇,刘易,等.TS-1催化氯丙烯直接环氧化反应的失活研究[J].石油炼制与化工,2006,37(7):21-24.
ZHANG Yu,XIONG Yong,LIU Yi,et al. Study on the deactivation of TS-1 molecular sieve in catalyzing ally chloride direct epoxidation[J].Petroleum Processing and Petrochemicals,2006,37(7):21-24.
[4]中国石油化工股份有限公司. 一种生产环氧氯丙烷的方法:CN103772326B[P]. 2015-10-28.
[5]赵世霞.环氧法制备环氧氯丙烷的工艺参数优化研究[J].山东理工大学学报(自然科学版),2014,28(5):65-68.
ZHAO Shixia.Paramater optimization study on fabricating epichlorohydrin by peroxide hydrogen oxidation[J].Journal of Shandong University of Technology(Natural Science Edition),2014,28(5): 65-68.
[6]李钢,王祥生,郭新闻.丙烯环氧化反应溶剂效应和酸碱效应研究[J].石油学报(石油加工),2001,17(3):62-67.
LI Gang,WANG Xiangsheng,GUO Xinwen.Effects of the solvent,acid and base on the propylene epoxidation[J].ACTA PETROLEI SINICA(Petroleum processing section),2001,17(3):62-67.
[7]佟淑娇,吴宗之,王如君,等.2001—2013年危险化学品企业较大以上事故统计分析及对策建议[J].中国安全生产科学技术,2015,11(3):129-134.
TONG Shujiao,WU Zongzhi,WANG Rujun,et al. Statistical analysis and countermeasures on larger and above grades accidents of dangerous chemical enterprises from 2001 to 2013[J].Journal of Safety Science and Technology,2015,11(3):129-134.
[8]张凤.简单放热化学反应体系热安全性研究判据[J].中国安全生产科学技术,2011,78(8):79-82.
ZHANG Feng.Research criteria of thermal safety of simple exothermic chemical reaction system[J].Journal of Safety Science and Technology,2011,7(8): 79-82.
[9]钱新明,刘丽,张杰.绝热加速量热仪在化工生产热危险性评价中的应用[J].中国安全生产科学技术,2005,1(4):13-18.
QIAN Xinming,LIU Li,ZHANG Jie. Accelerating rate calorimeter and its application in the thermal hazard evaluation of chemical production [J].Journal of Safety Science and technology,2005,1(4):13-18.
[10]刘小琴.双氧水分解反应热危险性分析[D].青岛:青岛科技大学,2015.
[11]孙峰,谢传欣,张帆,等.pH值对双氧水绝热分解特性的影响[J].化学工程,2012,40(2):42-45.
SUN Feng,XIE Chuanxin,ZHANG Fan,et al. Effect of pH value on adiabatic decomposition characteristics of hydrogen peroxide[J].Chemical Engineering,2012,40(2): 42-45.
[12]石宁,谢传欣,于丽明,等.双氧水分解危险特性的定量研究[J].大氮肥,2010,33(1):53-55.
SHI Ning,XIE Chuanxin,YU Liming,et al.Quantitative Research of Hazardous Property in Hydrogen Peroxide Decomposition[J].Large Scale Nitrogenous Feetilizer Industry,2010,33(1):53-55.
[13]朱希增,朱顺兵,刘新华.有机磷酸稳定剂对双氧水绝热分解特性的影响[J].化工进展,2014,33(12):3197-3202.
ZHU Xizeng,ZHU Shunbing,LIU Xinhua.Effect of polyphosphonic acid on adiabatic decomposition characteristics of hydrogen peroxide[J].Chemical Industry and Engineering Progress,2014,33(12):3197-3202.
[14]梁志宏,耿惠民.过氧化氢爆炸事故浅析[J].消防科学与技术,2004,23(6):602-604.
LIANG Zhihong,GENG Huimin.Hydrogen peroxide explosion analysis[J].Fire Science and Technology,2004,23(6):602-604.
[15]杨衍超,廖菊英.一起双氧水储罐爆炸事故的原因调查[J].工业安全与环保,2009,35(2):29-30.
YANG Yanchao,LIAO Juying.The investigation on the reason of explosion of a tank of hydrogen peroxide[J].Industrial Safety and Environmental Protection,2009,35(2):29-30.
[16]陈利平,陈网桦,彭金华,等.间歇与半间歇反应热失控危险性评估方法[J].化工学报,2008,59(12):2963-2970.
CHEN Liping,CHEN Wanghua,PENG Jinhua,et al.Thermal runaway assessment methods of chemical reactions in batch and semi-batch reactors[J].Journal of Chemical Industry and Engineering(China),2008,59(12):2963-2970.

