肌肉生长抑制素在慢性阻塞性肺疾病合并肺动脉高压患者血浆中的表达及意义*
王同生,苏秀丽,孙瑜霞,毛毅敏,曲红培
[河南科技大学第一附属医院(河南科技大学临床医学院),河南 洛阳 471003]
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)合并肺动脉高压(pulmonary hypertension,PH)患者的早期诊断和分期很关键[1]。脑钠肽(brain natriuretic peptide,BNP)是PH和右心室功能不全的敏感指标之一[2]。肌生长抑制蛋白(Myostatin)这种特殊的肌肉生长调节因子在容量负荷所致的心力衰竭模型中表达增高[3],在慢性肺源性心脏病患者表达水平也升高[4]。本研究评估COPD合并PH患者是否血浆中Myostatin增加,及其与COPD合并PH的关系。
1 资料与方法
1.1 一般资料
收录2013年1月-2016年6月河南科技大学第一附属医院呼吸科门诊的稳定期COPD患者,入选标准:①符合COPD稳定期的标准,咳嗽、咳痰、气短等症状稳定或症状轻微[5],持续8周以上;②年龄>50岁。③不吸烟或戒烟3年以上。在研究期间,患者的治疗主要包括吸入长效支气管扩张剂和/或抗胆碱能药物。此外,85%的患者在吸入糖皮质激素(相当于布地奈德剂400~800 mg/d)。排除标准:①左心室射血分数(LVEF)<50%,未发现三尖瓣反流。②排除其他可能引起肺动脉压力升高的疾病:限制性通气功能障碍者;近2个月内COPD急性加重者;近2年内有静脉血栓栓塞者;未经治疗的阻塞性睡眠呼吸暂停;囊性纤维化者;充血性心力衰竭Ⅲ或Ⅳ级;先天性心脏病者;肝硬化和风湿性疾病者。③全身应用糖皮质激素患者。④恶性肿瘤;代谢性疾病;营养不良;骨骼肌疾病;系统性炎症反应疾病;肾功能不全。肺动脉压力(systolic pulmonary artery pressure,SPAP)≥40 mmHg为PH[1]。按是否合并PH分为两组:COPD合并PH组59例,其中,男性47例,女性12例,年龄62~ 75岁,平均(67.8±5.5)岁;COPD无PH组166例,其中,男性133例,女性33例,年龄61~76岁,平均(65.7±5.1)岁。两组在年龄、性别、吸烟史、体重指数、COPD严重程度分级及吸入药物治疗方面相比,差异无统计学意义(P>0.05)。本研究经该院伦理委员会审批通过(批准号:20120307),所有研究对象均签署知情同意书。
1.2 方法
记录COPD患者的性别、年龄、吸烟史、身高、体重等一般临床资料,并进行体检、经胸超声心动图检查、肺功能测定、6 min步行距离、检测Myostatin、BNP水平及动脉血气。
1.2.1肺功能测定采用德国耶格肺功能仪,测用力肺活量(FVC)、第1秒用力呼气容积(FEV1)、残气量(RV)、肺总量(TLC)、肺一氧化碳弥散量(DLCO)。肺容积通过体积描记法测量,DLCO通过一口气法测量并经血红蛋白校正。然后吸入沙丁胺醇气雾剂二喷(200μg),15 min 后重测 FEV1。
1.2.26 min步行距离试验(6 MWD)参照文献[1]试验在长30 m的直走廊里进行,患者尽最大可能行走,在6 min内能完成的最远距离。测量并记录步行的最大距离。
1.2.3心脏彩超由于经胸超声心动图不能直接测量平均肺动脉压(PAMP),故采用多普勒超声测定三尖瓣返流速度(TRV),再经柏努力方程式计算肺动脉收缩压(SPAP),即SPAP=4×最大返流速度(TRVmax)2+右房压(RAP),按照2009年9月欧洲呼吸学会和欧洲心脏病学会颁布的PH诊治指南,当SPAP≥40 mmHg(1 mmHg=0.133 kPa)时,即可认为存在PH[1]。采用Philips iE33彩色多普勒超声诊断仪,探头2.5MHz,患者取左侧卧位或平卧位,同步记录Ⅱ导联心电图。超声心动图测量方法参照2010版ASE成人右心指南[6]。参数包括:三尖瓣环收缩期位移(TAPSE)、右室心肌做功指数(RVMPI)、右室面积变化分数(FAC)。同时测量左室射血分数(LVEF)、右心室横径(RVD)、右心房横径(RAD)、右心室室壁厚度(RVWT)、SPAP。
1.2.4Myostatin和BNP测定每位患者空腹12 h早晨抽肘静脉血6 ml,注入加有10%乙二胺乙酸二钠30μl及抑肽酶40μl抗凝剂的试管中,混均,4℃,3 000 r/min离心15 min,分离血浆-80℃保存待测定。Myostatin用ELISA法测定(人ELISA试剂盒,广东兆康生物科技有限公司),Myostatin抗体、兔抗人多克隆抗体(上海信裕生物科技有限公司),严格按照操作说明书进行,单位ng/ml。BNP也采用ELISA法测定,均严格按照操作说明书进行,单位pg/ml。
1.3 统计学方法
采用SPSS 17.0统计学软件对数据进行分析处理,符合正态分布的计量资料以均数±标准差(±s)表示,采用t检验;计数资料构成比比较采用χ2检验;非正态分布资料用中位数(四分位间距)表示,两组间比较采用Mann-Whitneyu检验。非正态分布资料应用log转换成正态分布资料,对数据进行Pearson相关分析和多元线性逐步回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 临床特征
225例COPD患者,其中,男性180例,女性45例,150例患者属于重度(30%≤FEV1<50%),75例患者极重度(FEV1<30%)。COPD合并PH组59例,COPD无PH组166例,两组年龄、性别、体重指数、吸烟史,TLC、FRC、RV、DLCO占预计值百分比,动脉二氧化碳分压及吸入药物情况差异无统计学意义(P>0.05);和无PH患者相比,PH患者吸药前后FEV1占预计百分比、FEV1/FVC、动脉氧分压更低,COPD严重程度分级相比,PH患者更重,差异有统计学意义。两组MWD和SPAP比较,差异有统计学意义(P<0.05)。见表1。
2.2 心脏彩超参数
两组比较:心率、LVEF差异无统计学意义;COPD合并PH患者TAPSE、FAC低于COPD无PH患者,差异有统计学意义。COPD合并PH患者RVMPI、RVWT、RVD、RAD高于COPD无PH患者,差异有统计学意义(P<0.05)。见表2。
2.3 Myostatin和BNP水平
COPD合并PH组Myostatin和BNP水平高于COPD无PH组,Myostatin水平分别是16.4(四分位间距,2.2~25.7 ng/L)与12.8 ng/L(四分位间距,3.2~20.3 ng/L),差异有统计学意义(Z=-2.741,P=0.011);BNP水 平 分 别 是(147.87±42.98) 和(114.61±53.47)pg/ml,差异有统计学意义(Z=-2.023,P=0.042)。

表1 COPD合并PH与未合并PH患者各种临床特征比较
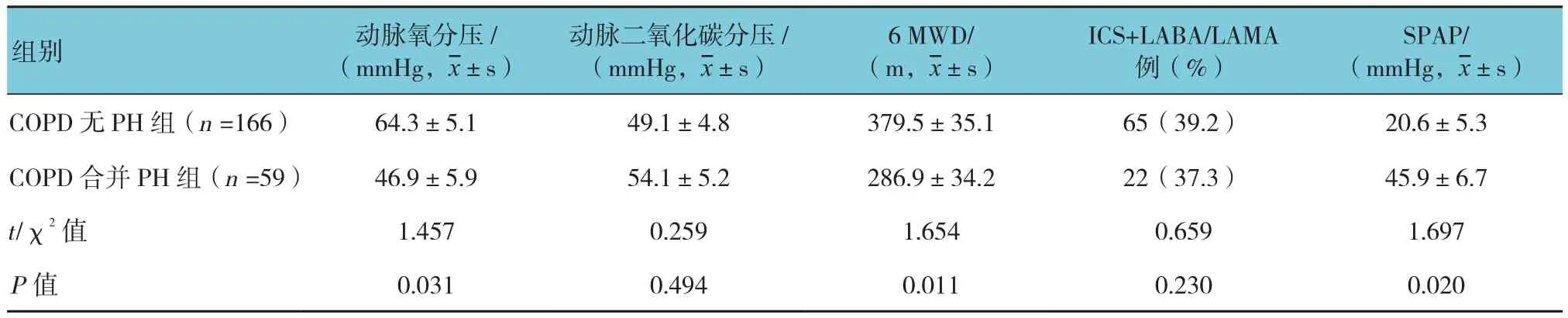
续表1
表2 在COPD合并PH与未合并PH患者心脏彩超参数比较 (±s)
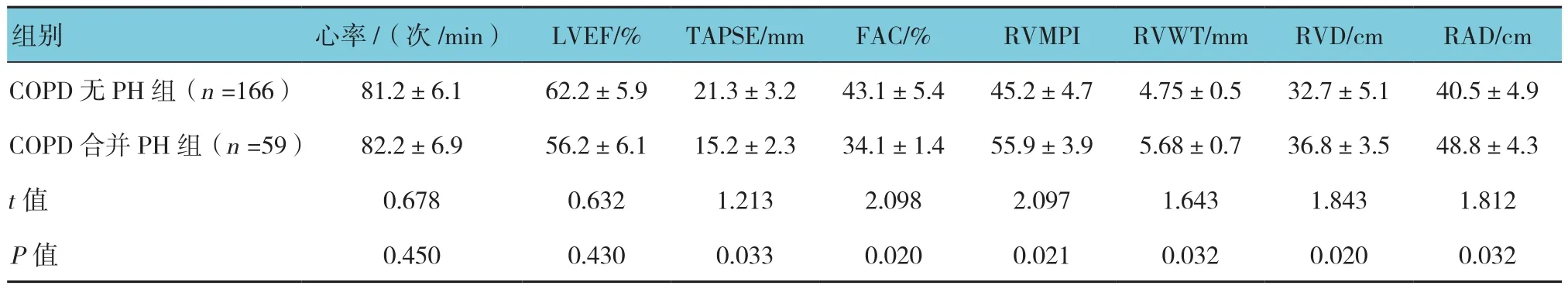
表2 在COPD合并PH与未合并PH患者心脏彩超参数比较 (±s)
COPD 无 PH 组(n =166) 81.2±6.1 62.2±5.9 21.3±3.2 43.1±5.4 45.2±4.7 4.75±0.5 32.7±5.1 40.5±4.9 COPD合并PH组(n =59) 82.2±6.9 56.2±6.1 15.2±2.3 34.1±1.4 55.9±3.9 5.68±0.7 36.8±3.5 48.8±4.3 t值 0.678 0.632 1.213 2.098 2.097 1.643 1.843 1.812
2.4 Pearson相关分析结果
Myostatin水平应用log转换成正态分布资料,Myostatin水平与TAPSE、FAC呈负相关(r=-0.315和 -0.241,P=0.002和 0.003);与 RVWT、RVMPI、RVD呈正相关(r=0.351、0.209和0.195,P=0.001、0.003和0.005);BNP水平与SPAP呈正相关(r=0.201,P=0.009);Myostatin水平和BNP水平呈正相关(r=0.295,P=0.002)。见表 3。
2.5 多元线性逐步回归分析结果
通过对Myostatin和BNP表达水平有影响的相关性因素行多元线性逐步回归分析,筛除混杂变量的影响,结果显示,TAPSE 、RVMPI和SPAP对Myostatin表达水平的影响差异有统计学意义(P<0.05)。见表4。
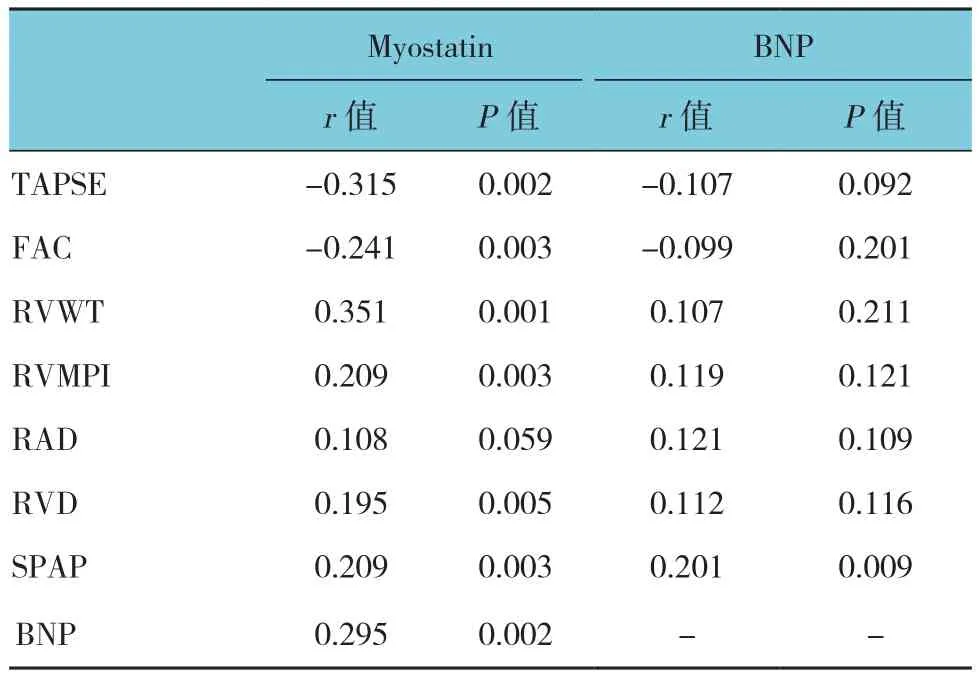
表3 Myostatin和BNP水平与COPD患者有关参数的相关分析
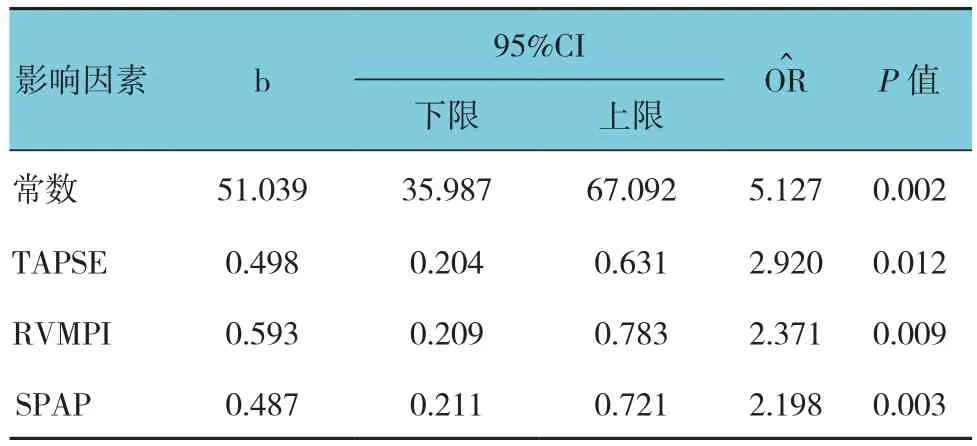
表4 Myostatin表达水平影响因素多元线性逐步回归分析结果
3 讨论
本研究有2个发现:①COPD合并PH组血浆Myostatin水平高于COPD无PH组;②Myostatin水平与右心室(RV)功能障碍和肥厚有关;并与COPD合并PH有关,基于相关系数比较,较BNP指标更敏感。本研究第一次探讨了COPD稳定期患者血浆Myostatin和右心室超声心动图参数的关系,以及与肺动脉高压的关系。
本研究入选的COPD患者多数有非常严重的气流受限,平均FEV1占预计值百分比<50%,合并PH的比例是59(26.2%),说明在COPD危重及极危重期患者合并PH普遍存在。RV功能障碍和由此产生的失代偿是COPD的自然过程[2]。有文献报告说[7],根据超声心动图测量结果,慢性肺源性心脏病患者,即使在COPD无PH患者,RV会出现功能不全、肥厚和扩张。研究同时还强调,在肺血管病的早期,可能出现RV功能不全。
GRUSON等[8]报道,慢性充血性心力衰竭患者与对照组相比,血浆myostatin水平升高。同时,GEORGE等[4]发现,缺血性心脏疾病或扩张型心肌病引起的心力衰竭,血浆Myostatin水平增加。本研究进一步发现,COPD患者血浆Myostatin水平与反应RV功能的重要超声参数相关。结果表明,循环血中Myostatin水平升高可能与COPD晚期RV功能障碍有关。Myostatin是肌肉、骨骼肌质量调节因子,主要在骨骼肌上表达,而它也在心肌组织中表达。本研究的结果提出了1个问题:血浆Myostatin升高的原因是什么吗?是心力衰竭患者心脏分泌的Myostatin?
在心肌梗死动物模型中发现,心肌细胞上Myostatin的表达升高,在健康动物的心肌受损或心力衰竭时,心肌myostatin水平升高[3]。心力衰竭大鼠心肌Myostatin水平增加,并且干预治疗可降低心肌Myostatin水平[9]。由于心力衰竭患者Myostatin水平在循环血和心肌中同时增加,本研究假设COPD患者右心衰竭,合并PH患者循环血Myostatin升高可能和心肌中水平伴随增加,后者可能是循环血Myostatin升高的原因。HEINEKE等[10]报道,在心力衰竭时,心脏特异性产生Myostatin,使血浆中Myostatin水平增加3到4倍正常水平。
本研究观察到Myostatin水平与SPAP之间呈正相关。COPD患者,右心室超负荷导致PH出现。随着气流受限程度的日益严重和慢性低氧血症,肺血管收缩和血管阻力增加,肺动脉压力增大。这意味着,右心室功能长期过度后负荷和机械应力,导致肺心病失代偿,之后右心衰竭,并出现PH[3]。这也解释了本研究COPD患者中Myostatin水平和RV功能指标如TAPSE、FAC、RVMPI之间相关性的原因。Myostatin水平与RV功能指标、以及与肺血流动力学指标(SPAP)相关性,可能与COPD患者右心衰竭导致Myostatin上调有关。
COPD合并PH患者,RV直径扩大。Myostatin与RV直径相关,与RVMPI相关。RVMPI增大是右室功能不全的指标和反应RV扩张的一个间接指标[11]。研究结果表明,血浆Myostatin水平可能与RV容积增大有关。在容量超负荷致心力衰竭时,大鼠心肌Myostatin的表达上调[12],可以解释上述原因。研究表明[10],Myostatin可以作为心肌细胞增生性生长因子抑制剂。本研究中,大多数COPD合并PH患者,RV肥大与右室游离壁厚<5 mm以上。此外,观察到Myostatin水平和右心室室壁厚度呈正相关[13]。事实上,肥大是RV后负荷过度的早期迹象。表现为室壁增厚、RV趋于正常化的病理应激过程。COPD合并PH自然病程中,最初右心室代偿肥大,随后失代偿,RV扩张,最终心力衰竭。研究发现[3],Myostatin可能作为1个潜在的反调节器响应于心力衰竭的病理应激,但这种平衡以心力衰竭为代价。所以,本研究结果显示,右室功能参数(TAPSE和RVMPI)及SPAP与血浆Myostatin水平的相关性是合理的。从某种程度上,在COPD中,血浆Myostatin是RV功能障碍的1个指标,可早期预测是否合并PH。
研究发现在COPD、右心衰竭等患者中BNP和氨基末端脑钠肽前体(amino-terminal pro-brain natriuretic peptide,NT-Pro BNP)升高;同时,它们可作为慢性肺部疾病患者PH的1个预测因子[14]。本研究血浆BNP水平在COPD合并PH组中高于COPD无PH组。相关分析观察到BNP水平与SPAP相关。最近研究表明,COPD合并PH患者血浆BNP水平升高,BNP和NT-Pro BNP是目前用于诊断PH的重要的血清学标志物[2]。在COPD中发现,BNP和Myostatin呈正相关。这是因为BNP和Myostatin都在心肌中表达,与室壁应力增加有关,它们都可以从心肌释放进入循环。因此,血浆BNP水平与Myostatin水平的相关性是合理的。然而,相关系数显示,在反映RV功能参数上,BNP水平没有Myostatin水平强烈;此外,回归分析显示,2个重要的RV功能参数(TAPSE和RVMPI)、SPAP与Myostatin水平相关,但BNP水平仅仅与SPAP相关。本研究没有发现BNP水平与RV形态学相关。因此,这项研究表明,和BNP相比,在预测COPD合并PH方面,Myostatin可能更敏感。
目前的研究表明,COPD合并PH,血浆Myostatin水平增加,血浆Myostatin水平和COPD右心功能及形态学相关。与血浆BNP水平比较,在评估右心功能及肺动脉高压方面,Myostatin水平有更强的相关性。这些结果表明,Myostatin可能优于BNP对COPD合并PH的早期诊断,值得深入研究。
[1]LAU E M, TAMURA Y, MCGOON M D, et al. The 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: A practical chronicle of progress[J]. Eur Heart J 2015, 46(4): 879-882.
[2]GALE C P, WHITE J E, HUNTER A, et al. Predicting mortality and hospital adimission in patients with COPD: signi fi cance of NT pro-BNP, clinical and echocardiographic assessment[J]. J Cardiovase Med(Hagerstown), 2011, 12(9): 613-618.
[3]JU C R, CHEN M, ZHANG J H, et al. Higher plasma myostatin levels in cor pulmonale secondary to chronic obstructive pulmonary disease[J]. PLoS ONE, 2016, 11(3): e0150838.
[4]GEORGE I, BISH L T, KAMALAKKANNAN G, et al. Myostatin activation in patients with advanced heart failure and after mechanical unloading[J]. Eur J Heart Fail, 2010, 12(5): 444-453.
[5]中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版)[J]. 中华结核和呼吸杂志,2013, 36(4): 255-264.
[6]RUDSKI L G, LAI W W, AFILALO J, et al. Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Society of Echocardiography endorsed by the European Association of Echocardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of Echocardiography[J]. J Am Soc Echocardiogr, 2010, 23(7): 685-713.
[7]FREIXA X, PORTILLO K, PARÉ C, et al. Echocardiographic abnormalities in patients with COPD at their first hospital admission[J]. Eur Respir J, 2013, 41(4): 784-791.
[8]GRUSON D, GINION A, LAUSE P, et al. Urotensin II and urocortin trigger the expression of myostatin, a negative regulator of cardiac growth, in cardiomyocytes[J]. Peptides, 2012, 33(2):351-353.
[9]LENK K, ERBS S, HÖLLRIEGEL R, et al. Exercise training leads to a reduction of elevated myostatin levels in patients with chronic heart failure[J]. European Journal of Preventive Cardiology, 2012,19(3): 404-411.
[10]HEINEKE J, AUGER-MESSIER M, XU J, et al. Genetic deletion of myostatin from the heart prevents skeletal muscle atrophy in heart failure[J]. Circulation, 2010, 121(3): 419-425.
[11]PARIAUT R, SAELINGER C, STRICKLAND K N, et al.Tricuspid annular plane systolic excursion (TAPSE) in dogs:Reference values and impact of pulmonary hypertension[J].Journal of Veterinary Internal Medicine, 2012, 26(5): 1148-1154.
[12]BREITBART A, AUGER-MESSIER M, MOLKENTIN J D,et al. Myostatin from the heart: Local and systemic actions in cardiac failure and muscle wasting[J]. Ajp Heart & Circulatory Physiology, 2011, 300(6): 1973-1982.
[13]CHOI J O, CHOI J H, LEE H J, et al. Dual pulsed-wave doppler tracing of right ventricular inflow and outflow: single cardiac cycle right ventricular tei index and evaluation of right ventricular function[J]. Korean Circulation Journal, 2010, 40(8):391-398.
[14]SU Y C, KIM E Y, BAN H J, et al. Plasma N-terminal pro-brain natriuretic peptide: A prognostic marker in patients with chronic obstructive pulmonary disease[J]. Lung, 2012, 190(1): 271-276.

