P5CR基因的进化及其在木薯中的表达分析
丁泽红 付莉莉 颜彦 铁韦韦 胡伟
(中国热带农业科学院热带生物技术研究所,海口 571101)
木薯(Manihot esculentaCrantz)是大戟科热带和亚热带地区重要的薯类作物,具有高产、高淀粉和耐贫瘠等特点,在现代工业和农业中起着非常重要的作用。木薯具有发达的根系,可以忍受长达4-6个月的干旱胁迫[1]。然而,在这种长时间(或较为严重)的干旱胁迫条件下,木薯的生长和发育受到显著了的影响,最终导致其块根产量减少[2]。作为典型的热带块根作物,木薯主要种植在南北纬30°之间的热带和亚热带地区。木薯对温度非常敏感,低于14℃时木薯生长会明显变缓,低于10℃时木薯将停止生长。更为严重的是,在极端的低温天气下木薯块根产量会急剧下降甚至绝收[3]。因此,提高木薯抵御干旱和低温等胁迫的抗性,对减少木薯在不良生长环境下的产量损失具有重要指导意义。
脯氨酸是重要的渗透调节物质,在植物体内起着调节细胞渗透平衡、维持细胞结构稳定和清除活性氧等作用[4]。在干旱、低温、高盐等胁迫条件下,植物体内脯氨酸含量会显著增加[5-6],其含量和植物的抗逆性呈正相关[7]。植物脯氨酸合成途径可以分为两种:鸟氨酸途径和谷氨酸途径。有趣地是,这两种途径的最后一步反应相同,均由吡咯啉-5-羧酸还原酶(P5CR)催化完成,可见P5CR是脯氨酸生物合成途径的关键酶,由其催化的反应对植物生长可能至关重要,例如在拟南芥中敲除P5CR后可引起植株胚胎致死[8]。此外,在植物中超表达P5CR后,转基因植株在胁迫条件下脯氨酸含量显著增加,其抗逆性显著增强[9]。
大多数植物中P5CR仅由1个基因编码,它们在进化过程中比较保守,属于看家基因(Housekeeping genes)[10]。P5CR的表达在不同组织中存在显著差异。例如,拟南芥中AtP5CR在根中表达量最高,其次是果荚、花和叶,而茎中的表达量最低[11]。P5CR的表达还受到干旱、低温、盐和ABA等的诱导。例如,拟南芥AtP5CR的表达量受到低温、高温和盐胁迫的诱导[12-13];黑麦草LpP5CR的表达受到盐、PEG(Polyethylene glycol)、低温和ABA(Abscisic acid)处理的诱导[14];而小麦TaP5CR的表达则受到盐、PEG和ABA处理的诱导[9]。这些研究成果为在其他植物中挖掘和鉴定P5CR的功能奠定了重要基础。
迄今为止,在木薯中已经克隆了一个P5CR,其表达在转录水平受到渗透胁迫的调控[6]。然而,在木薯中是否还存在其他的P5CR,它们和其他植物中P5CR的进化关系如何以及它们是否参与了木薯干旱、低温等胁迫响应,仍不清楚。本研究拟采用生物信息学的方法从已完成基因组测序的植物中鉴定P5CR,并对其序列特征和进化模式进行分析;之后主要针对木薯MeP5CR,分析其在不同组织以及干旱、低温等胁迫条件下的表达模式,旨在为进一步研究MeP5CR在木薯非生物胁迫中的功能奠定基础,同时也为其他植物中P5CR的功能研究提供参考。
1 材料与方法
1.1 材料
试验所用木薯材料为主推广品种Ku50,由中国热带农业科学院热带生物技术研究所提供。
1.2 方法
1.2.1 材料种植与处理 参照丁泽红等[15]方法进行木薯种植:将具有3-4个芽眼且粗细匀称的木薯茎段(长度约15 cm)扦插于塑料盆(高×上直径×下直径 = 18.8 cm×18.5 cm×14.8 cm)中,每盆1个茎段。基质采用蛭石与营养土按照1:1的体积比进行混合。木薯种植约10 d后进行间苗,每盆保留1棵苗。
木薯种植60 d后,选取长势一致植株分别进行(1)干旱处理:采用20%的PEG-6000溶液模拟干旱胁迫,在处理0、3和24 h后,分别收集老叶、第一片完全展开叶、未展开叶和根的样品,-80℃保存待用;(2)低温处理:采用4℃进行低温胁迫处理,在0、6和24 h后分别收集第一片完全展开叶、未展开叶和根的样品,-80℃保存待用。
为考察MeP5CR在不同组织中的表达变化,收集正常种植条件下木薯Ku50的叶片、叶柄、茎、须根和储藏根的样本,进行qRT-PCR分析。
1.2.2 RNA提取与qRT-PCR 用天根生化科技有限公司RNA提取试剂盒提取木薯总RNA。用Fermentas公司反转录试剂盒将总RNA反转录成cDNA,-20℃保存待用。用Primer 6.0设计引物,由上海生工生物工程股份有限公司合成(表1)。qRTPCR在Mx 3005P荧光定量PCR仪(Stratagene,美国)上进行,每个样品3次生物学重复,按照2-ΔΔCt方法计算基因相对表达量[6]。
1.2.3 生物信息学分析 以拟南芥[16]、水稻[17]中P5CR的蛋白质序列为参考,用BLASTP搜索Phytozome数据库获取其他物种的P5CR同源序列。在去除冗余序列之后,用NCBI-CDD数据库进行保守结构域分析,确保每条序列都含有P5CR保守结构域。之后,用ClustalX进行序列比对;用MEGA5.2构建Neighbor-Joining系统进化树;用ExPASy ProtParam分析蛋白质的分子量和等电点。

表1 qRT-PCR引物
2 结果
2.1 P5CR在不同物种中的分布
以拟南芥和水稻中P5CR为查询序列,搜索Phytozome数据库,在45个物种中共找到54条P5CR序列,其中苹果P5CR数目最多,为3个,其次是柳枝稷、卷心菜、白菜型油菜、落地生根、巴旦木、亚麻、大豆,为2个,在主要单子叶植物(如水稻、玉米、小米、高粱等)和双子叶植物(如拟南芥及其近缘种鼠耳芥等)中有且仅有1个P5CR(图1和表2)。木薯与杞柳、毛果杨亲缘关系较近,它们仅有1个P5CR。除此之外,在许多低等生物如团藻、莱菌衣藻、盐生杜氏藻、小立碗藓和泥炭藓中也只有1个P5CR(图1)。
序列特征分析表明,P5CR平均氨基酸长度为282.6,最大值为347,最小值为208;平均外显子数目为7.2,最大值为9,最小值为6(表2)。P5CR的分子量和等电点在不同物种之间的差别不大。相比之下,P5CR长度的最大值为9 797 bp,最小值为1 174 bp,两者相差9倍之多(表2)。可见,P5CR在基因长度上差别较大,且这种差异主要是由内含子长度上的差异造成的。
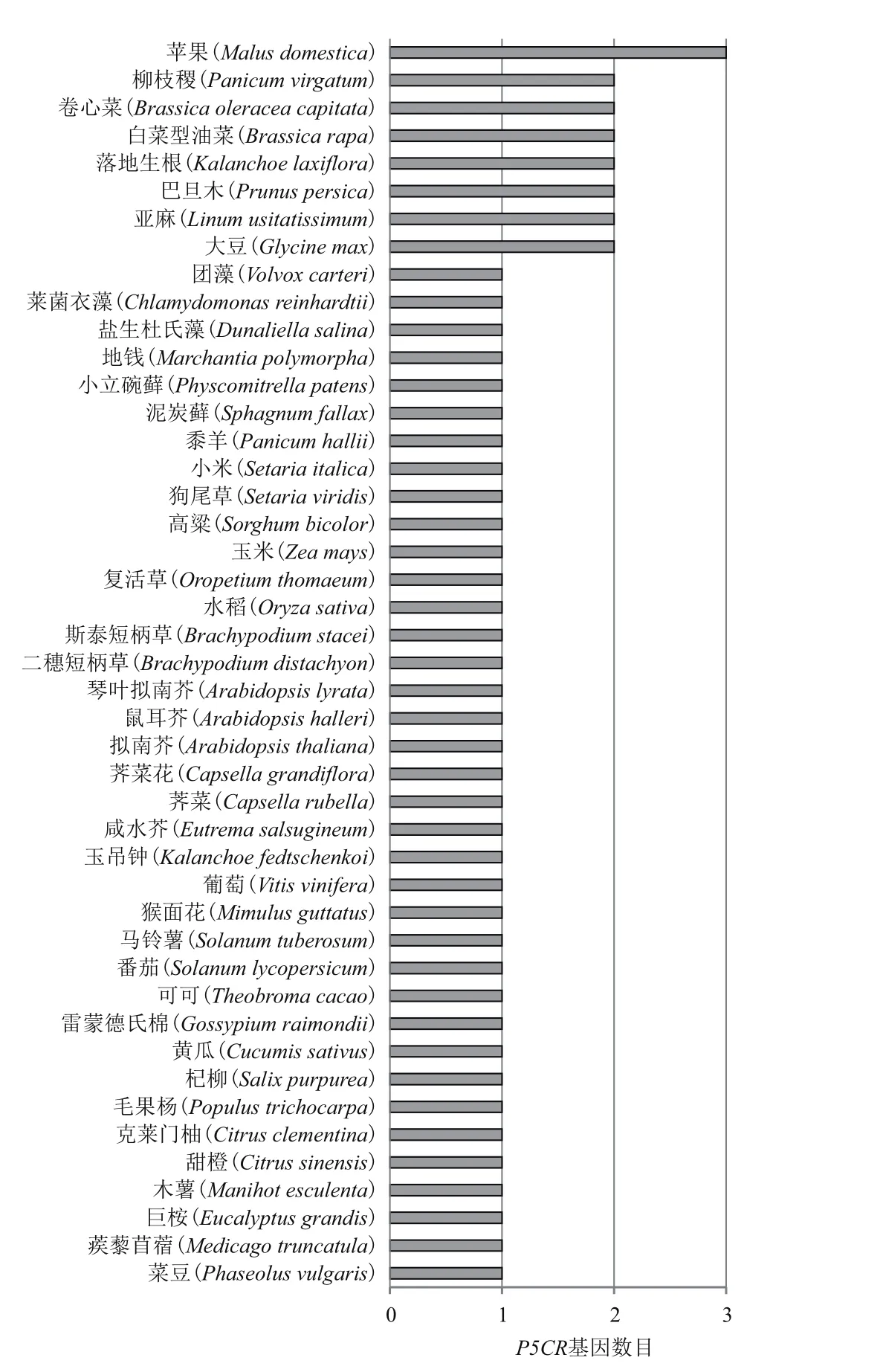
图1 P5CR基因在不同物种中的分布
2.2 P5CR进化分析
将54条P5CR氨基酸序列进行比对、聚类后发现,它们可以分成12个主要组群(图2)。其中,木薯与巨桉中P5CR的亲缘关系较近,聚类在一起(图2-K)。可以清楚的看到,各物种中P5CR的亲缘关系与物种之间的进化关系呈现很好的一致性:低
等藻类和藓类植物(如团藻、莱菌衣藻、泥炭藓和小立碗藓等)都聚类在A组,单子叶植物(如水稻、高粱、玉米和二穗短柄草等)都聚类在B组,双子叶植物(如拟南芥、琴叶拟南芥和鼠耳芥等)都聚类在D组,豆科植物(如大豆、菜豆和蒺藜苜蓿等)都聚类在L组,且大多数植物中都只有1个P5CR(图2)。不同组群之间P5CR长度的统计结果显示,除了个别组群中P5CR的长度要显著的低于或高于其他组群,如D组(双子叶植物)中P5CR长度最小(~1 600 bp)、F组(茄科植物)和J组(可可和雷蒙德氏棉)中P5CR长度最大(>6 000 bp),大多数组群中P5CR的长度都保持在4 000 bp左右,差异不显著(图3)。结果表明,P5CR在各物种之间非常保守,且是单基因起源的。
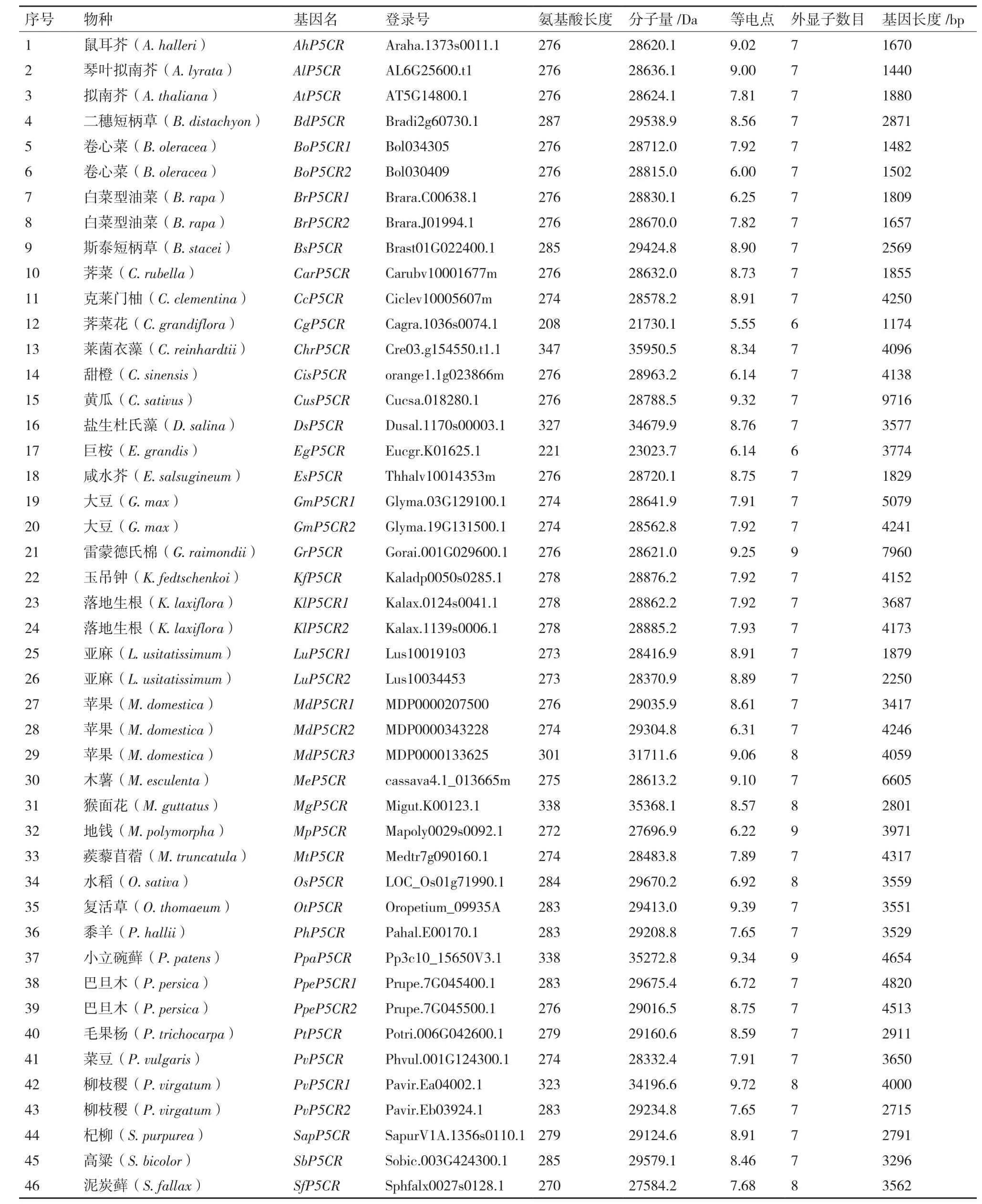
表2 本研究中鉴定到的P5CR
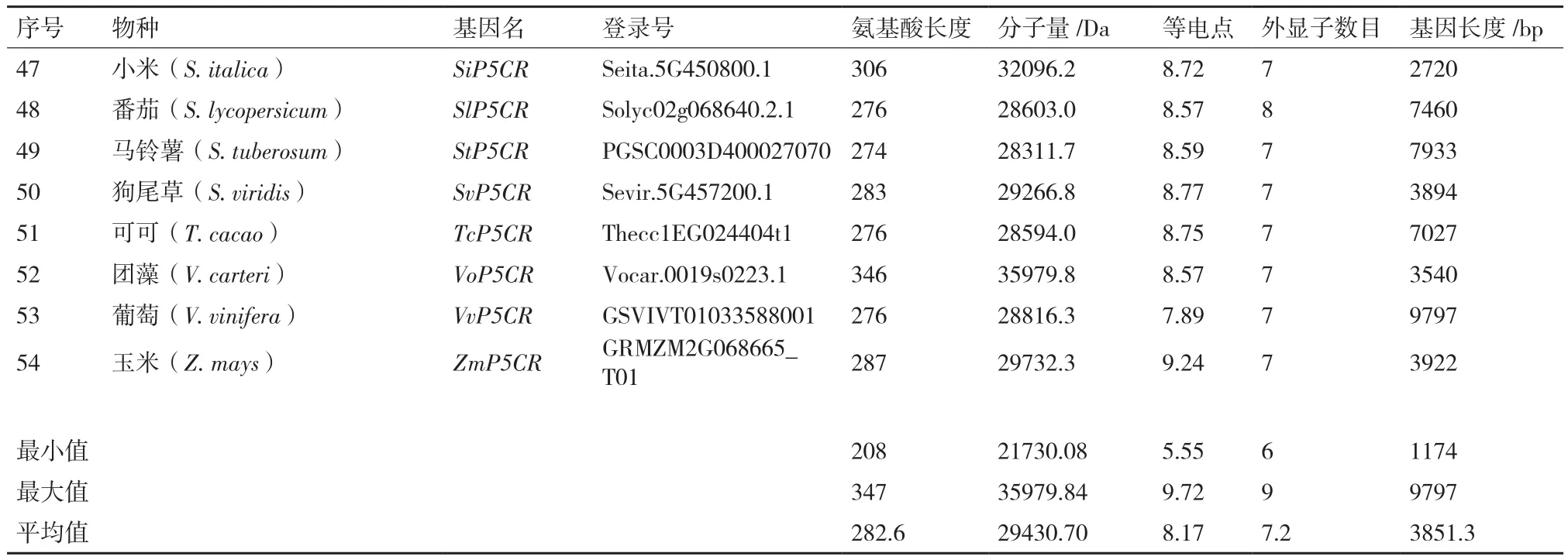
续表
在少数物种中P5CR仍发生了2-3次重复,并可以将它们归纳成3种进化模式。模式I:种内进化模式,即只在两近缘物种中的某一物种发生重复。例如,大豆和菜豆都属于豆科植物,亲缘关系较近,大豆中有2个P5CR(GmP5CR1和GmP5CR2),而菜豆中只有1个P5CR(PvP5CR),且它们聚类在一起(图2-L);模式Ⅱ:种间进化模式,即在两近缘物种中均发生重复。例如,卷心菜和白菜型油菜都属于芸苔属植物,亲缘关系较近,卷心菜和白菜型油菜中均有2个P5CR,且卷心菜BoP5CR1和BoP5CR2分别和白菜型油菜BrP5CR1和BrP5CR2聚类在一起(图2-D);模式Ⅲ:种间与种内进化模式共存。巴旦木和苹果亲缘关系较近,本研究发现巴旦木PpeP5CR1和苹果MdP5CR1、MdP5CR3聚类在一起(图2-C),而巴旦木PpeP5CR2和苹果MdP5CR2聚类在一起(图2-H)。以上结果表明,P5CR呈现多样性的进化模式。
2.3 MeP5CR在不同组织中的表达情况
采用qRT-PCR方法检测MeP5CR在木薯不同组织中的表达情况。结果(图4)表明,MeP5CR在叶片、须根和储藏根中表达量最高,且三者之间的表达量无显著差异;MeP5CR在叶柄和茎中的表达量最低,仅是叶片中表达量的48%和51%。说明MeP5CR主要是在木薯叶片、须根和储藏根中起作用。
2.4 MeP5CR对干旱和低温胁迫的响应
采用qRT-PCR方法在木薯不同叶片(如第一片完全展开叶、未展开叶及老叶)和根中,分别检测MeP5CR对干旱(PEG模拟)和低温胁迫的响应情况。在PEG胁迫条件下,在老叶中MeP5CR呈现先不变后下降的变化趋势,在24 h其表达量显著下降约36%;在第一片完全展开叶MeP5CR呈现先下降后上升的变化趋势,在3 h和24 h其表达量分别下降20%和提高1.3倍;在未展开叶和根中,MeP5CR呈现持续下降的变化趋势,在24 h其表达量分别下降23%和9%(图5-A)。
在低温胁迫条件下,在未展开叶中MeP5CR的表达量呈现先上升后下降的变化趋势,在6 h其表达量提高3.7倍,在24 h其表达量又回复到初始水平;在根中MeP5CR的表达量也呈现先上升后下降的变化趋势,在6 h和24 h其表达量分别提高1.9倍和下降59%;在第一片完全展开叶中,MeP5CR的表达量呈现持续上升的变化趋势,在6和24 h其表达量分别提高3.4倍和5.9倍(图5-B)。
综上所述,MeP5CR在转录水平参与木薯干旱和低温胁迫响应。
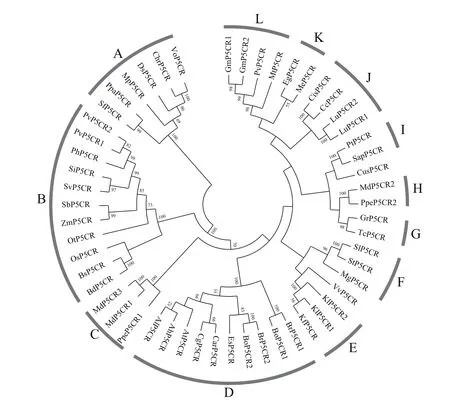
图2 植物中P5CR的进化树分析
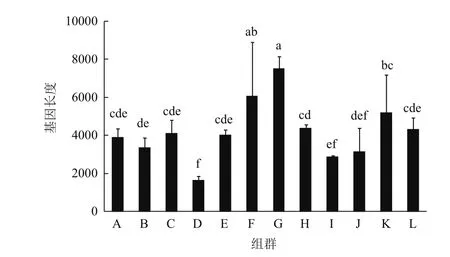
图3 不同组群中P5CR长度的变化
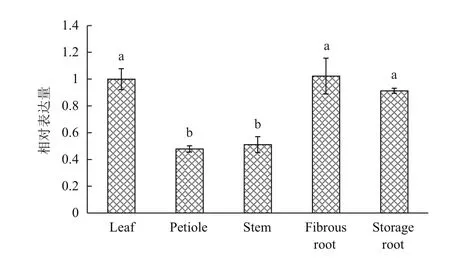
图4 MeP5CR在不同组织中的表达
3 讨论
P5CR属于看家基因,在大多数植物中有且仅有1个拷贝[10]。尽管目前已陆续从拟南芥、水稻、黑麦草、木薯等植物中克隆了P5CR[6,14,17],但这些研究仅关注于少数几个物种的P5CR亲缘关系,无法全面系统地了解P5CR的进化历史。本研究采用生物信息学方法,从已经完成基因组测序的45个植物中共鉴定出54条P5CR序列,并考察了它们在不同植物中的分布情况(图1)。结果表明,在主要农作物(水稻、玉米、小米、高粱)和模式植物拟南芥中都仅有1个P5CR,与前人研究结果一致[10]。在木薯中也只有1个P5CR成员。与前人报道不同的是,本研究发现至少在8种植物(包括苹果、柳枝稷、卷心菜、白菜型油菜、落地生根、巴旦木、亚麻、大豆)中存在2-3个P5CR(图1),暗示P5CR在这些植物中存在不一样的进化过程。序列特征分析表明,各植物中P5CR的氨基酸长度、分子量大小、和外显子数目相差不大,但基因长度的变化幅度非常大。进一步分析表明,基因长度的变化主要是由内含子长度的变化引起的,且这种变化与物种进化的关系非常密切(图3)。
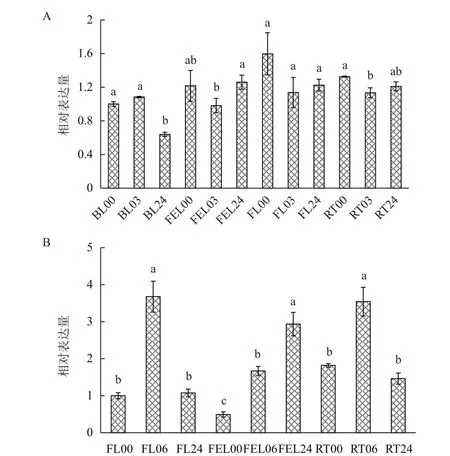
图5 MeP5CR对干旱和低温胁迫的响应
聚类分析表明,各物种中P5CR的亲缘关系与物种之间的进化关系呈现很好的一致性。而且,无论是在低等藻类藓类植物中,还是在高等单子叶和双子叶植物中,大多数物种有且仅有1个P5CR,与前人研究结果一致[10]。说明P5CR是单基因起源的,且在各物种之间非常保守。尽管如此,仍有少数物种中的P5CR发生了2-3次重复:这些重复或只发生在某一物种内部,如P5CR基因在大豆(GmP5CR1和GmP5CR2)中发生了一次重复,但在菜豆中没有发生重复;或发生在某两近缘物种分化之前,并在分化之后继续保留在两近缘物种中,如卷心菜BoP5CR1和BoP5CR2和白菜型油菜BrP5CR1和BrP5CR2;或以上2种情况同时发生,如巴旦木和苹果中的P5CR基因(图2):产生这种结果的最大可能性是,在巴旦木和苹果分化之前,P5CR基因发生一次重复,使得巴旦木和苹果中分别保留有2个P5CR基因(PpeP5CR1和PpeP5CR2,和MdP5CR1和MdP5CR2);在巴旦木和苹果分化之后,巴旦木中的P5CR基因维持不变,而苹果中的P5CR基因再次发生一次重复(如MdP5CR1发生重复获得MdP5CR3)。这一推测从基因组结构分析上也得到了验证:PpeP5CR1和PpeP5CR2、MdP5CR1和MdP5CR2在染色体上分别成串联重复排列,且相互之间具有共线性。值得强调的是,本研究并没有发现在某一植物不存在P5CR,这可能是因为P5CR丢失后会引起植株致死[8]。以上结果比较系统地阐述了P5CR在植物中的进化方式,为进一步研究其在不同物种中的功能奠定基础。
P5CR在不同植物中非常保守,暗示它们可能具有相同的功能,在基因表达水平上通常表现为相同的表达模式。拟南芥中AtP5CR在茎中的表达量最低,而在根中表达量最高[11];木薯中MeP5CR也表现出相同的表达模式,支持“根是脯氨酸生物合成的主要场所,而茎则主要是负责脯氨酸的运输”的结论[11]。研究表明,P5CR的表达还受到干旱、低温、盐和ABA等处理的诱导。例如,在低温胁迫条件下,AtP5CR的表达量上升了约3倍[12];在盐、PEG、低温和ABA处理条件下,LpP5CR的表达量被诱导了约2-4倍[14]。本研究发现,在低温胁迫条件下,MeP5CR的表达量在未展开叶、第一片完全展开叶、和根中分别上升了3.7倍、5.9倍和1.9倍;然而,在干旱条件下,MeP5CR的表达量却被显著的抑制了,暗示不同植物中P5CR对同一胁迫的响应可能是不一样的。本研究结果将有助于深入了解P5CR在不同植物中的进化模式,同时也为进一步研究MeP5CR在木薯干旱和低温等逆境胁迫中的功能奠定基础。
4 结论
在不同植物中,P5CR内含子长度差别较大,而在氨基酸长度、外显子数目、等电点和分子量方面差别不大。在大多数植物(如木薯)中,P5CR有且仅有1个拷贝,在进化上比较保守;而在某些植物(如大豆、苹果等)中有2-3个拷贝,并将其进化方式归纳为3种模式。木薯MeP5CR在叶片、须根和储藏根中表达量最高,而在叶柄和茎中的表达量最低。此外,MeP5CR表达量受到低温胁迫诱导、但被干旱胁迫抑制。
[1] Lokko Y, Anderson JV, et al.Characterization of an 18, 166 EST dataset for cassava(Manihot esculentaCrantz)enriched for droughtresponsive genes[J]. Plant Cell Rep, 2007, 26(9):1605-1618.
[2] Okogbenin E, Setter TL, Ferguson M, et al.Phenotypic approaches to drought in cassava:review[J]. Frontiers in Physiology, 2013,4(1):93.
[3] 卢赛清, 盘欢, 马崇熙, 等. 2008年广西木薯低温冻害情况及应对措施[J]. 广西热带农业, 2009, 1(1):21-22.
[4] 颜志明, 孙锦, 郭世荣. 外源脯氨酸对NaCl胁迫下甜瓜幼苗生长和活性氧物质代谢的影响[J]. 江苏农业学报, 2011, 27(1):141-145.
[5] 邓凤飞, 杨双龙, 龚明. 外源ABA对低温胁迫下小桐子幼苗脯氨酸积累及其代谢途径的影响[J]. 植物生理学报, 2015, 51(2):221-226.
[6] 付莉莉, 韩冰莹, 谭德冠, 等. 木薯MeP5CS和MeP5CR基因克隆及其干旱胁迫下的表达分析[J]. 湖北农业科学, 2016, 55(15):4024-4028.
[7] Claussen W. Proline as a measure of stress in tomato plants[J].Plant Science, 2005, 168(1):241-248.
[8] Funck D, Winter G, Baumgarten L, et al.Requirement of proline synthesis duringArabidopsisreproductive development[J]. BMC Plant Biology, 2012, 12(1):191.
[9] Ma L, Zhou E, Gao L, et al.Isolation, expression analysis and chromosomal location of P5CR gene in common wheat(Triticum aestivumL.)[J]. South African Journal of Botany, 2008, 74(4):705-712.
[10] Forlani G, Makarova KS, Ruszkowski M, et al.Evolution of plant δ1-pyrroline-5-carboxylate reductases from phylogenetic and structural perspectives[J]. Front Plant Sci, 2015, 6(1):567.
[11] Hua XJ, van de CB, Montagu MV, et al.Developmental regulation of pyrroline-5-carboxylate reductase gene expression inArabidopsis[J]. Plant Physiol, 1997, 114(4):1215-1224.
[12] Xue Y, Peng R, Xiong A, et al.Yeast heat-shock protein gene HSP26 enhances freezing tolerance inArabidopsis[J]. Journal of Plant Physiology, 2009, 166(8):844.
[13] Yoshiba Y, Kiyosue T, Katagiri T, et al.Correlation between the induction of a gene for delta 1-pyrroline-5-carboxylate synthetase and the accumulation of proline inArabidopsis thalianaunder osmotic stress[J]. Plant J, 1995, 7(5):751-760.
[14] Cao L, Wei S, Han L, et al.Gene cloning and expression of the pyrroline-5-carboxylate reductase gene of perennial ryegrass(Lolium perenne)[J]. Horticultural Plant Journal, 2015, 1(2):113-120.
[15] 丁泽红, 付莉莉, 铁韦韦, 等. 木薯MeHB2转录因子的克隆与表达分析[J]. 西北植物学报, 2016, 36(8):1522-1527.
[16] Miller G, Honig A, Stein H, et al.Unraveling Δ1-pyrroline-5-carboxylate-proline cycle in plants by uncoupled expression of proline oxidation enzymes[J]. J Biol Chem, 2009, 284(39):26482-26492.
[17] Sripinyowanich S, Klomsakul P, Boonburapong B, et al.Exogenous ABA induces salt tolerance in indica rice(Oryza sativaL.):The role of OsP5CS1 and OsP5CR gene expression during salt stress[J]. Environmental and Experimental Botany, 2013, 86(2):94-105.

