山茶属种质资源亲缘关系的SSR 分析
张旻桓,张汉卿,蔡秀兰,王 海,叶 烨,吴 毅
(1.中南林业科技大学,湖南 长沙 410004;2.福建鑫禾园林开发有限公司,福建 三明 365000;3.湖南涉外经济学院,湖南 长沙 410006)
茶花Camellia japonica是山茶科山茶属植物,中国十大名花之一,为世界名贵花木[1-2],其优良品种选育长期受到国内外园艺界的重视[3-6]。已有1 000 多年的栽培历史,深受人们喜爱。中国是山茶属植物的世界分布中心,种质资源极其丰富[7-10]。但是,长期的引种和杂交,使茶花品种的遗传背景模糊,品种间亲缘关系难以界定,在大树油茶嫁接茶花时难以区别对待[11-12]。近年来,有不少企业进行油茶大树嫁接茶花方式的研究和试验,但茶花实生苗生长缓慢[13],无法满足人们对优良名贵茶花品种欣赏的要求,而大量的油茶林产量低、效益差。用山茶花作接穗,嫁接在低产油茶树上,既可以为改造油茶低产林开辟新的途径,又可以快速培育茶花。油茶Camellia oleiferaAbel.为山茶属植物,是直根系树种,主根发达,愈合能力强,适宜用作茶花嫁接砧木。油茶和茶花同为山茶科植物,目前茶花异砧嫁接的常用方法有插皮接、劈接和腹接等,但这些方法仅适合高位换接和树姿整形,不具备大规模繁殖的能力。但油茶大树移栽后进行茶花嫁接还存在较多问题,为了提高油茶根接茶花的成活率,试验研究了基因型对油茶嫁接茶花成活率的影响[14]。
SSR(simple sequence repeat)标记是目前较常用的分子标记之一[15]。SSR 标记具有数量丰富、等位基因变异多、共显性遗传、稳定性和重复性好、操作简单、易于分析等优点[16]。随着山茶属植物的SSR 引物被陆续开发[17],SSR 标记已经被用于山茶属植物的遗传图谱构建、品种鉴定和遗传多样性及亲缘关系的分析[18-21]。
福建鑫禾园林开发有限公司种质资源圃收集和保存国内外茶花种质128 份,其中有从大田选育出的优良变异植株。本研究中应用SSR 分子标记,将36 份花形、花色、花香等受到人们喜爱的品种进行亲缘关系比较分析,以期为优化油茶大树嫁接茶花技术,提高嫁接成活率提供参考,同时为茶花的鉴定及分类、种质资源的保存和合理利用提供参考[22-25]。
1 材料与方法
1.1 试验材料
2015年5月,在福建省明溪县福建鑫禾园林林业开发有限公司茶花种质资源圃,选生长健壮且无病虫危害植株的幼嫩叶片,用保鲜袋编号封存后以变色硅胶干燥备用。各试验材料的编号及名称见表1。

表1 试验材料的编号及名称Table 1 No.and names of test materials
2017年7~11月在中南林业科技大学实验室进行试验。试验中使用Ueno 等从山茶属植物筛选的12 对SSR 引物(见表2),由上海生工生物公司合成,试验用的TaqDNA 聚合酶、dNTPs 等试剂购自北京鼎国生物工程有限公司。
1.2 试验方法
1.2.1 基因组提取与检测
以改良CTAB 法提取样品总DNA,紫外分光光度计检测提取液中核酸质量和浓度,以ddH2O稀释至25 ng/mL 后,-20 ℃保存备用。

表2 12对SSR引物的基本信息Table 2 Basic information of 12 pairs of SSR primers
1.2.2 SSR-PCR 反应体系优化
以品种‘红露珍’DNA 为模板,对Mg2+、Taq DNA 聚合酶、dNTPs、引物以及DNA 模板进行筛选。SSR-PCR 反应体系经过比较和优化确定为20 μL,其中包括模板DNA 20 ng、10×Buffer 2 μL、25 mmol/L MgCl20.8 μL、2.5 mmol/L dNTP 0.8 μL、 引 物 各0.4 μL、TaqDNA 聚 合 酶1 U、ddH2O 10 μL。再以12个茶花品种(分别为‘赤丹’、‘白雪塔’‘宫粉’‘金杯’‘东红’‘皇冠’‘宾司’‘美兰’‘海艳’‘玫瑰茶’‘圣洁’和‘花露珍’)的基因组DNA为模板,按初选的最优反应体系进行PCR反应,检测该体系对不同茶花品种的适用性[1]。
1.2.3 PCR 扩增与产物检测
反应在eppendorf热循环仪上进行。扩增程序为:94 ℃度预变性4 min,94 ℃变性45 s,相应的退火温度复性45 s,72 ℃延伸45 s,35 个循环后72 ℃延伸8 min,8 ℃保存。每份扩增产物各加入6×溴酚蓝1.5 mL,轻微振动混匀,取2.0 mL 产物在8.0%聚丙烯酰胺凝胶上电泳后银染显色,使用FR-200 全自动紫外与可见光凝胶图像分析系统拍照保存。
1.2.4 PCR 数据分析
每对SSR 引物检测1 个位点,每条多态性带代表1个等位基因。遗传聚类(genetic clustering)是反映居群间相似性的一种有效方法,首先计算居群间的遗传距离(D),其值可以从0 至无限大,然后利用POPTREE2软件采用非加权平均聚类法(UPGMA)绘制聚类图[26],分析遗传距离和种质关系。
2 结果与分析
2.1 扩增产物多态性分析
12 对SSR 引物均能扩增出清晰的谱带,共扩增出138 条谱带,其中多态性谱带134 条,多态性比率为97.06%。每对引物检测到的多态性谱带范围为11~16,平均多态性位点数为12.80,多态性比例范围为83.67%~100%。
从76 对SSR 引物中筛选出12 对引物用于茶花材料的SSR 扩增(见表2),经过优化后,退火温度见表2。12 对引物扩增的谱带清晰,且多态性丰富(见图1)。单条引物扩增的条带为5~36 条,平均23.7 条。多态性信息含量指数(PIC)变幅为0.686 8~0.964 0,平均为0.908 4,扩增产物长度100~1 650 bp,以150~750 bp 的扩增片段居多。扩增条带数最少的引物为VVMD19,仅扩增出5 条条带;扩增条带数最多的引物为UDV-033,多达36 条。引物UDV-041 扩增片段长度范围最大,为80~900 bp;引物VVMD19 扩增片段长度范围最小,为180~420 bp。8 对引物共扩增出190 条条带,均为多态性条带,多态性百分率为100%。
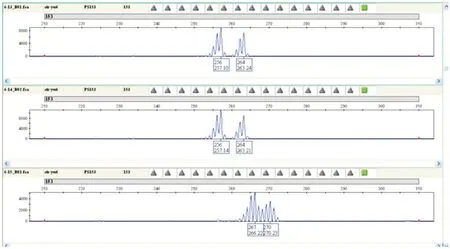
图1 样品在PS153 扩增的毛细管电泳检测Fig.1 Capollary electroperrogram obtained by PS153
2.2 亲缘关系聚类分析
以各品种12 对引物的扩增带型为基础,用NTSYS 软件进行UPGMA 法聚类,分析得出36份茶花的聚类图(见图2)。各品种间遗传相似系数范围为0.62~0.95,平均相似系数为0.793。以遗传相似系数0.624 为标准,可将所有供试材料分为2 个类群A 和B。A 类中油茶单独聚类,另外包括1 份茶花品种‘春诗’,在遗传相似系数0.664 处又分为4 个亚类,即A1、A2、A3 和A4。A1 亚类包括‘云斑大元帅’ ‘太阳颂’‘茶梅’‘南海明珠’‘红荷花’‘休斯富豪’‘耐冬’‘粉十八’‘皇家天鹅绒’‘七星红’;A2 亚类包括‘红露珍’‘花露珍’‘牡丹皇后’‘金奖牡丹’‘四季茶花’‘花仙子’‘旭之舞’;A3 亚类有‘美国大红’;A4 亚类有‘布鲁克氏玫瑰’‘正黄旗’‘豪斯’,且在相似系数0.725 处可进一步划分为2 组,第1 组为‘撒琳佛那礼’‘雅特诗’‘黑绒带’‘香茶花’‘五色赤丹’‘赤丹’‘苏圣尼’;第2组为‘火爆布’‘丹巴通’‘迪斯’‘碧玉’‘斑阿波罗’‘花宝珠’。研究结果表明,SSR 分子标记适合于茶花亲缘关系的研究,组间水平的聚类与形态分类相吻合。

图2 根据SSR 结果构建的36 个茶花品种的亲缘关系Fig.2 Genetic relationship of 36 cultivars of C.japonic based on SSR result
3 结论与讨论
3.1 茶花品种鉴定
EST-SSR 作为一种与基因表达相关的SSR 分子标记,不仅具备传统基因组SSR 标记的共显性、多态性高、重复性好等特点,而且因开发经济、通用性高及性状连锁等优势已在很多植物研究中得到开发和应用。然而,基于ESR-SSR 标记进行茶花种质资源的遗传多样性和亲缘关系的分析报道较为鲜见,且标记数目有限。本研究中利用12对SSR 引物对茶花品种的遗传背景进行分析,筛选出的12对SSR引物能够将全部供试材料区分开。12 对引物均能成功扩增多态位点, 36 份品种资源具有复杂的遗传背景。由于目前国内外茶花品种杂合度高,一些品种往往聚类于不同的群或亚群内,表明不同品种即使单一性状相同也不一定能聚类到一起。一方面,可能是由于供试的茶花品种数量不够大或可用标记数有限,不足以形成一个与形态学特征相一致的清晰的区分模式;另一方面,也可能是供试的栽培茶花品种因种内或品种内发生杂交从而形成了较高的遗传多样性,而聚类结果又同时受到多种形态学性状的影响。此外,也可能因茶花品种繁多,部分品种遗传背景复杂或不清,前人根据形态特征进行分类可能存在错误。
3.2 亲缘关系分析
分析茶花品种资源的亲缘关系的远近,对于大树油茶嫁接茶花的工作具有重要的指导意义。试验结果表明,在大树油茶嫁接时,选择‘云斑大元帅’‘太阳颂’‘茶梅’‘红露珍’和‘美国大红’等与油茶亲缘关系较近的品种更容易嫁接成功,在实际嫁接时,基本与试验结果相吻合。SSR 分子标记能灵敏地揭示2 个亲缘关系十分相近个体间的差异,该试验结果表明,聚类分析中部分地理来源相同或遗传背景相似的品种资源能够聚在同一类群,但也有一些地理来源及遗传背景不一致的品种资源聚集在同一类群,显示了复杂的亲缘关系。茶花有着悠久的栽培历史,在长期的栽培中,遗传资源不断交流,品种数量不均匀,这导致聚类结果的不规律,难以准确区分近似品种的类型,而更难以准确划分同类型的品种,也难以弄清楚一些品种间的亲缘关系及演化;所用引物数量不够,所检测位点较少,使得各品种间的遗传变异估算发生偏差。SSR分子标记反映物种间遗传物质的差异,不易受外界条件影响,但因覆盖的基因组有限,在种质资源分类及亲缘关系研究中,进行大范围的评价和开发大量的标记时,可将形态学标记和分子标记两者相结合来揭示茶花品种间的亲缘关系。

