新型分散液液微萃取-高效液相色谱法检测盐酸利多卡因注射液中2,6-二甲基苯胺杂质
王璇璇, 李 潇, 肖玉秀(组合生物合成与新药发现教育部重点实验室, 武汉大学药学院, 湖北 武汉 430071)
临床常用的局麻药盐酸利多卡因注射液中常含有杂质2,6-二甲基苯胺(2,6-DMA, logP=1.631±0.223,极性较大)[1]。2,6-DMA是一种具有遗传毒性和致癌性的化合物,可能导致高铁血红蛋白血症,且在动物实验中表现出膀胱癌和鼻腔癌致癌性[2-4]。因此,严格控制该注射液中2,6-DMA杂质的含量并进行准确定量显得格外重要。目前,2,6-DMA的定量分析方法主要为HPLC和GC,如GC-FID[5]、GC-MS[5]、LC-MS/MS[6]、超高效液相色谱-四极杆飞行时间质谱法(UHPLC-QTOF MS)[7]等。《中国药典》(2015版)采用HPLC-UV法直接检测盐酸利多卡因注射液中的2,6-DMA杂质[8]。然而,由于注射液中所含有的2,6-DMA浓度极低,现有杂质检测方法常常难以准确定量,不利于盐酸利多卡因注射液的质量控制。对2,6-DMA进行预富集、提高检测灵敏度,是解决这一问题的有效手段。目前用于萃取富集2,6-DMA的方法主要包括SPE[7]、液-液萃取(LLE)[6,9]和SPME[5]等。
传统的样品预处理方法SPE和LLE存在萃取时间长、有机溶剂消耗量大、不利于高效富集等缺点。SPME和液液微萃取(LLME)可以显著降低有机溶剂的消耗量,是环境友好的样品预处理方法。其中,分散液液微萃取(DLLME)因操作简便、快速,有机试剂消耗少、绿色环保,萃取富集效果好等优点,自2006年以来在分析领域受到广泛关注[10]。DLLME基于目标物在水相和微量有机相中的分配以达到萃取富集效果,特别适合于水性基质样品中目标物的高效富集。经典DLLME体系的组成主要包括萃取剂和分散剂,前者是萃取过程的主要执行者,后者主要是将萃取剂充分分散于待测的水样中,以提高萃取率。早期的萃取剂以含氯有机试剂(密度大于水)为主[11],但其毒性大且对极性化合物萃取不理想[12-14]。近年来,长链烷醇类化合物作为萃取剂已广泛应用于DLLME[15]。长链烷醇是一类低毒性的两亲性物质,有生物表面活性剂的美誉,其在一定条件下可以形成反向胶束结构的超分子溶剂(SUPRAS)[16]; SUPRAS也即两亲物质在分子和纳米尺寸上连续自组装而凝聚形成的与水不相混溶的纳米/微米结构液体,其独特性质是兼具疏水和亲水区域,故对不同极性目标物均能实现高效萃取[17]。然而,由于其密度低于水,微量的长链烷醇萃取剂在DLLME体系中会漂浮在水溶液表面而导致收集困难,常需借助自制窄口径器皿等特殊方法来实现收集,增加了操作的复杂性和/或成本[11,12,15,18,19]。
六氟异丙醇(HFIP)是一个全氟代醇,其相比于碳氢醇具有很多独特的性质:高密度(1.46 g/cm3),强氢键给体能力,两个三氟甲基又赐予其一定的疏水性;与水完全互溶,对很多有机试剂(包括长链烷醇)都具有很强的溶解能力,是潜在的DLLME分散剂;可以介导单一或混合表面活性剂发生自组装而凝聚形成SUPRAS[20-24]。目前国内外还未见HFIP介导长链烷醇两亲分子自组装形成SUPRAS的研究报道。
本文选择正辛醇为萃取剂,HFIP为分散剂、正辛醇的自组装诱导剂和密度调节剂,通过研究HFIP-正辛醇-H2O三元混合体系的相行为,构建了基于HFIP-正辛醇SUPRAS且萃取相位于下层的新型DLLME体系,并采用该萃取体系与HPLC-UV分析方法对盐酸利多卡因注射液中的2,6-DMA杂质进行了检测。
1 实验部分
1.1 仪器、试剂与材料
LC-20AD高效液相色谱仪,配备紫外检测器(Shimadzu,日本); H1850台式高速离心机(湖南湘仪实验室仪器开发有限公司); MX-S涡旋仪(北京大龙兴创实验仪器有限公司); Leica-LCS-SP8-STE超高分辨共聚焦荧光显微镜(Leica,德国); 890Titrando卡氏水分测定仪(Metrohm,瑞士)。
正辛醇(纯度99.5%)、HFIP(纯度99.5%)、利多卡因标准品(纯度≥99%)购于上海阿拉丁生化科技股份有限公司;2,6-DMA标准品(纯度99%)购于上海麦克林生化科技有限公司;盐酸利多卡因注射液(批号:1612072、1612092,标示量为0.1 g: 5 mL)购于山东华鲁制药有限公司;氯化钠、磷酸二氢钠、十二水合磷酸氢二钠、甲醇(分析纯)购于上海国药集团化学试剂有限公司;乙腈(色谱纯)购于上海星可高纯溶剂有限公司;去离子水(电阻率≥18 MΩ5cm, pH=5.6~5.8)由Milli-Q Reference超纯水系统(Millipore,法国)制得。
利多卡因标准储备液(1 g/L)和2,6-DMA标准储备液(10 mg/L)分别用甲醇配制于5 mL棕色容量瓶中,于4 ℃避光储存。不同浓度的工作溶液由标准储备液用去离子水稀释而得。盐酸利多卡因注射液用去离子水(0.1 mol/L NaOH调至pH 9)稀释成含1 g/L盐酸利多卡因的稀释液备用。
1.2 相行为研究
在室温下绘制HFIP-正辛醇-H2O体系的二元相图,以确定SUPRAS形成的区域和相应的体系条件。将一定体积的正辛醇溶于一定体积的HFIP中,混匀,然后将混合液用微量注射器快速注入装有一定量去离子水(含罗丹明B染料,便于观察)的1.5 mL离心管中(体系总体积为1 mL), 60 W涡旋10 s后,3 000 r/min离心5 min,观察体系的相行为。以正辛醇加入量为横坐标,HFIP用量为纵坐标,绘制二元相图。
1.3 相率分析和微结构观察
相率分析:记录不同条件下HFIP-正辛醇-H2O体系所形成的下相SUPRAS的体积(Vs)和体系的总体积(Vt),以二者之比(Vs/Vt)表示相率(phase ratio)。分别考察正辛醇用量(0.2%~5.0%, v/v,下同)、HFIP用量(4%~12%)、水溶液pH (2~11)和溶液中NaCl质量浓度(0~50.0 g/L)对相率的影响。
SUPRAS的微结构观察:将一定量的正辛醇溶于一定量的HFIP中,混匀,然后将混合液用微量注射器快速注入装有疏水性染料BODIPY (10-7mol/L,结构见文献[25])或亲水性染料荧光素钠(10-6mol/L)水溶液的离心管中(体系总体积为5 mL), 60 W涡旋10 s后,3 000 r/min离心5 min。将萃取了染料的下相(SUPRAS相)取出,滴在小皿中,置于超高分辨共聚焦荧光显微镜下观察。其中,萃取BODIPY溶液时,正辛醇加入量为1.0%, HFIP加入量为10%;萃取荧光素钠溶液时,正辛醇加入量为1.0%, HFIP加入量为5%。BODIPY的激发波长为575 nm,发射波长为665 nm;荧光素钠的激发波长为490 nm,发射波长为515 nm。
1.4 萃取程序
取5 mL待萃取加标水样或盐酸利多卡因注射液的稀释液置于15 mL离心管中。将20 μL的正辛醇(水样体积的0.4%)和250 μL HFIP (水样体积的5%)涡旋混匀,用微量注射器快速注入上述样品溶液中,60 W涡旋3 s,静置3 min, 3 000 r/min离心3 min,体系分成界面清晰的两相透明溶液,用微量注射器取出下相,用于HPLC分析。
1.5 色谱条件
Syncronis C18反相色谱柱(250 mm×4.6 mm, 5 μm; Thermo,德国),流动相为乙腈-磷酸盐缓冲液(pH 8)(53∶47, v/v),流速为1.0 mL/min,柱温为室温,进样量为10 μL,检测波长为230 nm。
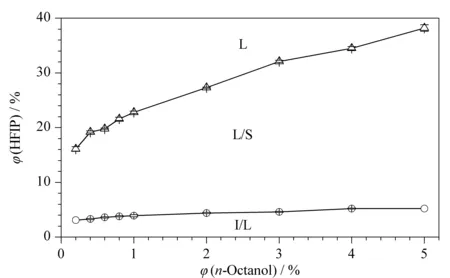
图 1 HFIP-正辛醇-H2O体系的二元相图(n=3)Fig. 1 Binary phase diagram of HFIP-n-octanol-H2O system (n=3) L: isotropic liquid region; L/S: liquid-liquid two-phase region with the aqueous phase in the top and the SURPAS phase in the bottom; I/L: two-phase region with insoluble octanol in the top and the aqueous phase in the bottom.
2 结果与讨论
2.1 相行为
HFIP-正辛醇-H2O体系的二元相图见图1。由图1可知,相图包括3个区域。当HFIP加入量很少时体系形成I/L两相,上相为不溶解的正辛醇(密度小于水),下相为水相;此时体系表现为经典的DLLME体系。随着HFIP用量增加,体系转变为相界面清晰的L/S液-液两相透明溶液,上相为水相,下相为SUPRAS相;正辛醇用量越大,诱导体系形成SUPRAS所需的HFIP用量就越多。当HFIP用量继续增加到一定值时,体系转变为均一的单相溶液(L),不能用于萃取。相图中较大面积的L/S区域为基于HFIP-正辛醇SUPRAS的新型DLLME体系的实际萃取应用提供了良好的可行性;而SUPRAS处于体系的下相,可以解决DLLME中微量低密度萃取相难以收集的问题,且上相的水封还能增加SUPRAS长时间放置的稳定性。
2.2 相率和微结构
体系的相率越大,则SUPRAS的体积越大,不利于对目标物的高效富集。而相率太小,则太小体积的SUPRAS不利于HPLC分析时的取样。本实验首先考察了正辛醇用量和HFIP用量对相率的影响。由于pH值影响弱碱性2,6-DMA的存在形式,萃取时需要优化样品溶液pH以提高萃取和富集效率;又由于盐酸利多卡因注射液中含有氯化钠,因此本实验还考察了样品溶液pH值和溶液中氯化钠含量对相率的影响。如图2所示,随着正辛醇用量和HFIP用量的增加,相率均明显增加,并且正辛醇用量对相率的影响更为显著。但是,样品溶液pH值(2~11)和NaCl质量浓度(0~50.0 g/L)对相率基本没有影响,表明二者对体系形成SUPRAS的能力没有影响。
SUPRAS相的共聚焦荧光显微镜观察结果见图3。强疏水性染料BODIPY分布在球形结构的外面(粉红色荧光),而亲水性染料荧光素钠分布在球形结构的内部(绿色荧光),由此可推测HFIP-正辛醇-H2O体系所形成的SUPRAS呈反向胶束聚集体结构,具有亲水性内核,聚集体直径大约为2~6 μm(Nano Measurer software, version 1.2,复旦大学)。反向胶束聚集体与小分子目标物之间的氢键作用和疏水作用是SUPRAS的主要萃取机理。
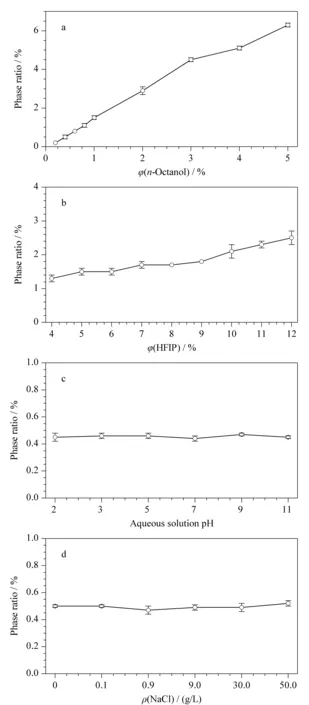
图 2 (a)正辛醇用量、(b)HFIP用量、(c)水溶液pH和(d)NaCl质量浓度对体系相率的影响(n=3)Fig. 2 Effects of (a)n-octanol content, (b)HFIP content,(c)aqueous solution pH and (d)NaCl mass concentration on the phase ratio of HFIP-n-octanol-H2O system (n=3) Conditions: vortex for 10 s at 60 W, centrifugation for 5 min at 3000 r/min; (a) HFIP content 6% (v/v), pH 5.6, without NaCl; (b) n-octanol content 1.0% (v/v), pH 5.6, without NaCl; (c) n-octanol content 0.4% (v/v), HFIP content 5% (v/v), without NaCl; (d) n-octanol 0.4% (v/v), HFIP 5% (v/v), pH 5.6.

图 3 SUPRAS的共聚焦荧光显微镜观察结果Fig. 3 Confocal fluorescence microscopy images of SUPRAS a. Hydrophobic BODIPY, the SUPRAS was formed by 1.0% (v/v) n-octanol and 10% (v/v) HFIP; b. hydrophilic fluorescein sodium, the SUPRAS was formed by 1.0% (v/v) n-octanol and 5% (v/v) HFIP.
2.3 萃取条件优化
由于盐酸利多卡因注射液中2,6-DMA的含量极少,因此釆用富集因子(EF,即目标物在SUPRAS相中的浓度与初始浓度的比值)作为评价萃取效果的指标。
2.3.1正辛醇用量、HFIP用量和样品水溶液的pH值
正辛醇用量增加,则SUPRAS体积显著增加,不利于对目标物的富集;同时又必须保证SUPRAS的体积满足HPLC分析所需的用量。本实验固定HFIP用量为5%,在0.2%~1.0%范围内优化了正辛醇的用量,结果见图4a。正辛醇用量为0.4%时EF最大,为最优选择。
由图1可知,正辛醇用量为0.4%时,HFIP用量在3.3%~19.1%内体系均为L/S分相区域。一方面,考虑到绿色环保的原则,应尽量减少有机试剂的用量;另一方面,分散剂用量越多,SUPRAS体积也越大,不利于对目标物的富集,因此考察了HFIP用量在4%~10%内变化时对目标物富集效果的影响。如图4b所示,5% HFIP用量为最佳选择。

表 1 2,6-DMA在样品溶液中3个水平下的加标回收率和相对标准偏差Table 1 Recoveries and RSDs of 2,6-DMA spiked in sample solutions at three levels
2,6-DMA的pKa为4.31,当pH<4时,2,6-DMA的-NH2为离子状态,不利于通过氢键作用和疏水作用被萃取富集。而pH值越大,2,6-DMA以分子形式存在的比例越大,越有利于萃取富集。因此选择在pH 3~9范围内优化,结果如图4c所示,随着pH值增加,2,6-DMA的EF逐渐增加,故最终选择pH 9。
2.3.2涡旋时间、静置时间和离心时间
涡旋能使目标物与SUPRAS胶束聚集体充分发生作用,静置能使更多目标物分配进入SUPRAS相,而离心可以促使SUPRAS相与水相更好的分离,三者均有利于对目标物的萃取。如图4d~f所示,涡旋时间和静置时间对2,6-DMA的EF影响都不大,但涡旋3 s和静置3 min时,富集效果相对较优;离心时间对2,6-DMA的EF基本没有影响,但离心3 min时萃取效率最大。最终选择涡旋3 s、静置3 min和离心3 min。
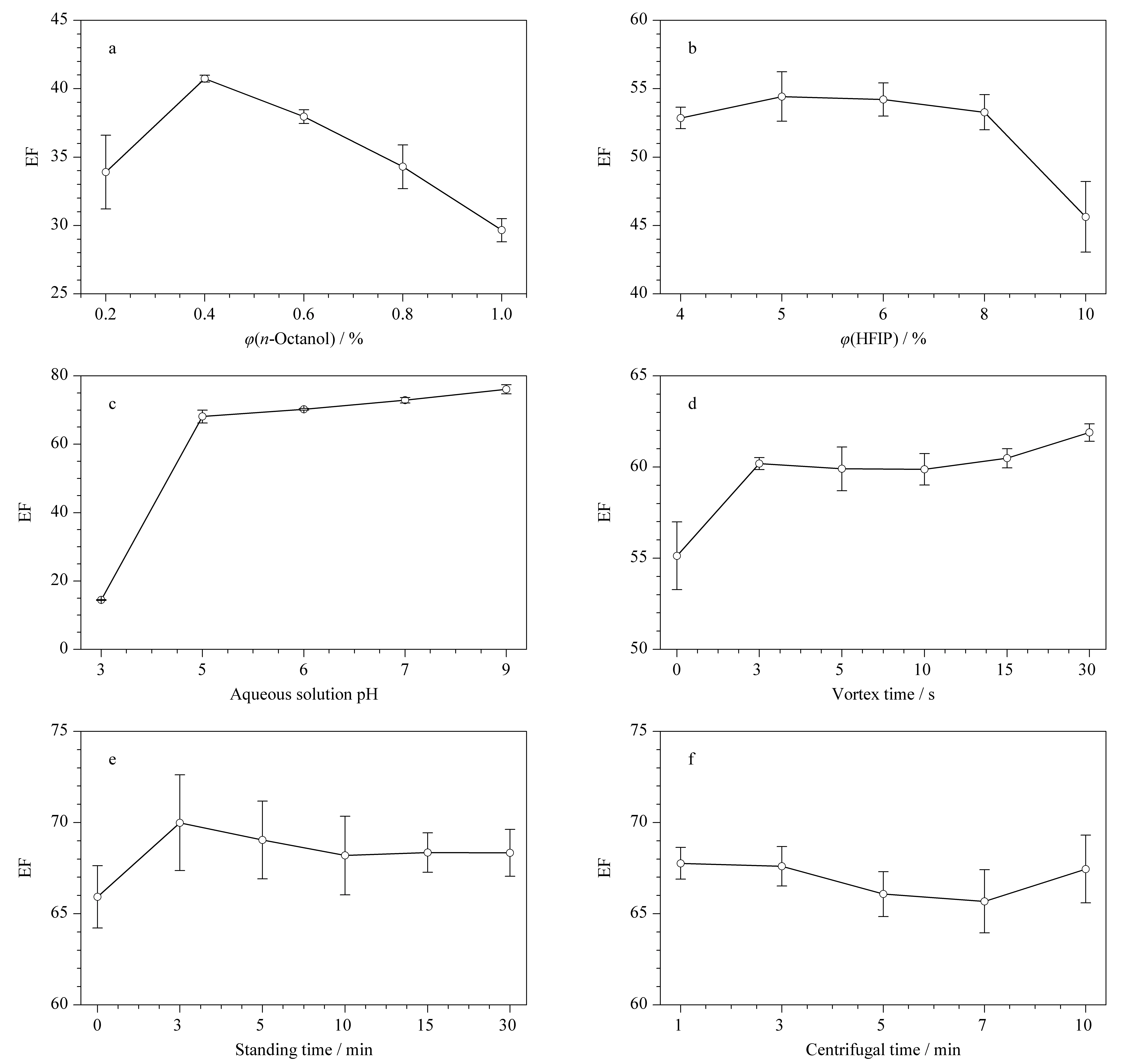
图 4 (a)正辛醇用量、(b)HFIP用量、(c)水溶液pH、(d)涡旋时间、(e)静置时间、(f)离心时间对2,6-DMA富集因子的影响(n=3)Fig. 4 Effects of (a) n-octanol content, (b) HFIP content,(c) aqueous solution pH, (d) vortex time, (e) standing time and (f) centrifugal time on the enrichment factor of 2,6-DMA (n=3)
2.4 方法学验证
采用2,6-DMA加标的盐酸利多卡因注射液的稀释液为样品溶液进行方法学验证。在最优萃取条件(0.4%正辛醇,5%HFIP,样品水溶液pH 9,涡旋3 s,静置3 min,离心3 min)下,样品水溶液经萃取后所得的SUPRAS相直接进行HPLC分析。2,6-DMA在1~100 μg/L范围内线性关系良好(y=964.13x+1 075.4,R=0.998 9,n=6,y:萃取后2,6-DMA的峰面积;x:萃取前2,6-DMA的加标质量浓度,μg/L),检出限(LOD,S/N=3)为0.33 μg/L,定量限(LOQ,S/N=10)为1.00 μg/L,富集因子EF为63(±2)。
方法的准确度和精密度考察结果见表1。2,6-DMA的加标回收率为93.9%~100.8%,日内、日间相对标准偏差(RSD)均不大于2.5%,表明方法的准确度和精密度均良好。
2.5 实际样品检测
将基于HFIP-正辛醇SUPRAS的DLLME体系与HPLC-UV法应用于检测盐酸利多卡因注射液中的2,6-DMA杂质。结果表明,批号分别为1612072和1612092的盐酸利多卡因注射液中均含有0.001 7%的2,6-DMA,符合中国药典(2015)的相关要求(不得大于0.04%)[8]。典型色谱图如图5所示,可以看出,SUPRAS和注射液中其他物质均对2,6-DMA的检测没有干扰;萃取之后2,6-DMA的峰面积和峰高均显著增加,表明基于HFIP-正辛醇SUPRAS的新型DLLME方法可以对2,6-DMA实现高效富集,能够有效地降低检出限。
此外,比较图5a和图5b发现,所建立的萃取方法对注射液中其他几种杂质也有非常好的富集效果。这为盐酸利多卡因注射液中更多杂质的结构鉴定和定量分析提供了可能,有利于进一步提升该药品的质量标准水平。
2.6 与其他方法的比较
表2列出了本文方法与检测2,6-DMA的其他方法的比较[5,7,9]。本文方法操作简单,萃取时间显著少于其他方法。在线性关系、检出限、准确度和精密度方面,本文方法均优于或接近其他方法。
在t2n-3至t2n-1阶段,可以假设信标节点相对静止不动,因此节点B相对于节点A的移动距离即为dAB(t2n-1,t2n-1)-dAB(t2n-3,t2n-3).CB-Sync算法通过1.3节估计的多普勒规模因子η,可求得在t2n-3和t2n-1阶段的平均移动速度
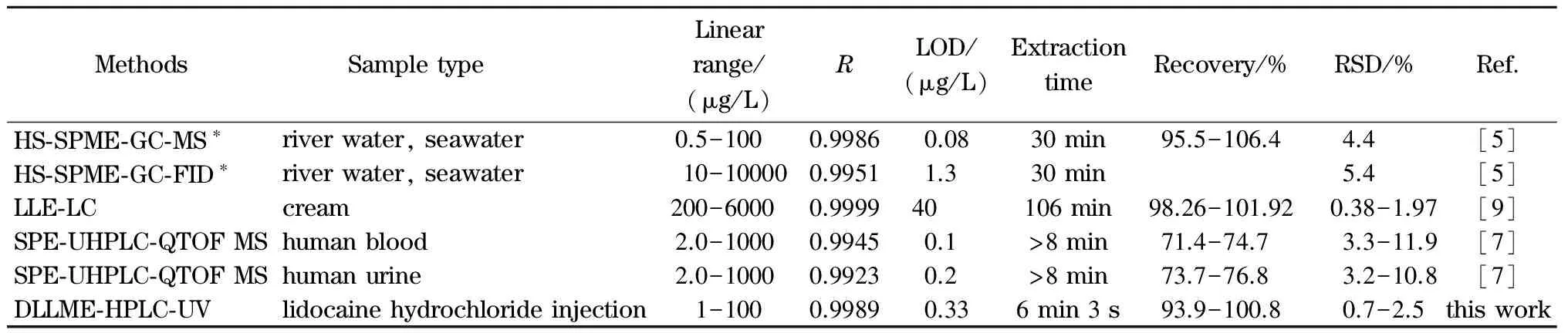
表 2 本文方法与其他方法的比较Table 2 Comparison of this method and other methods
* HS-SPME: headspace-solid phase microextraction.
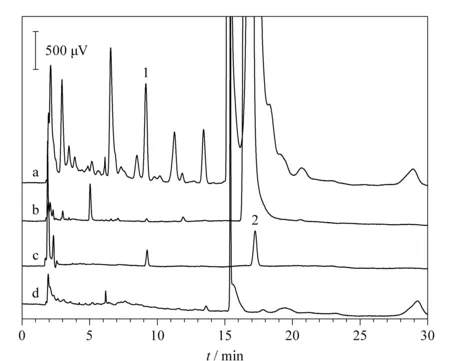
图 5 盐酸利多卡因注射液的稀释液(a)萃取后、(b)萃取前、(c)2,6-DMA(100 μg/L)和利多卡因(1 mg/L)的混合标准溶液以及(d)空白SUPRAS的典型色谱图 Fig. 5 Typical chromatograms of (a) diluted lidocaine hydrochloride injection after extraction, (b) diluted lidocaine hydrochloride injection before extraction, (c) mixed standard solution of 100 μg/L 2,6-DMA and 1 mg/L lidocaine and (d) blank SUPRAS Peak identifications: 1. 2,6-DMA; 2. lidocaine.
3 结论
本文建立了一种基于HFIP-正辛醇SUPRAS的新型DLLME方法。HFIP-正辛醇SUPRAS易于形成、体积小、呈反向胶束聚集体结构,故而可以对极性目标物实现高效萃取和富集;位于体系的下相故而能够解决DLLME中微量低密度萃取相难收集的问题。该萃取方法简便、快捷,绿色环保,具有良好的发展前景。将新型DLLME方法与HPLC-UV法应用于盐酸利多卡因注射液中2,6-DMA杂质的定量检测,灵敏度高,准确度和精密度好,具有可行性。
参考文献:
[1]Belal T S, Bedair M M, Gazy A A, et al. Acta Chromatogr, 2015, 27(3): 477
[2]Fijalek Z, Baczyński E, Piwońska A, et al. J Pharm Biomed Anal, 2005, 37(5): 913
[3]Zheng X C, Mi X X, Li S C, et al. J Food Sci, 2013, 78(6): T955
[4]Tao L, Day B W, Hu B, et al. Cancer Epidemiol Biomarkers Prev, 2013, 22(5): 937
[5]Jain A, Reddy-Noone K, Pillai A K K V, et al. Anal Chim Acta, 2013, 801: 48
[6]Yang F, Bian Z, Li Z, et al. J AOAC Int, 2016, 99(5): 1370
[7]Gao X, Guo H, Du Y, et al. J Anal Toxicol, 2015, 39(6): 444
[8]Pharmacopoeia Commission of the People’s Republic of China. Pharmacopoeia of the People’s Republic of China, Part 2. Beijing: China Medical Science and Technology Press, 2015: 979
国家药典委员会. 中华人民共和国药典, 二部. 北京: 中国医药科技出版社, 2015: 979
[9]Plenis A, Konieczna L, Miekus N, et al. Chromatographia, 2013, 76(5/6): 255
[10]Rezaee M, Assadi Y, Hosseini M R M, et al. J Chromatogr A, 2006, 1116(1): 1
[11]Leong M I, Fuh M R, Huang S D. J Chromatogr A, 2014, 1335: 2
[12]Yan H Y, Wang H. J Chromatogr A, 2013, 1295: 1
[13]Jafarvand S, Shemirani F. J Sep Sci, 2011, 34: 455
[14]Hu X Z, Wu J H, Feng Y Q. J Chromatogr A, 2010, 1217: 7010
[15]Kocúrová L, Balogh I S, Sandrejová J, et al. Microchem J, 2012, 102: 11
[16]Melnyk A, Wolska L, Namiesnik J. J Chromatogr A, 2014, 1339: 1
[17]Ballesteros-Gómez A, Rubio S. Anal Chem, 2011, 84: 342
[18]Shi Z G, Lee H K. Anal Chem, 2010, 82: 1540
[19]Zhu J, Li M X, Wang Q, et al. Chinese Journal of Chromatography, 2016, 34(11): 1120
朱婧, 李明昕, 王倩, 等. 色谱, 2016, 34(11): 1120
[20]Khaledi M G, Jenkins S I, Liang S. Langmuir, 2013, 29(8): 2458
[21]Jenkins S I, Collins C M, Khaledi M G. Langmuir, 2016, 32: 2321
[22]Xu J, Li X, Li C, et al. Food Chem, 2018, 242: 122
[23]Xu J, Li Y F, Li C, et al. Anal Bioanal Chem, 2017, 409: 4559
[24]Xu J, Niu M L, Xiao Y X. Anal Bioanal Chem, 2017, 409: 1281
[25]Deng W W, Zong Y, Xiao Y X. ACS Sustain Chem Eng, 2017, 5: 426

