皮质下缺血性血管病患者血清ADMA变化及其对轻度认知损害的影响
倪明珠,余 锋,刘文灿,褚忠海,王兆平,王文静
随着全球人口的老龄化及与之伴随的血管性疾病的增多,预测未来30年内血管性认知损害(vascular cognitive impairment, VCI)患者数量会出现大幅度的增加[1]。其中皮质下缺血性血管病(subcortical ischemic vascular disease, SIVD)是其主要病因,且具有较高的同质性[2],近年来已成为国内外学者研究的热点。然而,SIVD的发病机制尚未完全明确[3]。研究[3-5]表明,内皮功能障碍可能在SIVD发病过程中具有重要作用。非对称性二甲基精氨酸(asymmetric dimethylarginine, ADMA)可通过减少一氧化氮(nitricoxide, NO)的生成导致内皮功能障碍,进而引起脑缺血和低灌注[6-7]。近年来有研究[7-9]显示ADMA与脑小血管病(cerebral small vessel disease, CSVD) 及记忆障碍、阿尔茨海默病(Alzeheimer’s, AD)关系密切,但关于SIVD患者血清ADMA水平与认知损害的关系鲜有报道。该研究旨在探讨SIVD患者血清ADMA水平及其对轻度认知损害的影响,以期为早期识别提供新的思路。
1 材料与方法
1.1病例资料
1.1.1SIVD组 收集2016年12月~2017年6月安徽医科大学附属省立医院神经内科住院和门诊SIVD患者116例,其中无认知损害(SIVD non-cognitive impairment, SNCI)组53例,轻度认知损害组(SIVD vascular mild cognitive impairment, SVaMCI)组63例。
SIVD纳入标准:① 年龄50~85岁;② 受教育程度≥8年;③ 头颅MRI检查提示皮质下腔隙性脑梗死(lacunar infarcts, LI)和脑白质病变(white matter lesions, WML)。影像学诊断参照Galluzzi et al[10]提出的标准。
排除标准:① 脑外伤、皮质梗死、脑出血史;② AD、帕金森病、路易体痴呆等其他引起认知损害的疾病;③ 非SIVD导致的脑白质病变,如代谢、多发性硬化、免疫等因素引起的非血管性脑白质病变;④ 严重的躯体或精神疾病。
SVaMCI诊断标准:参照《中国血管性轻度认知损害诊断指南》[11]提出的诊断标准并修改如下:① 符合SIVD纳入标准;② 患者或知情者证实认知功能较前轻度下降;③ 整体认知功能正常,记忆、语言、视空间、执行中≥1个认知领域受损的客观证据;③ 保持生活的独立性;④ 认知功能受损与脑血管病间具有相关性:认知损害发生在卒中后3个月内;或无脑血管事件发生,但存在执行功能、信息处理速度明显减退,且具早期尿路症状、早期步态异常、人格和性格改变特征之一;⑤ 无痴呆:不符合痴呆诊断标准。
SNCI诊断标准:① 符合SIVD纳入标准;② 认知功能测试正常。
1.1.2对照组 选取同期年龄、性别相匹配,头颅MRI未见明显异常、认知功能正常的58例体检者为对照组。
1.2方法
1.2.1一般临床资料采集 记录所有入选者的年龄、性别、受教育程度、吸烟史、饮酒史、高血压史、糖尿病史、肝肾疾病史等,收集空腹血糖、血脂、肝肾功能等指标。
1.2.2MRI评价 应用3.0 T MRI机(德国西门子公司)扫描,并依据头颅MRI T2、FLAIR成像对所有受试者脑损伤程度进行评估。依据Fazekas评分[12]将脑白质病变分为4级:0级(无白质病变);1级(斑点状病变);2级(病变开始融合);3级(融合成弥漫性病变)。LI数量:皮质下直径为3~15 mm、边界清楚的缺血性病灶。
1.2.3神经心理学评估 采用简易精神状态检查量表(mini-metal state examination, MMSE)、霍普金斯语言学习测试(hopkins verbal learning test, HVLT)、波士顿命名测试(boston naming test, BNT)、画钟测试(clock drawing test, CDT)、连线测试A(trail making test-A, TMT-A)、工具性日常生活能力量表(instrumental activities of daily living, IADL)分别对患者的整体认知状态和记忆、语言、视空间、执行、日常生活能力进行评估。汉密尔顿抑郁量表(17项) 评估抑郁状态。
1.2.4血标本的采集和检测 采集所有受试者清晨空腹静脉血4 ml,静置15 min,然后以3 000 r/min离心10 min,收集血清,于-80 ℃冰箱低温保存。应用酶联免疫吸附法测定血清ADMA浓度。操作方法严格按照试剂盒(上海源叶生物科技有限公司,批号:E201700501A)说明书进行。
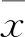
2 结果
2.1三组一般临床资料及血清ADMA水平、脑损害程度的比较SVaMC、SNCI组高血压比例、Fazekas评分显著高于对照组,差异有统计学意义(P<0.01);SVaMCI组受教育程度低于SNCI、对照组,差异有统计学意义(P<0.05);SVaMC、SNCI组LI数量、血清ADMA水平显著高于对照组,且SVaMCI组高于SNCI组,差异有统计学意义(P<0.01)。见表1。
2.2血清ADMA水平与脑损伤程度的相关分析血清ADMA水平与Fazekas评分(rs=0.208,P<0.05)及LI数量(rs=0.416,P<0.01)呈显著正相关性。
2.3三组神经心理学评分的比较SVaMCI组MMSE、HVLT、BNT、CDT评分显著低于SNCI组和对照组,差异有统计学意义(P<0.01);SVaMCI组TMT-A、IADL评分显著高于SNCI组和对照组,差异有统计学意义(P<0.05)。见表2。
2.4血清ADMA与认知功能评分的相关分析血清ADMA水平与MMSE(rs=-0.227,P<0.05)、CDT(rs=-0.364,P<0.01)、BNT(rs=-0.245,P<0.05)、HVLT(rs=-0.285,P<0.01)评分呈显著负相关性,与TMT-A(rs=0.293,P<0.01)评分呈显著正相关性。
2.5SIVD患者认知功能的多元线性回归分析将MMSE评分作为因变量,ADMA水平、性别、年龄、受教育年限、吸烟、高血压、糖尿病、LI数量、总胆固醇等作为自变量进行多元线性回归分析显示:在控制各项因素后,MMSE评分与ADMA水平存在显著相关性。在控制变量中添加白质病变分级后显示:ADMA水平与MMSE评分间无明显相关性,而白质病变分级与MMSE评分呈显著负相关性。在回归方程中,将男性赋值为“1”,女性赋值为“0”;是否高血压、糖尿病、吸烟,是赋值为“1”,否赋值为“0”。见表3。
3 讨论
SIVD是由小血管严重的狭窄和闭塞引起的以皮质下多灶性LI和白质缺血性病变为主要病理表现的脑小血管病,是导致VCI主要原因之一。SIVD通过对额叶-皮质下环路及丘脑-皮质环路的破坏最终可导致SIVD患者以执行功能障碍为主要特征的认知功能损害。除了认知功能损害,临床症状还可有偏瘫、吞咽困难、构音障碍、小步态、排尿障碍等[4-5]。

表1 三组一般临床资料及血清ADMA水平、脑损害程度比较
与SNCI组比较:*P<0.05;与对照组比较:#P<0.05;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇

表2 三组认知功能评分比较[M(QR)]
与SVaMC组比较:*P<0.05
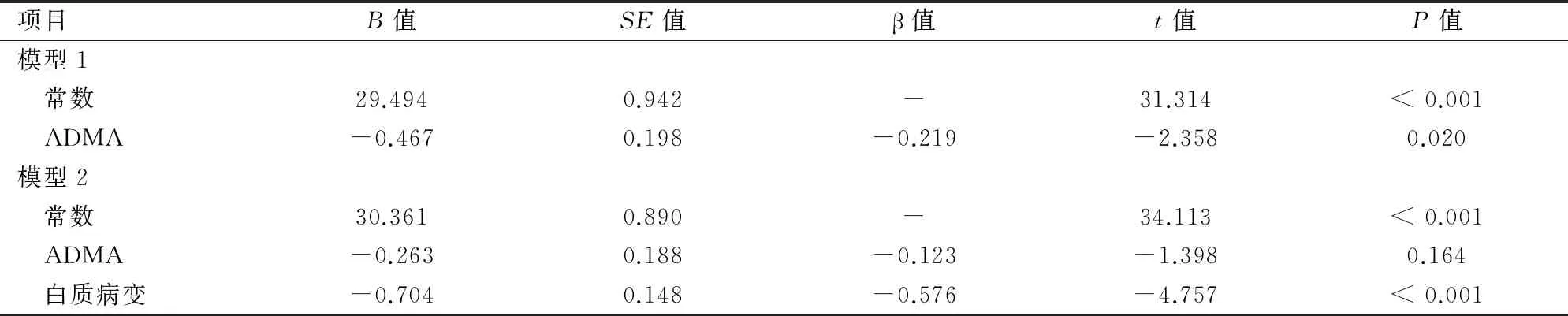
表3 SIVD认知功能损害及其影响因素相关分析
目前SIVD 的发病机制尚未阐明,除了与血管危险因素如年龄、高血压、糖尿病等有关[5],近年来内皮功能障碍在SIVD发病中的作用受到越来越多的关注。
ADMA是内皮型一氧化氮合酶抑制剂,通过与底物左旋精氨酸竞争性结合一氧化氮合酶活性部位,从而使NO生成减少,导致内皮功能障碍[3,6-7]。
近年有研究[4,13]证实,ADMA浓度的升高与CSVD有关。Pikula et al[9]对2013名社区人群研究发现,在校正年龄、性别及卒中危险因素后,血浆ADMA水平与亚临床脑梗死患病率的增加呈独立相关性。Khan et al[14]对症状性CSVD患者进行研究发现,在控制血管危险因素后,血浆ADMA水平为CSVD的独立危险因素,并且与WML严重程度呈正相关性。上述研究结果均不同程度的提示ADMA与SIVD密切相关。潜在的机制主要考虑如下:ADMA通过减少NO的生成,导致内皮功能障碍,从而引起小穿支动脉硬化、脑动脉收缩、脑血流调节功能受损、血栓形成,进而造成深部脑组织低灌注和缺血,最终表现为皮质下WML和(或) LI[3-6,9,14]。
本研究结果显示SIVD患者血清ADMA水平在三组间有显著差异,且随脑损伤程度的加重而升高,这与上述研究结果一致,进一步表明ADMA在SIVD发病过程中起到重要作用。
血清ADMA浓度是否会对SIVD患者认知功能障碍产生影响以及可能的机制目前仍不明确。本研究结果显示,对照人群、SNCI和SVaMCI患者血清ADMA浓度依次增高;ADMA水平与MMSE、HVLT等认知功能评分呈负相关性。在校正相关危险因素后分析显示,MMSE评分与ADMA的这种相关性仍然存在,但当进一步校正WML分级后,ADMA与认知功能评分间无明显相关性。因此本研究推测ADMA可能是通过WML进而介导认知功能损害。Gao et al[12]对CSVD患者进行研究表明,血浆ADMA水平与WML患者认知功能障碍有关。该研究推测由于ADMA使NO生成减少,引起脑血流下降、白质水肿和脱髓鞘病变以及β-淀粉样蛋白沉积,从而导致认知功能损害。Miralbell et al[13]对747例社区人群进行研究,在控制混杂因素后发现血浆ADMA水平增高与语言记忆受损有关,这提示内皮功能障碍可能在认知损害早期阶段(轻度认知损害)发挥作用。Yan et al[15]对血管性痴呆患者的研究表明,MMSE评分与WML严重程度呈负相关性,且ADMA水平的增加可导致WML严重程度的加重[14]。本研究结果与上述研究结果具有良好的一致性,进一步证实ADMA作为内皮功能障碍标志物参与了SIVD患者白质病变及轻度认知损害的过程。
ADMA对脑小血管病认知功能损害可能至少通过如下两个机制:① 导致SIVD的发病[3-8],皮质下白质病变和腔隙性脑梗死引起认知功能损害;② NO生成减少导致神经保护的减少,进而促进Ca2+内流和细胞死亡;使两种具有神经保护作用的蛋白质即环磷腺苷效应元件结合蛋白和蛋白激酶B生成减少;使抗氧化分子胆红素生成减少[8]。
综上所述,SIVD患者血清ADMA浓度显著增高,且与脑白质病变、多发性腔隙性脑梗死的发生密切相关。血清ADMA与认知功能损害呈显著正相关性,将来或许可通过检测血清ADMA水平来早期识别SIVD及SIVD轻度认知损害,但尚需大样本、多中心研究进行验证。
[1] Rosenberg G A, Wallin A, Wardlaw J M, et al. Consensus statement for diagnosis of subcortical small vessel disease[J].J Cereb Blood Flow Metab, 2016, 36(1): 6-25.
[2] 褚忠海, 王文静, 韩丽珠. 皮质下缺血性脑血管病患者血清sICAM-1、IGF-1与认知损害的关系[J]. 安徽医科大学学报, 2016, 51(2): 268-71.
[3] Poggesi A, Pasi M, Pescini F, et al. Circulating biologic markers of endothelial dysfunction in cerebral small vessel disease: A review[J]. J Cereb Blood Flow Metab, 2016, 36(1): 72-94.
[4] Vilar-Bergua A, Riba-Llena I, Nafria C, et al. Blood and CSF biomarkers in brain subcortical ischemic vascular disease: Involved pathways and clinical applicability[J]. J Cereb Blood Flow Meta,2016,36(1):55-71.
[5] Roh J H, Lee J H. Recent updates on subcortical ischemic vascular dementia[J]. J stroke, 2014, 16(1): 18-26.
[6] Hu X, De Silva T M, Chen J, et al. Cerebral vascular disease and neurovascular injury in ischemic stroke[J]. Circ Res, 2017,120(3):449-71.
[7] McEvoy M, Schofield P, Smith W,et al.Memory impairment is associated with serum methylarginines in older adults[J]. Curr Alzheimer Res,2014,11(1):97-106.
[8] Asif M, Soiza R L, McEvoy M, et al. Asymmetric dimethylarginine: a possible link between vascular disease and dementia[J]. Curr Alzheimer Res,2013,10(4):347-56.
[9] Pikula A, Böger R H, Beiser A S, et al. Association of plasma ADMA levels with MRI markers of vascular brain injury:Framiingham offspring study[J]. Stroke, 2009, 40(9): 2959-64.
[10] Galluzzi S, Sheu C F, Zanetti O, et al. Distinctive clinical features of mild cognitive impairment with subcortical cerebrovascular disease[J]. Dement Geriatr Cogn Disord, 2005, 19(4):196-203.
[11] 田金洲, 解恒革, 秦 斌, 等. 中国血管性轻度认知损害诊断指南[J].中华内科杂志, 2016, 55(3): 249-56.
[12] Gao Q, Fan Y, Mu L Y, et al. S100B and ADMA in cerebral small vessel disease and cognitive dysfunction[J]. J Neurol Sci, 2015, 354(1-2): 27-32.
[13] Miralbell J, López-Cancio E, López-Oloriz J, et al. Cognitive patterns in relation to biomarkers of cerebrovascular disease and vascular risk factors[J]. Cerebrovasc Dis, 2013, 36(2): 98-105.
[14] Khan U, Hassan A, Vallance P, et al. Asymmetric dimethylarginine in cerebral small vessel disease[J]. Stroke, 2007, 38(2): 411-3.
[15] Yan T, Yu J R, Zhang Y P, et al. Analysis on correlation of white matter lesion and lacunar infarction with vascular cognitive impairment[J]. Int J Clin Exp Med, 2015, 8(8): 14119-22.

