缺硼对脐橙幼苗硼分配及叶片细胞壁组分硼含量的影响
刘桂东,胡 萍,张婧卉,周高峰,曾 钰,钟八莲,姜存仓*
(1 赣南师范大学生命与环境科学学院/国家脐橙工程技术研究中心,江西赣州 341000;2 华中农业大学微量元素研究中心,湖北武汉 430070)
硼 (B) 是植物必需的微量元素之一,是细胞壁和细胞膜的组成成分,对植物生长点 (根尖和茎尖) 的生长、营养物质运输和代谢、生殖生长等具有重要作用,这些作用与植物缺硼症状表现直接相关[1-3]。脐橙缺硼后易发生叶片黄化、落果等症状[4-5],采取土施硼肥的方式,满足脐橙壮根、叶片生长与果实发育对硼的需要,对于缓解叶片黄化进而促进脐橙增产效果显著[4]。然而,目前对于脐橙缺硼症状产生原因及施硼增产机理尚不明确,因此需要进一步开展脐橙硼营养机理研究。
硼与植物细胞壁的关系一直是硼营养机理研究的热点,硼主要作用于细胞壁,有研究表明细胞中的硼80%以上存在于细胞壁中,硼对细胞壁的结构和功能有重要影响[6]。硼在细胞壁中以硼酸盐二酯键交联果胶多糖的两条RG-II(鼠李半乳糖醛酸聚糖II)链,形成B-RG-II复合物[7-9]。而且,这种复合物的形成发生在细胞壁多糖合成和分泌的过程中而不是分泌后[10]。利用拟南芥突变体进一步证实B-RG-II复合物对于维持植物的正常生长是必需的[3]。已有研究表明,细胞壁的生物化学修饰如细胞壁多糖的数量和分子大小的改变很可能参与了细胞壁伸展性的调节[11-12]。而细胞壁的机械伸展性及细胞壁多糖分子量在应答环境胁迫时发生改变这一现象在多种植物中都有报道[13]。前期结果表明,缺硼后脐橙叶片细胞壁的组分和结构都发生显著变化,且与缺硼程度有关[14],但是不同缺硼程度脐橙叶片细胞壁各组分中硼含量是如何变化的并不清楚。
植物中的硼一般以水溶性硼和水不溶性硼两种形态存在[15-16]。水不溶性硼主要包括与细胞壁紧密结合的那部分硼,而水溶性硼则主要存在于细胞内和质外体中[16]。在柑橘叶片中也包括这两部分硼,但不同形态硼含量及其相对分配则与外界供硼水平有关[5]。由于硼是维持细胞壁结构完整性所必需的[3],因此许多植物中细胞壁硼的相对比例在缺硼条件下显著增加[17-18]。而且,缺硼条件下往细胞壁分配更高比例的硼也是硼高效品种的表现之一[17,19]。另外,缺硼条件下硼往细胞壁的分配能力以及果胶组分的变化对于是否表现出可见的缺硼症状具有决定作用[19]。然而,到目前为止对于脐橙不同部位叶片缺硼后的表现差异是否与硼的分配模式有关并不清楚。
因此,在前期证实缺硼严重的脐橙叶片细胞壁结构改变程度也更大的基础上,本研究以纽荷尔脐橙幼苗为试验材料,分析缺硼与不同部位叶片硼分配模式和细胞壁结构变化之间的关系,明确缺硼症状表现及细胞壁结构变化与细胞壁各组分中硼含量变化间的相关性。研究结果对于理解硼在脐橙中的生理作用进而解决柑橘类果树缺硼问题具有一定的参考意义。
1 材料与方法
1.1 试验材料
从赣州市江口无病毒苗圃基地选取生长一致的纽荷尔脐橙 (Citrus sinensis Osbeck ‘Newhall’) 幼苗为试材,砧木为枳橙[C. sinensis (L.) Osb. × Poncirus trifoliata (L.) Raf.]。本试验中所选取的幼苗砧木茎粗为6~7 mm,植株高度18~22 cm,单株总鲜重20~25 g,仅有一个抽梢,叶片数12~15片,在试验开始时这些叶片都还没有完全展开。
1.2 试验步骤
将全部幼苗浸泡在自来水中饥饿处理2 d,用去离子水将根系冲洗干净,移入盛有8 L营养液的塑料桶中,试验所用的塑料桶,使用前先用稀盐酸浸泡,然后用去离子水冲洗干净。营养液配方参考Hoagland和Arnon配方[20],营养液组成:1 mmol/L KNO3、1.23 mmol/L Ca(NO3)2、0.5 mmol/L MgSO4、0.07 mmol/L Na2HPO4、0.16 mmol/L NaH2PO4、4.45 μmol/L MnCl2、0.8 μmol/L ZnSO4、0.16 μmol/L CuSO4、0.18 μmol/L Na2MoO4、28.7 μmol/L EDTAFe。将所有植株在1/2当量完全营养液中先预培养1周,并供应10 μmol/L H3BO3。随后,营养液变为正常浓度,一半植株供应20 μmol/L H3BO3作为硼充足供应的对照处理 (+B),另一半植株停止供硼作为缺硼处理 (-B),每个处理9次重复,每个重复1株幼苗。营养液每7 d更换1次,每隔2 h通气20 min,每天测定营养液pH值,用NaOH或HCl调节使之维持在5.8~6.2之间。所用试剂为分析纯,利用纯水系统所制的水电导率低于0.06 μS/cm(硼含量低于0.5 μmol/L)。试验在华中农业大学盆栽场自然光照条件下进行。
1.3 植株取样及硼含量测定
开始进行硼处理后10~15天,所有的纽荷尔脐橙幼苗开始抽新梢,抹掉多余的新梢,每株小苗只保留一个新抽梢。该试验不同硼处理的植株培养9周后结束,此时所有的叶片都已完全展开。取样时,将试验开始之前存在的叶片定义为下部叶,而将试验开始之后新形成的叶片定义为上部叶,下部叶和上部叶分开取样,将植株剩余的部分再按根、砧木茎和接穗茎分开取样。在70℃烘箱中烘干,烘干磨碎的样品500℃干灰化4 h,用0.1 mol/L的HCl溶解后,采用姜黄素比色法测定各部位硼含量。
1.4 叶片中不同形态硼与粗细胞壁的提取
提取方法参照Hu和Brown的方法[18],将剪碎的叶片在10倍体积的冰水中匀浆,然后1000× g离心10 min,收集上清液,残渣再用10倍体积的冰水冲洗再离心,合并这两次的上清液,测定其中的硼含量作为水溶性硼含量 (主要指存在于自由空间中的硼);残渣用10倍体积的80%乙醇冲洗3次,然后用10倍体积的甲醇-氯仿 (体积比1∶1) 混合物冲洗1次,最后用10倍体积丙酮冲洗,上述有机试剂浸提的主要是细胞的原生质体,因此有机试剂提取的这部分硼定义为原生质体硼;最后剩下的不溶性残渣即为粗细胞壁,将其烘干并称重。将提取的粗细胞壁分成两部分:一部分进行干灰化,姜黄素比色测定细胞壁硼含量;另一部分用于提取细胞壁组分。
1.5 细胞壁各组分提取及硼含量的测定
细胞壁多糖组分的提取参考Redgwell和Selvendran[21]的方法,略有改动。称取上述提取的粗细胞壁200 mg左右,加入20 mL 50 mmol/L醋酸钠缓冲液(内含50 mmol/L的CDTA,pH 6.5),室温下振荡提取8 h后5000× g离心10 min,收集上清液,残渣用10 mL双蒸水冲洗一次,合并这两次上清液即为CDTA可溶性果胶组分,这部分果胶称为离子结合态果胶;往CDTA不溶性残渣中加入20 mL 50 mmol/L碳酸钠溶液,室温下静置过夜后再振荡提取3 h,离心并收集上清液,残渣用10 mL去离子水冲洗一次,合并这两次上清液即为Na2CO3可溶性果胶组分,这部分果胶称为共价结合态果胶;剩下的残渣加入20 mL 4 mol/L氢氧化钾溶液室温下振荡提取3 h,离心并收集上清液,残渣用10 mL双蒸水冲洗一次,合并这两次上清液即为KOH可溶性组分,这部分组分主要是半纤维素;最后剩下的残渣则主要是纤维素。
取CDTA可溶性组分和Na2CO3可溶性组分各10 mL于15 mL的瓷坩埚中,在电炉上蒸干,然后用5 mL 0.5 mol/L的HCl溶解浸提2 h,定量滤纸过滤,滤液用姜黄素比色法测定硼含量,分别计算离子结合态果胶和共价结合态果胶中的硼含量;取粗细胞壁和提取多糖组分后的残渣进行干灰化,0.1 mol/L的HCl溶解后,姜黄素比色法测定硼含量,分别计算细胞壁总硼含量和纤维素中硼含量;最后用细胞壁总硼含量减去离子结合态果胶、共价结合态果胶和纤维素中硼含量即为半纤维素 (KOH可溶性组分) 中的硼含量。
1.6 统计分析
所有数据均用SAS 8.1 (SAS Institute,Cary,NC,USA) 软件进行统计分析,干重、鲜重、各部位硼含量和吸收量数据为9个单独植株 (重复) 的平均值,其他生理指标的结果为3次独立试验的平均值,干重、鲜重、各部位硼含量和吸收量硼处理之间的比较用独立样本T检验,同一形态硼含量叶片部位及处理的比较用one-way ANOVA过程的邓肯法进行,显著水平为P < 0.05。
2 结果与分析
2.1 硼对脐橙幼苗生长的影响
缺硼处理9周的脐橙根系生长受到明显的抑制,在培养期间没有任何的新根形成。叶片卷曲及叶片失绿等症状只出现在缺硼植株的上部叶,而下部叶没有出现任何可见的症状。与此现象一致,缺硼植株上部叶的相对叶绿素含量 (46.5) 仅为加硼处理的 (80.1)58.1%,而下部叶的相对叶绿素含量 (77.0)与加硼处理的 (79.0) 相比则无明显差异 (SPAD仪测定数据)。另外,就缺硼对干物质形成的影响程度而言,根系受缺硼的影响程度要明显大于叶片所受到的影响。缺硼显著降低了脐橙幼苗根干重,而上部叶和下部叶的干物重在缺硼与加硼处理之间都没有显著的差异 (表1)。虽然缺硼上部叶和下部叶的鲜重比加硼处理的有所下降,但仍没有达到统计学上的显著差异。结合其它部位鲜重和干重在缺硼条件下降低的程度,可以发现同一部位鲜重降低的程度远远大于干重降低的程度,说明缺硼导致纽荷尔脐橙各部位含水率明显地降低 (表1)。
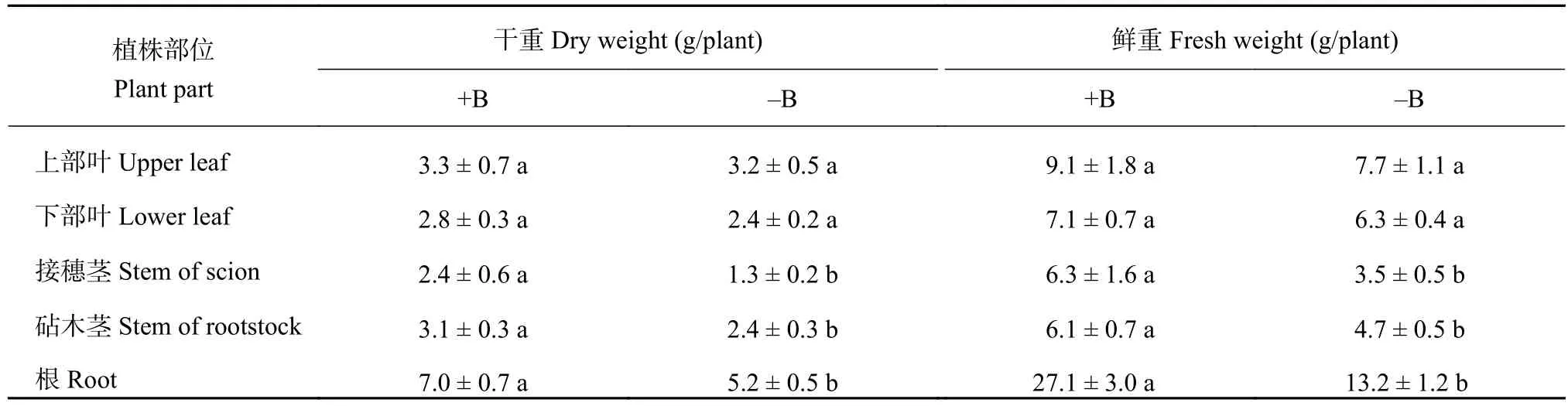
表1 缺硼对脐橙幼苗各部分干重和鲜重的影响Table 1 Effect of B deficiency on the dry and fresh weight in different parts of navel orange plants
2.2 缺硼对脐橙幼苗各部分硼含量、硼吸收量和硼分配的影响
缺硼处理的脐橙幼苗各部位硼含量均显著降低,且叶片降低的程度显著高于其他部位 (表2)。加硼条件下,脐橙幼苗中叶片硼吸收量显著高于其他部位,是脐橙中硼积累的主要器官,但是缺硼以后上部叶和下部叶硼吸收量分别降低了92.1%和85.0%,降低程度显著高于根 (47.2%) 和砧木茎 (57.5%) 降低的程度。加硼处理的脐橙幼苗下部叶和上部叶硼吸收量没有显著差异,而缺硼处理的植株下部叶硼吸收量显著高于上部叶。本试验脐橙幼苗缺硼处理后,作为吸收硼并向地上部分运输器官的根,以及作为运输器官的砧木茎和接穗茎,其硼吸收量显著低于加硼处理,但三部分硼分配率之和却高达49.7%,而加硼处理仅为21.4%。另外,加硼处理的上部叶硼分配率为41.6%,而缺硼处理的仅为18.8%。上述结果说明,本试验中缺硼显著阻碍脐橙对硼的吸收和向叶片的运输且上部叶受到的影响程度更大。
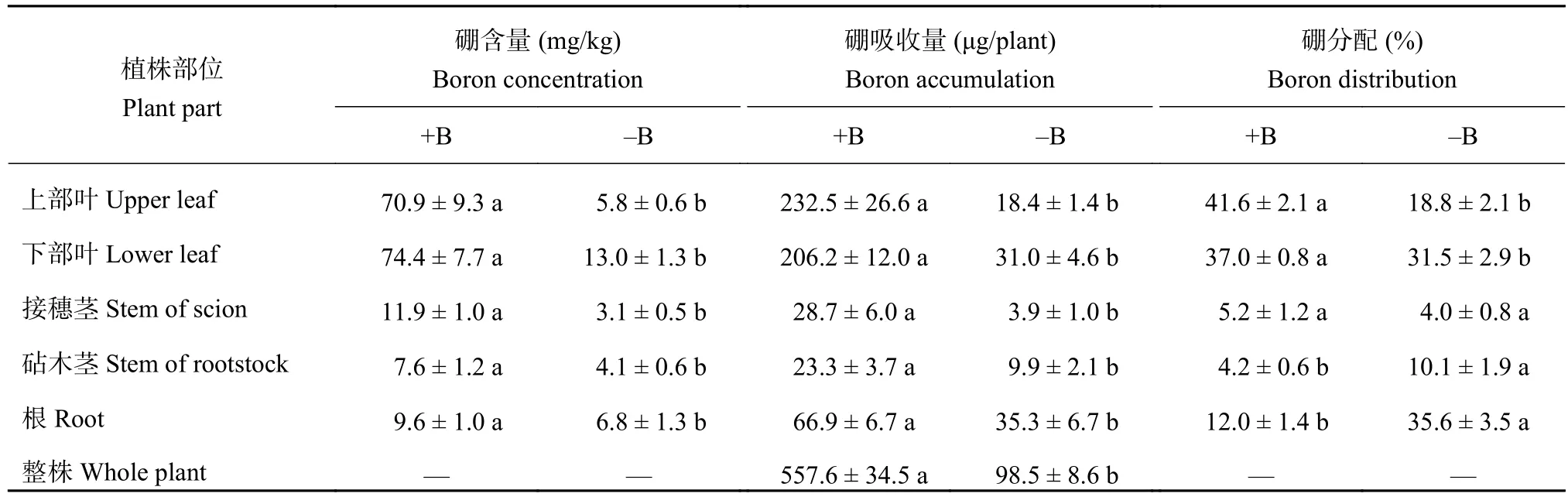
表2 缺硼脐橙幼苗各部分硼含量、硼吸收量和硼分配Table 2 B concentrationaccumulation and distribution in different parts of navel orange plants under B deficiency
2.3 缺硼对脐橙叶片细胞各组分硼含量的影响
与叶片中硼含量的变化趋势一致,缺硼后虽然上部叶和下部叶细胞壁硼含量都显著降低,但下部叶细胞壁硼含量明显高于上部叶细胞壁硼含量,说明下部叶细胞壁硼含量降低的程度也小于上部叶细胞壁的,一定程度上解释了为什么缺硼后上部叶出现可见的缺硼症状而下部叶没有出现可见症状 (表3)。在硼正常供应条件下,上部叶和下部叶之间不同形态硼 (游离态硼、原生质体硼和细胞壁硼) 所占的比例没有显著差异 (表3和表4),说明硼在不同类型脐橙叶片细胞各组分中的分配是相对稳定的。加硼处理的植株中,上部叶和下部叶细胞壁硼积累仅占细胞总硼的22%左右,而在缺硼植株中这一比例增加到80%以上 (表3),出现这一现象主要的原因在于非细胞壁硼含量在缺硼条件下极显著地降低 (表4)。上述结果说明,缺硼以后脐橙叶片细胞组分中的硼更多地分配于细胞壁。
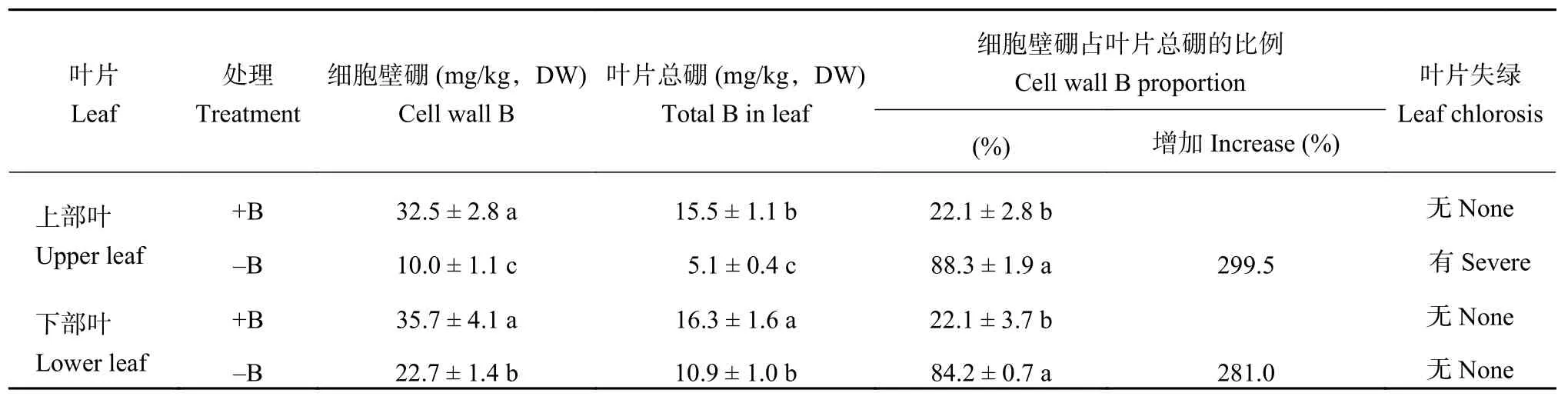
表3 缺硼对脐橙叶片细胞壁硼含量的影响Table 3 Effect of B deficiency on the B concentration of cell wall in navel orange leaves
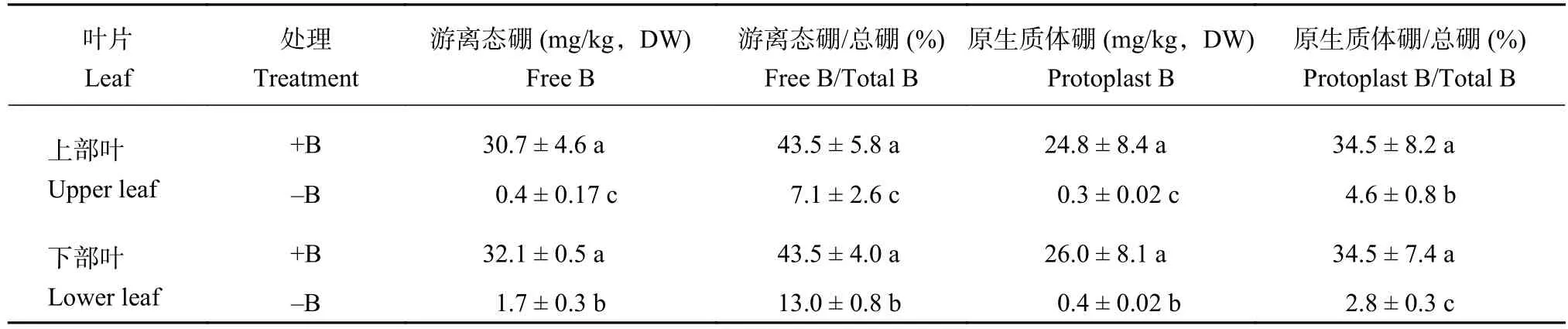
表4 缺硼脐橙叶片游离态硼和原生质体硼含量Table 4 Concentration of free B and protoplast B in navel orange leaves under B deficiency
2.4 缺硼对脐橙叶片细胞壁各组分硼含量的影响
图1显示,缺硼显著降低了上部叶细胞壁CDTA可溶性组分的硼含量,而下部叶细胞壁CDTA可溶性组分硼含量没有发生明显的变化。与加硼处理相比,缺硼植株上部叶和下部叶细胞壁Na2CO3可溶性组分和KOH可溶性组分的硼含量都显著下降。下部叶细胞壁残渣硼含量明显高于上部叶的,但是缺硼对这两种叶片细胞壁残渣硼含量的影响都不明显。考虑到硼在细胞壁中的重要作用以及上部叶和下部叶缺硼所表现出的症状差异,这些结果说明CDTA可溶性组分中硼含量的多少在很大程度上影响着细胞壁结构的状态。
图2表示细胞壁各组分硼含量的百分比,结果表明,大部分硼都结合在果胶中,而且离子结合态果胶 (CDTA可溶性组分) 中硼的比例大于共价结合态果胶 (Na2CO3可溶性组分) 中的比例。纤维素和半纤维素中硼相对含量的变化存在差异,缺硼后上部叶和下部叶中半纤维素硼所占的比例都下降而纤维素硼所占的比例都增加。另外,缺硼后离子结合态果胶硼所占的比例在上部叶中略有下降而在下部叶中显著增加,总果胶硼所占的比例同样在下部叶中有所增加。
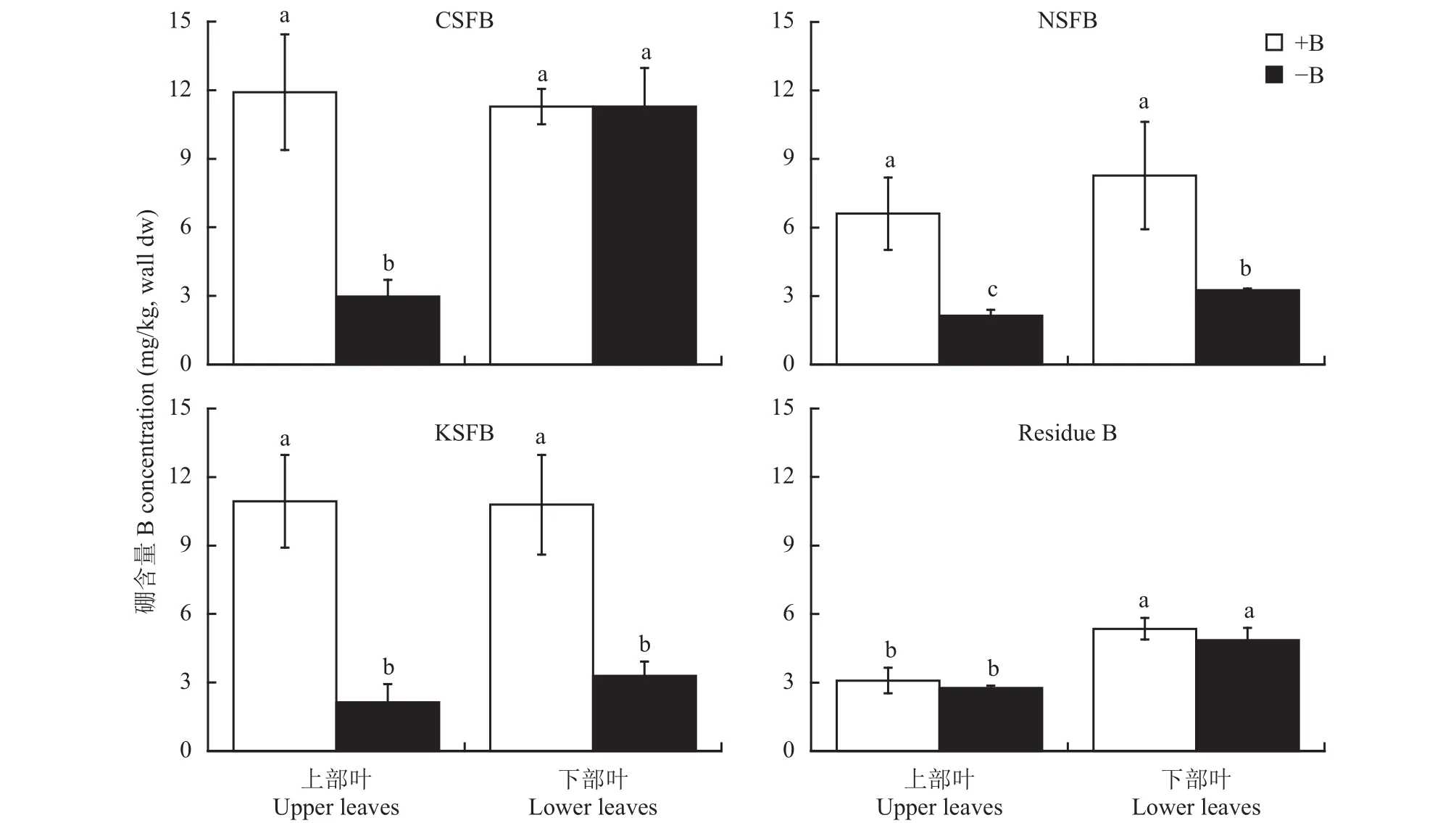
图1 缺硼脐橙叶片细胞壁中各组分硼含量Fig. 1 Concentration of B in extracts of cell wall in navel orange leaves under B deficiency

图2 缺硼对脐橙叶片细胞壁各组分硼相对含量的影响Fig. 2 Effect of B deficiency on the relative concentration of B in extracts of cell wall preparations in navel orange leaves
3 讨论
3.1 缺硼对脐橙叶片硼含量、吸收量及分配的影响
本试验结果表明,正常条件下叶是脐橙各组织中硼含量最高的部位,也是硼积累的主要部位 (表2)。而缺硼减少了地上部分尤其是叶片部分硼的相对比例而增加了根系部分硼的相对比例,说明缺硼条件下硼由根系往地上部分的转运受到抑制。这和笔者前期的结果[5]以及在挪威云杉和油菜中的研究结果是一致的[22-23]。这种现象的发生可能是因为缺硼影响了植物中具有疏导能力的维管组织的结构[24]。
本试验中所选脐橙幼苗在缺硼处理前是在正常硼营养条件下培养,下部叶已吸收了一定量的硼,到开展试验后才处于缺硼处理,而上部叶是在缺硼条件下生长,一定程度上造成上部叶更缺硼的可能。另外,虽然上部叶是在处理后形成的,但在加硼条件下,本试验结束时上部叶和下部叶的硼含量和硼吸收量已没有显著差异 (表2),说明上部叶硼的相对吸收速率高于下部叶。这和我们前期利用10B同位素进行吸收试验的结果是一致的,即脐橙幼苗从营养液中新吸收的硼都是新叶中的高于老叶中的[25]。然而,缺硼处理以后,硼向上部叶的运输受到明显的抑制,硼的吸收量远低于下部叶,因此导致上部叶表现出明显的叶片黄化症状 (表3)。
3.2 缺硼后硼在脐橙叶片细胞各组分中的相对比例变化
缺硼处理的上部叶与加硼处理的相比硼含量下降了91.8%,而下部叶的下降了82.5%;上部叶和下部叶细胞壁的硼含量则分别比加硼处理的下降了67.1%和33.1%(表2和表3)。可以看出缺硼使细胞壁硼含量下降的程度明显低于叶片硼含量下降的程度,说明细胞壁硼含量受外界硼浓度的影响程度显著低于相应的器官。由于硼在细胞壁中的结构作用,使得缺硼后细胞中的硼会优先供应细胞壁,从而维持细胞壁的正常结构。细胞壁硼占总硼的比例由硼正常供应条件下的22%左右增加到缺硼条件下的接近90%(表3),说明脐橙中硼的结合位点主要在细胞壁。这与其他作物中的研究结果一致[10,17]。
另外,下部叶及其细胞壁硼含量下降的程度明显低于上部叶及其细胞壁硼含量下降的程度。这可能是由于本研究中的上部叶在试验开始时还没有形成,下部叶已经存在但没有完全展开,所以下部叶在试验开始之前已经积累了一部分硼。本试验中叶片黄化、叶脉胀裂等症状只出现在缺硼处理的上部叶,而下部叶没有任何可见的症状 (表3),这种现象或许与硼含量下降的程度 (表2) 及细胞壁结构改变程度不同有关[14]。在本研究中,缺硼后水溶性硼 (包括游离态硼和原生质体硼) 在脐橙上部叶和下部叶中都降到极低的水平,尤其是原生质体硼的百分含量下部叶甚至是低于上部叶的 (表4),说明原生质体硼含量的高低并不是决定缺硼症状的主要因素,而是缺硼后细胞壁的硼结合能力决定了植物对缺硼的耐受性。
3.3 缺硼对细胞壁组分硼含量的影响及其与细胞壁结构间的关系
缺硼处理后,单位细胞壁的半纤维素硼含量显著下降,纤维素硼含量不变 (图1),而单位细胞壁中半纤维素和纤维素的相对含量在缺硼条件下是显著增加的[14],说明单位纤维素或半纤维素中硼含量缺硼后是显著下降的。单位细胞壁中共价结合态果胶相对含量[14]和共价结合态果胶硼含量 (图1) 在上部叶和下部叶中的变化趋势非常一致,说明这部分果胶含量和硼含量之间的关系是非常密切的。但到底是由于缺硼直接引起的共价结合态果胶含量降低,还是由于缺硼的次生反应引起共价结合态果胶含量的降低从而使得这部分果胶结合的硼减少,两者之间具体的变化关系目前还不能确定。前期研究结果表明,单位细胞壁中离子结合态果胶相对含量在上部叶和下部叶的缺硼与加硼处理之间都没有显著差异[14],但是离子结合态果胶硼含量缺硼后上部叶明显降低而下部叶没有明显降低。考虑到硼在果胶中的结构作用[3],并结合细胞壁其他组分硼含量的变化情况(图1) 及上部叶和下部叶的缺硼症状表现,我们推测离子结合态果胶含量及其结合硼的能力对缺硼条件下细胞壁的结构[14]及缺硼症状表现起着至关重要的作用。而前期对于缺硼敏感性存在显著差异的两种砧木苗的研究结果也进一步支持了我们的这一推测,缺硼35天后枳橙幼苗没有任何可见的症状出现而枳壳幼苗出现叶片黄化及生长抑制等现象,通过测定两种砧木苗的果胶组成发现,枳橙的离子结合态果胶含量缺硼后增加而枳壳的没有变化,进一步分析细胞壁硼含量表明枳橙的细胞壁硼含量缺硼后增加而枳壳的却减少[19]。同样,在硼高效的油菜品种上部叶中离子结合态果胶含量要高于硼低效品种的[26]。综上所述,离子结合态果胶含量及其与硼的结合能力在缺硼条件下对于维持细胞壁的结构具有重要的作用。
参 考 文 献:
[1]Voxeur A, Fry S C. Glycosylinositol phosphorylceramides from Rosa cell cultures are boron-bridged in the plasma membrane and form complexes with rhamnogalacturonan II[J]. The Plant Journal, 2014,79: 139-149.
[2]Brown P H, Bellaloui N, Wimmer M A, et al. Boron in plant biology[J]. Plant Biology, 2002, 4: 205-223.
[3]O’Neill M A, Eberhard S, Albersheim P, et al. Requirement of borate cross-linking of cell wall rhamnogalacturonan II for Arabidopsis growth[J]. Science, 2001, 294: 846-849.
[4]姜存仓, 王运华, 刘桂东, 等. 赣南脐橙叶片黄化及施硼效应研究[J]. 植物营养与肥料学报, 2009, 15(3): 656-661.Jiang C C, Wang Y H, Liu G D, et al. Effect of boron on the leaves etiolation and fruit fallen of Newhall navel orange[J]. Plant Nutrition and Fertilizer Science, 2009, 15(3): 656-661.
[5]Liu G D, Jiang C C, Wang Y H. Distribution of boron and its forms in young ‘Newhall’ navel orange (Citrus sinensis Osb.) plants grafted on two rootstocks in response to deficient and excessive boron[J].Soil Science and Plant Nutrition, 2011, 57: 93-104.
[6]Matoh T, Ishigaki K, Ohno K, et al. Isolation and characterization of a boron-polysaccharide complex from radish roots[J]. Plant and Cell Physiology, 1993, 34: 639-642.
[7]Kobayashi M, Matoh T, Azuma J. Two chains of rhamnogalacturonan II are cross-linked by borate-diol ester bonds in higher plant cell walls[J]. Plant Physiology, 1996, 110: 1017-1020.
[8]O’Neill M A, Warrenfeltz D, Kates K, et al. Rhamnogalacturonan-II,a pectic polysaccharide in the walls of growing plant cell, forms a dimer that is covalently cross-linked by a borate ester[J]. The Journal of Biological Chemistry, 1996, 271: 22923-22930.
[9]Ishii T, Matsunaga T, Pellerin P, et al. The plant cell wall polysaccharide rhamnogalacturonan II self-assembles into a covalently cross-linked dimer[J]. The Journal of Biological Chemistry, 1999, 274: 13098-13104.
[10]Chormova D, Messenger D J, Fry S C. Boron bridging of rhamnogalacturonan-II, monitored by gel electrophoresis, occurs during polysaccharide synthesis and secretion but not postsecretion[J]. The Plant Journal, 2014, 77: 534-546.
[11]Kaku T, Tabuchi A, Wakabayashi K, et al. Action of xyloglucan hydrolase within the native cell wall architecture and its effect on cell wall extensibility in azuki bean epicotyls[J]. Plant and Cell Physiology, 2002, 43: 21-26.
[12]Sakurai N. Cell wall functions in growth and development, a physical and a chemical point of view[J]. Curtis's Botanical Magazine, 1991,104: 235-251.
[13]Hoson T. Apoplast as the site of response to environmental signals[J].Journal of Plant Research, 1998, 111: 167-177.
[14]Liu G D, Dong X C, Liu L C, et al. Boron deficiency is correlated with changes in cell wall structure that lead to growth defects in the leaves of navel orange plants[J]. Scientia Horticulturae, 2014, 176:54-62.
[15]Goldbach H E, Wimmer M A, Findeklee P. Discussion paper: Boron-How can the critical level be defined?[J]. Journal of Plant Nutrition and Soil Science, 2000, 163: 115-121.
[16]Dannel F, Pfeffer H, Römheld V. Compartmentation of boron in roots and leaves of sunflower as affected by boron supply[J]. Journal of Plant Physiology, 1998, 153: 615-622.
[17]Pan Y, Wang Z H, Yang L, et al. Differences in cell wall components and allocation of boron to cell walls confer variations in sensitivities of Brassica napus cultivars to boron deficiency[J]. Plant and Soil,2012, 354: 383-394.
[18]Hu H, Brown P H. Localization of boron in cell walls of squash and tobacco and its association with pectin (Evidence for a structural role of boron in the cell wall)[J]. Plant Physiology, 1994, 105: 681-689.
[19]Liu G D, Wang R D, Liu L C, et al. Cellular boron allocation and pectin composition in two citrus rootstock seedlings differing in boron-deficiency response[J]. Plant and Soil, 2013, 370: 555-565.
[20]Hoagland D R, Arnon D I. The water-culture method for growing plants without soil[J]. California Agricultural Experiment Station Circular, 1950, 347: 1-32.
[21]Redgwell R J, Selvendran R R. Structural features of cell-wall polysaccharides of onion Allium cepa[J]. Carbohydrate Research,1986, 157: 183-199.
[22]Möttönen M, Lehto T, Aphalo P J. Growth dynamics and mycorrhizas of Norway spruce (Picea abies) seedlings in relation to boron supply[J]. Trees, 2001, 15: 319-326.
[23]Asad A, Blamey F P C, Edwards D G. Dry matter production and boron concentration of vegetative and reproductive tissues of canola and sunflower plants grown in nutrition solution[J]. Plant and Soil,2002, 243(2): 243-252.
[24]Dong X C, Liu G D, Wu X W, et al. Different metabolite profile and metabolic pathway with leaves and roots in response to boron deficiency at the initial stage of citrus rootstock growth[J]. Plant Physiology and Biochemistry, 2016, 108: 121-131.
[25]Liu G D, Wang R D, Wu L S, et al. Boron distribution and mobility in navel orange grafted on citrange and trifoliate orange[J]. Plant and Soil, 2012, 360: 123-133.
[26]杨玉华, 王运华, 杜昌文, 等. 硼对不同硼效率甘蓝型油菜品种细胞壁组成的影响[J]. 植物营养与肥料学报, 2002, 8(3): 340-343.Yang Y H, Wang Y H, Du C W, et al. Study on the influence of B on cell wall components in different B efficiency rape cultivars[J]. Plant Nutrition and Fertilizer Science, 2002, 8(3): 340-343.

