血浆抗凝血酶Ⅲ和血清IL-6与降钙素原对判断克罗恩病活动性的临床价值
印中鹏,宋令雄,王苏梦,汪俊军,王 锋
0 引 言
克罗恩病是由于环境、遗传、感染等多种因素共同作用引发免疫功能紊乱后产生的一种慢性肉芽炎症性疾病,可发生于胃肠道的任意部位。患者肠道炎症反复发作,甚至出现肠道溃疡和全身症状,严重影响患者的健康和日常工作和生活,降低患者的生存质量。目前,克罗恩病辅助诊断以及病情动态监测常用的实验室指标主要包括白细胞计数(WBC)、C反应蛋白、血沉等传统炎症标志物,但其特异性和敏感性均不高[1]。血清白介素-6(IL-6)、降钙素原(PCT)是临床炎症反应性疾病诊断的重要指标,相对于传统的炎症指标,IL-6和PCT的敏感性和特异性更高。已有研究表明,炎症性肠道疾病患者外周血IL-6和PCT水平均明显升高[2],这提示IL-6和PCT可能用于其疾病活动性的预测[3]。血浆抗凝血酶Ⅲ(AT-Ⅲ)是体内主要的抗凝物质,新近研究发现AT-Ⅲ还具有明显的抗炎作用,有望成为炎症性疾病病情监测的新指标[4-5]。有研究表明AT-Ⅲ水平在炎症性肠病中降低,在活动期时降低更明显[6]。因此,同时检测克罗恩病患者体内相关凝血因子和炎症因子的水平变化,将有助于临床该类疾病的早期诊断,为疾病的活动性评估提供新的途径与方法。本文通过检测克罗恩病患者血浆AT-Ⅲ活性和血清IL-6、PCT水平及相关性,探讨其在克罗恩病诊断和活动性评估中的临床价值。
1 资料与方法
1.1研究对象回顾性分析2015年2月至2016年10月本院普通外科住院的克罗恩病患者62例,纳入标准:患者均经临床病理学和内镜检查,参照《2010年世界胃肠病学组织关于炎症性肠病诊断和治疗的实践指南》[7]。排除标准:临床资料不全、合并其他感染性疾病或全身感染、合并免疫功能障碍、糖尿病、严重心脏疾病或肝脏疾病患者。采用克罗恩病活动指数(Crohn’s disease activity index,CDAI)评价患者的疾病活动性,分值越高,疾病活动性越强,其中CDAI<150分为缓解期,150分≤CDAI≤450分为活动期,CDAI>450分为极严重[8-9]。克罗恩病患者中男41例,女21例,年龄(49.7±15.3)岁,根据CDAI分为两个亚组:活动组(32例)和缓解组(30例)。对照组为同期来本院体检者30例,其中男19例,女11例,年龄(46.3±16.1)岁,均为无心肝肾疾病及感染性疾病的健康人。克罗恩病患者与健康对照组患者的年龄和性别差异无统计学意义(P>0.05)。
1.2试剂和仪器克罗恩病患者入院后采集血样样本,血液样本分别采用分离胶管和枸橼酸钠抗凝管采集,血清样本3000 r/min分离后保存于-70℃。
1.3方法血浆AT-Ⅲ通过凝血分析仪检测(CS5100 希森美康公司,日本);血清IL-6和PCT均采用电化学发光法检测(Roche e601罗氏公司,德国) ;高敏C反应蛋白(hs-CRP)采用免疫比浊法测定(Delta特种蛋白分析仪 希亚克公司,意大利)。
2 结 果
2.1克罗恩病患者与健康对照者血浆AT-Ⅲ和血清PCT、IL-6以及hs-CRP的比较克罗恩病患者血浆AT-Ⅲ活性显著下降(P<0.001);血清IL-6水平显著升高(P<0.001);血清PCT水平显著下降(P<0.01); hs-CRP水平也有明显降低(P<0.001)。见表1。
表1克罗恩病患者与健康对照组血浆AT-Ⅲ和血清IL-6、PCT、hs-CRP水平的比较
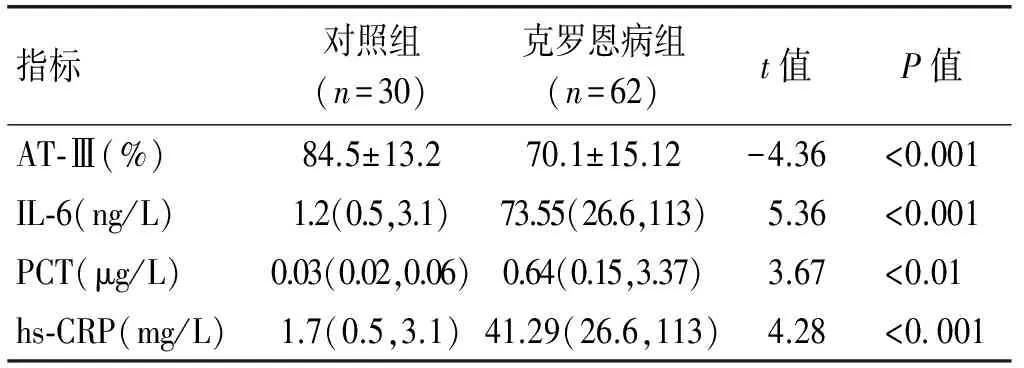
指标对照组(n=30)克罗恩病组(n=62)t值P值AT⁃Ⅲ(%)84.5±13.270.1±15.12-4.36<0.001IL⁃6(ng/L)1.2(0.5,3.1)73.55(26.6,113)5.36<0.001PCT(μg/L)0.03(0.02,0.06)0.64(0.15,3.37)3.67<0.01hs⁃CRP(mg/L)1.7(0.5,3.1)41.29(26.6,113)4.28<0 001
2.2克罗恩病患者活动组和缓解组血浆AT-Ⅲ和血清IL-6、PCT水平的比较与克罗恩病患者缓解组相比,活动组血浆AT-Ⅲ活性显著下降(P<0.001),血清IL-6水平显著升高(P<0.001),同时,活动组的血清PCT水平(P=0.011)以及hs-CRP水平(P<0.01)也显著升高。见表2。
表2克罗恩病患者活动组和缓解组血浆AT-Ⅲ和血清IL-6、PCT水平的比较
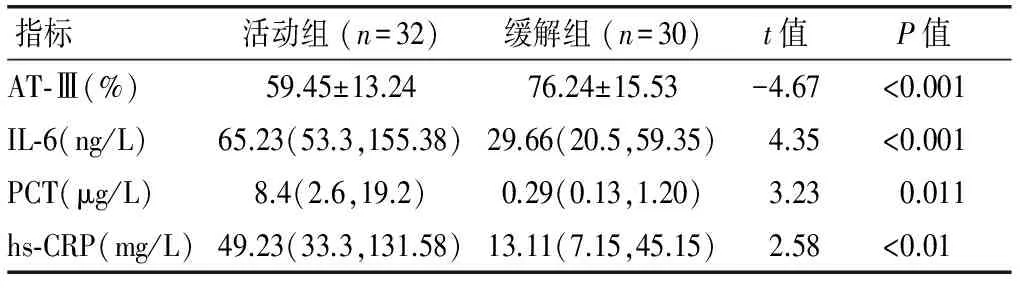
指标活动组(n=32)缓解组(n=30)t值P值AT⁃Ⅲ(%)59.45±13.2476.24±15.53-4.67<0.001IL⁃6(ng/L)65.23(53.3,155.38)29.66(20.5,59.35)4.35<0.001PCT(μg/L)8.4(2.6,19.2)0.29(0.13,1.20)3.230.011hs⁃CRP(mg/L)49.23(33.3,131.58)13.11(7.15,45.15)2.58<0.01
2.3克罗恩病患者血浆AT-Ⅲ活性与血清PCT、IL-6水平的相关性分析Spearman相关性分析结果显示,活动组AT-Ⅲ活性与IL-6、PCT、hs-CRP均呈显著负相关(P<0.05);缓解组AT-Ⅲ活性则与IL-6、PCT呈显著负相关(P<0.05)。见表3。
表3不同炎症反应期克罗恩病患者血浆AT-Ⅲ活性与血清IL-6水平的相关性分析

项目IL⁃6PCThs⁃CRPr值P值r值P值r值P值活动组AT⁃Ⅲ-0.3890.002-0.3170.009-0.2690.035缓解组AT⁃Ⅲ-0.3080.004-0.2790.021-0.1480.599
3 讨 论
克罗恩病属于慢性非特异性肉芽肿性疾病,原因不明,被认为是遗传、环境、感染等多种因素引发的肠道免疫功能低下和炎症病变。克罗恩病患者常可表现出腹痛、腹泻、肠梗阻等局部症状,也可出现发热、贫血、营养不良等全身症状,随着疾病发展,患者可出现管腔狭窄、穿孔等严重并发症,以及多脏器的损害,严重影响患者的健康状况,降低生存质量。因此,提高克罗恩病的诊治水平十分重要[7-9]。目前克罗恩病的治疗方法多样,但尚无有效的根治方法,患者常病情反复。因此,早期明确克罗恩病病情并及时采取相应的干预措施对改善其疗效具有重要意义[10]。
AT-Ⅲ由肝细胞产生,是体内主要的抗凝物质,反映机体抗凝系统功能。近年研究表明,AT-Ⅲ也与炎症反应相关,具有抗凝和抗炎的双重作用;临床研究证实,严重炎症性疾病患者在早期就可出现AT-Ⅲ的活性下降[11]。活动期克罗恩病患者血浆AT-Ⅲ活性会显著低于缓解期患者或者正常人血浆AT-Ⅲ活性。这可能与炎症反应时期,补体激活,凝血因子消耗,同时炎症反应激活内、外源性凝血途径,由此产生的凝血酶使AT-Ⅲ出现消耗性的下降[12],此外中性粒细胞增多,其活化后所释放的弹性酶亦可使AT-Ⅲ发生降解。炎症反应期,克罗恩患者血液常呈现高凝状态[13],肠道微血栓形成,进而引起肠黏膜坏死,促进溃疡形成。由于炎症反应的存在,克罗恩病患者的炎症-凝血平衡被打破,炎症物质导致凝血物质及凝血过程异常,凝血级联反应进而促进了炎症过程,并形成恶性循坏。
IL-6由T淋巴细胞和巨噬细胞产生,兼备促炎与抗炎两种生物学功能。一方面,IL-6 对机体多种细胞都具有较为普遍的促炎性作用,在急性炎症反应期能够直接参与到炎症损伤过程中[14]。IL-6能诱导中性粒细胞分泌和增殖,促使内皮细胞通透性增加,炎性细胞透过血管浸润至肠道黏膜,加重克罗恩病病情。另一方面,IL-6 参与机体免疫反应,诱导特异性抗体的产生,如IL-6 可以刺激浆细胞产生抗体,参与免疫应答,抑制炎症反应,这些机制与炎症性肠病的发生密切相关[15]。有研究证实[16],IL-6可渐进性加重结肠炎症,使克罗恩病患者并发瘘管、狭窄、穿孔等严重并发症,且克罗恩病活动期IL-6水平明显高于健康人群。有文献报道[17],克罗恩病患者病理活检标本中的IL-6 水平高于疾病对照组及正常对照组,与内镜下炎症分级呈正相关,这提示随着疾病活动性增加,IL-6 表达水平也逐渐上调,高水平的IL-6 与病情重、预后差有关,IL-6可能是一种重要的评估克罗恩病病情严重程度的细胞因子。
PCT主要由甲状腺C细胞分泌产生,当机体发生严重感染以及脓毒症和多器官功能衰竭时它在血浆中的水平升高。即使机体未发生细菌感染,炎症反应时期一些肠道释放细胞因子也可诱导PCT水平升高[18]。克罗恩病患者活动期易出现管腔狭窄、穿孔、多脏器的损害等并发症,更加容易发生感染,所以活动期无论是炎症反应,还是疾病并发感染均可使血清PCT有显著升高[19-21]。
本研究发现,克罗恩病患者的血浆AT-Ⅲ水平显著降低,IL-6和PCT水平显著升高。进一步研究发现,活动组患者 AT-Ⅲ水平更低,而IL-6和PCT水平则更高。AT-Ⅲ、IL-6和PCT均是敏感和特异的炎症指标,并且在以往的研究中被证实可以在凝血和炎症两个系统反应克罗恩病的严重程度,因此AT-Ⅲ、IL-6和PCT联合评估克罗恩病患者的病情有着重要的指导意义。相关性分析显示,在克罗恩病活动组和缓解组中,AT-Ⅲ与IL-6、PCT存在显著负相关,并且在活动组中负相关性更高,表明随着病情严重程度的进展,炎症和凝血异常的相关性更加明显,进一步证明,凝血功能异常与炎症反应互相依赖,互相强化,形成恶性循环。综上所述,三者对克罗恩病的诊断以及病情严重程度的评估方面有着重要的意义。
目前评估克罗恩病病情最常用的方法则是通过内镜和组织学检查,以及一些影像学检查,而炎症是小肠克罗恩病患者出现症状和体征的基础。本研究发现,联合监测克罗恩病患者AT-Ⅲ、IL-6、PCT水平将同时评估其凝血与炎症两个系统,将有助于患者的早期辅助诊断以及病情活动性的评估,并且可以在治疗过程中及时监测治疗效果,为其早期干预提供指导,尽量减少并发症,提高患者预后。但是本研究仅通过CDAI评分将克罗恩病患者分为活动组与缓解组进行患者血液AT-Ⅲ、IL-6、PCT水平与疾病活动性分析,而这些血液指标与患者内镜以及组织学检查结果的相关性有待进一步研究,以期指导临床精准评估患者病情。
[1] 黄志梅, 刘焕云. 克罗恩病患者血清生化指标的相关性研究[J]. 西南国防医药, 2013, 23(4):369-371.
[2] Singh UP, Singh NP, Murphy EA,etal. Chemokine and cytokine levels in inflammatory bowel disease patients[J]. Cytokine, 2016, 77:44-49.
[3] Suzuki Y, Matsui T, Ito H,etal. Circulating interleukin 6 and albumin, and infliximab levels are good predictors of recovering efficacy after dose escalation infliximab therapy in patients with loss of response to treatment for crohn's disease: a prospective clinical trial[J]. Inflamm Bowel Dis, 2015, 21(9):2114-2122.
[4] Yan SL, Russell J, Harris NR,etal. Platelet abnormalities during colonic inflammation[J]. Inflamm Bowel Dis, 2013, 19(6):1245-1253.
[5] 孙辉明, 施 毅. 抗凝血酶-Ⅲ抗炎机制的研究进展[J]. 国际呼吸杂志, 2011, 31(22):1746-1750.
[6] 潜丽俊, 刘 晟, 蔡 莹. 全身炎症反应综合征患儿血浆抗凝血酶Ⅲ及D-二聚体的检测及临床意义[J]. 浙江中医药大学学报, 2010, 34(2):240-241.
[7] Bernstein CN,Fried M,Krabshuis JH,etal. 2010年世界胃肠病学组织关于炎症性肠病诊断和治疗的实践指南[J]. 胃肠病学, 2010, 15(9):548-558.
[8] 中华医学会消化病学分会炎症性肠病协作组. 中国炎症性肠病诊断治疗规范的共识意见[J]. 中华内科杂志, 2008, 47(1):139-145.
[9] 徐晓帆, 谢 颖, 龚剑峰,等. 18例克罗恩病并发肠管膀胱瘘的诊疗分析[J]. 医学研究生学报, 2013, 26(12):1266-1268.
[10] 兰 平, 何晓生. 解读2012年中国炎性肠病诊断与治疗共识意见中一些热点问题[J]. 中华胃肠外科杂志, 2013, 16(4):304-307.
[11] 郭利莉, 马志坤. AT-Ⅲ与全身炎症反应综合征相关性研究[J]. 医学信息, 2013(26):92-92.
[12] 李 原, 任建安, 吴秀文,等. 克罗恩病诊断延迟的危险因素及其对预后的影响[J]. 中华消化外科杂志, 2015, 14(7):598-600.
[13] Karczewski J, Sworacwynar E, Rzymski P,etal. Selected biologic markers of inflammation and activity of Crohn's disease.[J]. Autoimmunity, 2015, 48(5):318-327.
[14] 刘 文, 王 维, 谢龙龙,等. 活动性克罗恩病肠系膜淋巴结的CT 影像学研究[J]. 实用放射学杂志, 2016, 32(4):610-613.
[15] Çekiç C, Ipek S, Aslan F,etal. P225 Evaluation of the relationship between serum ghrelin, C-reactive protein and interleukin-6 levels and disease activity in inflammatory bowel diseases[J]. J Crohns Colitis, 2014, 8(supplement_1):S156-S156.
[16] Atreya R, Neurath MF.Involvement of IL-6 in the pathogenesis of inflammatory bowel disease and colon cancer[J]. Clin Rev Allergy Immunol, 2005, 28(3):187-196.
[17] Nancey S, Hamzaoui N, Moussata D,etal. Serum interleukin-6, soluble interleukin-6 receptor and Crohn’s disease activity[J]. Dig Dis Sci, 2008, 53(1):242-247.
[18] Owczarek D, Cibor D, Glowacki MK,etal. Inflammatory bowel disease:Epidemiology,pathology and risk factors for hypercoagulability[J]. World J Gastroenterol, 2014, 20(1):53-63.
[19] Oikonomopoulou K, Ricklin D, Ward PA,etal. Interactions between coagulation and complement—their role in inflammation[J]. Semin Immunopathol, 2012, 34(1):151-165.
[20] Suarezdelarica A, Maseda E, Anillo V,etal. Biomarkers (procalcitonin, c-reactive protein, and lactate) as predictors of mortality in surgical patients with complicated intra-abdominal infection[J]. Surg Infect, 2015, 16(3):346-351.
[21] 黄凤楼, 刁孟元, 钱海飞,等. 降钙素原及内毒素对腹腔感染脓毒症患者预后的评估[J]. 东南国防医药, 2014,16(2):147-149.

