大黄酸对非酒精性脂肪肝病模型大鼠干预作用及对血清IL-1β、IL-6的影响
吕媛琳刘晨晨刘 慧张仙土乔 梁包剑锋
非酒精性脂肪肝病(non-alcoholic fatty liverdisease,NAFLD)是目前最为常见的一种慢性肝病,其发病率在亚洲地区20年内升高2%[1]。NAFLD以肝实质细胞脂质贮积和脂肪变性为特征,包括单纯性脂肪肝、脂肪性肝炎(NASH)[2-3]。目前我国非酒精性脂肪肝的发病率约为15%,是肝纤维化、肝硬化甚至是肝细胞癌的重要促进因素[4]。然而NAFLD的发病机制尚不明确,近年研究表明,胰岛素抵抗与炎症反应在NAFLD发生发展中发挥重要作用[5-6]。白细胞介素 1β(interleukin 1β,IL-1β)是白细胞介素 1(IL-1)家族的关键调节因子,具有调节炎症反应、肝胰岛素抵抗等作用[7]。白细胞介素 6(interleukin 6,IL-6)作为炎症介质具有多种生物学效应,其浓度高低也与炎症反应密切相关[8]。研究[9]表明,IL-1β、IL-6 可以促进肝脏炎症,诱发脂肪变性。大黄酸是中药大黄的提取物,大黄具有清热解毒、通腑泻热、活血消痈等功效。大黄可通过改善胰岛素抵抗(insulin resistance,IR),纠正低脂联素血症和脂代谢紊乱等途径,逆转大鼠NAFLD的肝脂肪变性和肝功能异常[10];可改善肝细胞脂肪变和炎性浸润,减轻线粒体变形和肿胀[11];采用不同剂量大黄素治疗后,可显著降低血脂和肝脂,改善肝功能[12]。本研究旨在观察大黄酸对NAFLD干预作用及其对血清IL-1β、IL-6的影响。
1 实验材料
1.1 动 物 雄性SD大鼠40只,动物合格证号:SCXK(沪)2013-0016。体质量(200±20)g,清洁级,购于上海西普尔必凯实验动物有限公司,饲养于浙江中医药大学实验动物中心,环境温度18~20℃,湿度50%左右。
1.2 药物及试剂 高脂饲料(货号TP-2003,购自南通特洛菲饲料科技有限公司);果糖(批号57-48-7,购自湖北赛创生物科技有限公司);大鼠IL-6 Elisa试剂盒(批号L360014S,美国Bio-Rad);大鼠IL-1βElisa试剂盒(批号 L474307S,美国 Bio-Rad);大黄酸(批号NF-20151124,购自西安天丰生物科技有限公司)。
1.3 仪 器 1000mL烧杯:华东医药有限公司;37℃恒温箱:日本日立公司;精密移液器及一次性吸头:美国Bio-Rad;自动化酶免分析仪:郑州安图生物有限公司;离心机KUBOTA6200型:日本KUBOTA公司;日立7180全自动生化分析仪:日本日立公司;精密称量仪:赛多利斯科学有限公司;低速离心机:上海安亭仪器有限公司;自动洗板机:日本KUBOTA公司。
2 实验方法
2.1 分组与造模 40只雄性SD大鼠适应性饲养7天后,按体质量随机分为对照组10只,模型组20只,大黄酸组10只。对照组大鼠喂饲普通中性饲料(脂肪、碳水化合物、蛋白质分别提供13%、65%、22%的能量)+普通饮用水,模型组和大黄酸组大鼠喂饲高脂饲料(脂肪、碳水化合物、蛋白质分别提供45%、33%、22%的能量)+10%果糖水,造模8周。8周后,模型组处死10只HE染色,判断造模是否成功。
2.2 给 药 造模成功后,对照组和模型组大鼠分别给予生理盐水10mg/kg灌胃,每天1次,大黄酸组予大黄酸100mg/kg灌胃,每天1次,连续给药8周,实验期间大鼠自由饮食。实验过程中,由于灌胃操作不规范造成模型组与对照组大鼠死亡各1只。
2.3 观察指标
2.3.1 一般观察 每周对大鼠体质量、肝湿重、进食量及进水量进行测量和记录,观察各组大鼠皮毛光泽度,粪便,以及大鼠的精神状态。
2.3.2 标本处理 16周后,末次给药后禁食12h,3%戊巴比妥纳30mg/kg腹腔内注射麻醉后,无菌条件下解剖大鼠,腹主动脉取新鲜血液10mL,室温静置20min后分离血清,于超低温离心机4℃,3000r/min,15min分离血清,取上清液,置-80℃,备用。
2.3.3 血生化指标及血清IL-1β、IL-6检测 采用PHOMO自动化酶免分析仪检测丙氨酸转氨酶(alaninne aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、总胆固醇(Total cholesterol,TG)、甘油三酯(triglycerides,TC)、空腹血糖(glucose,GLU)。采用酶联免疫吸附检测法(enzyme-linked immunosorbent assay,ELISA) 测定血清白介素 1β(IL-1β)和血清白介素 6(IL-6)。
2.4 统计学方法 应用SPSS17.0软件进行数据统计分析,计量资料以均数±标准差(±s)表示,采用单因素方差分析,P<0.05为差异有统计学意义。
3 实验结果
3.1 一般情况 给药前,对照组行为活跃,反应灵敏,食欲好,皮毛光整,无脱毛现象,体质量稳定增长,大便呈颗粒状、色黄、质硬。模型组体型肥胖,反应迟钝,皮毛蓬乱,毛色发黄,欠光泽,后期出现脱毛现象、食欲减退,大便呈颗粒状、色黑、质硬。给药后,大黄酸组体质量下降,皮毛微黄,光泽可,脱毛少见,反应较为灵敏,大便质稀、不成型。
3.2 各组大鼠体质量和肝湿重比较 与对照组比较,模型组大鼠体质量和肝湿重明显增加(P<0.05);与模型组比较,大黄酸组大鼠体质量和肝湿重明显降低(P<0.05),见表 1。
表1 各组大鼠体质量及肝湿重比较(g,±s)
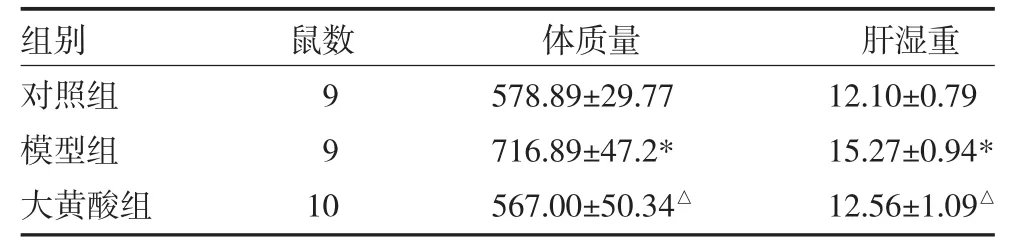
表1 各组大鼠体质量及肝湿重比较(g,±s)
注:与对照组比较,*P<0.05;与模型组比较,△P<0.05
?
3.3 各组大鼠血清IL-1β、IL-6水平比较 与对照组比较,模型组大鼠血清IL-1β、IL-6水平升高(P均<0.05)。与模型组比较,大黄酸组大鼠血清IL-1β、IL-6水平降低(P均<0.05),见表 2。
表2 各组大鼠血清IL-1β、IL-6 水平比较(pg/mL,±s)

表2 各组大鼠血清IL-1β、IL-6 水平比较(pg/mL,±s)
注:与对照组比较,*P<0.05;与模型组比较,△P<0.05
?
3.4 各组大鼠肝脏病理变化 对照组大鼠肝小叶结构完整清晰,肝细胞以中央静脉为中心呈放射状排列,无肝细胞肿胀及脂肪变性,汇管区无炎症细胞浸润;模型组大鼠肝脏细胞呈大泡性脂肪变性为主的混合性脂肪性病变,可见气球样变,汇管区及肝窦出现炎症细胞浸润和偶可见散在的点状坏死;大黄酸组大鼠肝细胞脂肪变程度明显减轻,肝细胞排列紧密,汇管区未见炎症细胞浸润。见图1(插页)。
3.5 各组大鼠血生化指标比较 与对照组比较,模型组大鼠血清 ALT、AST、TC、TG、GLU 明显增加(P<0.05);与模型组比较,大黄酸组大鼠血清ALT、AST、TC、TG、GLU 明显降低(P 均<0.05),见表 3。
表 3 各组大鼠血清 ALT、AST、TC、TG、GLU 水平比较(±s)

表 3 各组大鼠血清 ALT、AST、TC、TG、GLU 水平比较(±s)
注:与对照组比较,*P<0.05;与模型组比较,△P<0.05
?
4 讨论
中医文献中并无脂肪肝病名,但根据其发病特征和临床表现及致病因素应属“肥气”、“胁痛”、“积聚”、“胀满”、“痰浊”、“黄疽”等范畴。其多由饮食膏粱厚味,脾失健运,肝肾阴亏,气机瘀滞,血脉不畅而致。大黄具有泻热通便、凉血解毒、逐瘀通经的功效,而大黄酸是大黄的主要提取物,属蒽醌类衍生物,具有泻下、抑菌、止血、促进胆汁分泌、降脂、降压和抗肿瘤作用[13]。近年研究[14-15]显示,对脂肪肝、药物性肝损伤等具有保护作用,同时可通过多个靶蛋白发挥抗炎作用。
本研究结果表明,大黄酸组体质量、肝湿重较模型组明显降低,且 ALT、AST、TC、TG、GLU 明显降低(P<0.05),提示大黄酸可以抑制肝脏脂质沉积。而NAFLD的发病机制目前尚未明确,但胰岛素抵抗(IR)与炎症进展是其重要环节。IL-1β作为IL-1家族的一员,有研究表明在饮食诱导的肥胖模型中,IL-1β的表达可诱导肝脏炎症和肝纤维化[16]。同时IL-1β可促进胰岛β细胞的一氧化氮生成和细胞凋亡,从而选择性破坏胰岛β细胞导致IR,最终促进NAFLD发病[17]。本研究造模后,大鼠血清IL-1β明显升高,而大黄酸干预后其表达明显降低,提示大黄酸可能通过抑制IL-1β的表达从而达到减缓炎症以及胰岛素抵抗治疗脂肪肝。
白介素6(IL-6)是预测或者导致胰岛素抵抗的关键细胞因子[18]。研究[19]表明,IL-6在肥胖患者中的表达比BMI正常患者高30%,提示IL-6可能参与胰岛素抵抗的发生发展。而IL-6可激活Shc/ERK信号通路、mTOR信号通路及PI3K/AKT信号通路,从而促经炎症反应[20]。本研究造模后,大鼠血清IL-6明显升高,大黄酸干预后其表达水平明显降低(P<0.05),提示大黄酸可能通过抑制IL-6的表达从而达到减缓炎症以及胰岛素抵抗治疗脂肪肝。
综上所述,大黄酸可能通过抑制NAFLD大鼠血清IL-1β、IL-6表达,从而改善炎症水平,减少脂质沉积,改善肝脏脂肪变性。
[1] Macavei B,Baban A,Dumitrascu DL.Psychological factors associated with NAFLD/NASH:a systematic review[J].European Review for Medical&Pharmacological Sciences,2016,20(24):5081-5097.
[2] Nascimbeni F,Pais R,Bellentani S,et al.From NAFLD in clinical practice to answers from guidelines[J].Journal of Hepatology,2013,59(4):859.
[3]Pegah,Golabi,Cameron,et al.Effectiveness of exercise in hepatic fat mobilization in nonalcoholic fatty liver disease:Systematic review[J].World Journal of Gastroenterology,2016,22(27):6318-6327.
[4]董志霞,陆伦根.2015 JSGE非酒精性脂肪性肝病/非酒精性脂肪性肝炎循证临床实践指南解读[J].中国医学前沿杂志:电子版,2015,7(4):19-22.
[5] Tilg H,Diehl AM.Cytokines in alcoholic and nonalcoholic steatohepatitis[J].New England Journal of Medicine,2000,343(20):1467-1476.
[6]Fuchs CD,Traussnigg SA,Trauner M.Nuclear Receptor Modulation for the Treatment of Nonalcoholic Fatty Liver Disease[J].Seminars in Liver Disease,2016,36(1):69-86.
[7] Tilg Herbert,Moschen Alexander R.IL-1 cytokine family members and NAFLD:neglected in metabolic liver inflammation[J].Journal of hepatology,2011,55(5):960-962.
[8]Nahandi MZ,Khoshbaten M,Ramazanzadeh E,et al.Effect of non-alcoholic fatty liver disease on carotid artery intimamedia thickness as a risk factor for atherosclerosis[J].Gastroenterology&Hepatology from Bed to Bench,2014,7(1):55-62.
[9]陈晓顶,范录平,张有超,等.化滞柔肝颗粒对非酒精性脂肪肝脂联素、IL-6、TNF-α 水平的影响[J].中国生化药物杂志,2017,37(2):65-67.
[10]刘庆阳,高天舒,于世家.大黄酸改善大鼠非脂肪性肝病初步研究[J].辽宁中医药大学学报,2015,17(7):30-32.
[11]陆新烈,袁建芬,徐建立,等.大黄酸对非酒精性脂肪性肝病大鼠肝脏病理组织学及超微结构变化的影响[J].中国中医药科技,2013,20(5):477-478.
[12]董慧,陆付耳,高志强,等.大黄素治疗高脂饮食诱发的大鼠非酒精性脂肪肝的实验研究[J].中国中西医结合杂志,2006,26(Z1):64-67.
[13]陈秋荷,皮荣标,陈景考.大黄酸及其衍生物:合成与药理作用研究进展[J].药学研究,2016,35(3):161-167.
[14]武超,曹红燕,孙明瑜.大黄酸在肝病中的应用研究[J].辽宁中医杂志,2015,43(12):2382-2387.
[15]徐佑东,张艳,孟宪丽,等.基于反向对接法的大黄酸抗炎作用的分子机制研究[J].四川生理科学杂志,2016,38(1):1-4.
[16]王传敏,石庆凤,汤守兵,等.乙型肝炎患者血清 IL-1β、γ-IFN、HA、LN和PCⅢ在肝炎肝纤维化时水平的变化及其意义[J].临床和实验医学杂志,2015,14(9):718-721.
[17]王冲,程霖.初诊糖尿病患者白介素-1β与胰岛素抵抗的关系探讨[J].山东医药,2012,52(5):86-87.
[18]沈璐.血清内脂素、白介素6与非酒精性脂肪性肝病关系的研究[J].中国航天工业医药,2013,15(12):67-68
[19]Nassim DaliYoucef.Metabolic inflammation:Connecting obesity and insulin resistance[J].Annals of Medicine,2013,45(3):242-253.
[20]史冬梅,董方元,张帆,等.IL-6显著调节亚油酸棕榈酸联合诱导脂肪肝细胞模型中脂代谢的通路表达[J].世界华人消化杂志,2014,22(34):5235-5241.

