凤眼莲根际耐Cd、Zn细菌的分离鉴定及对Cd、Zn去除效果研究
郭 山,桂恒俊,陈 翩,赵建伟,周文兵,万小琼,朱端卫
(华中农业大学资源与环境学院生态与环境工程研究室,武汉 430070)
水体的重金属污染在我国是一项影响区域十分广泛、危害程度非常巨大、持续时间极为长久、对人体健康威胁尤为严重的水污染问题。从近年来对我国境内各大流域的调查报道情况来看,从雨水稀缺的西北地区到降雨充沛的东部地区,从人口密集的城市区域到人口稀疏的农村区域,从经济发达的沿海地区到经济较为落后的西部地区,全国范围内的大小水域均出现了程度不一的重金属污染问题[1-4]。Cd、Zn为同族元素,具有相似的原子结构及化学性质,在自然界总是伴生、伴存而造成复合污染[5]。Cd具有迁移性强、毒害性大的特点,是生物毒性最强的重金属元素之一。Zn是人体、动植物必需的微量元素,但其含量超过阈值也会对生物体产生毒害作用[6]。
植物-微生物联合修复重金属污染是近年来新兴的一种生物修复方法,随着人们对植物根际微生物和内生微生物认识的深入,越来越多的外接或内源微生物被用来与不同的重金属积累型或超积累型植物相互组合,以起到更加高效的重金属修复效果[7]。
凤眼莲(Eichhornia crassipes)作为一种能够有效净化水体污染的水生植物,被广泛运用在各类水体污染的治理工程中,在修复污染水体、丰富生物多样性等方面发挥了重要的作用。凤眼莲修复水体不仅仅依靠自身的净化能力,其发达的根系上寄生或共生的微生物也有突出贡献,目前凤眼莲与根际微生物联合修复重金属的作用越来越受到关注,Abou-Shanab等[8]从埃及Mariout湖泊的凤眼莲根系分离出6株对Cr有较高耐受性的细菌,将6种细菌和凤眼莲联合培养对Cr进行富集,结果显示接种组相对于对照组Cr富集量提高了8~35倍。Padmapriya等[9]从凤眼莲根部表面分离出了恶臭假单胞菌和蜡样芽孢杆菌,以其和凤眼莲为实验材料做联合培养实验对Cu进行去除,结果发现去除率可以达到80%以上。但是关于凤眼莲根际耐Cd和Zn菌株的研究还鲜有报道,本文将以从凤眼莲根系分离纯化的3株耐Cd和Zn的细菌R12、R15、R16为研究对象,初步探讨其特性及其对凤眼莲富集Cd和Zn的影响,研究结果在宏观层面为植物-微生物联合修复水体重金属污染提供了更多的理论依据。
1 材料与方法
1.1 凤眼莲样本
供实验所用凤眼莲采自武汉市洪山区野芷湖。将采回的凤眼莲冲洗干净后放入自来水中预培养一周[10],再选取大小长势基本一致的凤眼莲,用去离子水冲洗干净,进行 20 mg·L-1Zn2++0.5 mg·L-1Cd2+的水培暴露实验,Cd和 Zn分别以 CdCl2·2.5H2O、ZnCl2(分析纯)的形式添加。7周驯养结束后剪下部分凤眼莲根系作为实验材料。
1.2 菌株的分离及耐受性试验
将凤眼莲根部鲜样取下装入灭菌离心管,然后转移入超净工作台内,用灭菌塑料剪刀将根剪碎后转移入装有30 mL灭菌液体LB培养基的50 mL锥形瓶内;在37℃、160 r·min-1下于恒温培养箱内活化12 h;取活化后的菌悬液涂布到经系列浓度Cd2+和Zn2+修正过的固体LB培养基上,涂布好的平板于37℃培养箱内培养1~2 d,待菌落形成后,用接种环按无菌操作法从平板上形态不同的菌落中各取一环,再在新的固体培养基平板上用划线法分离,重复操作直至挑选出对Cd和Zn耐受性良好的菌株。
将生长至对数期的菌悬液按照1∶300体积比的接种量分别加入到含不同浓度重金属的LB培养基中。其中 Cd2+的浓度为 0.5、2.0、5.0、10.0 mg·L-1,Zn2+的浓度为 20、100、300、500 mg·L-1。接种后将培养基在 37℃、160 r·min-1培养 12 h,以菌株在不添加重金属的培养基中的生长情况为对照,用分光光度法测定不同金属浓度暴露下菌液的OD470值。
1.3 菌株的鉴定及系统发育分析
采用细菌16S rRNA通用引物,利用PCR技术进行扩增。引物由武汉擎科创新生物科技有限公司提供。16S rRNA PCR反应条件:94℃预变性5 min;94℃变性 1 min,50℃退火 1 min,72℃延伸 1.5 min,33个循环;72℃延伸10 min。
通过凝胶电泳检测结果,由武汉擎科创新生物科技有限公司测序。
对于每一个细菌的16S rRNA序列在NCBI数据库中进行BLAST检索,将检索结果中序列相似度达到95%以上的细菌种属罗列备用为实验菌的大致归属。将罗列出来的序列相似度较高的菌株与实验菌株的16S rRNA序列一起进行系统发育分析,进一步确定细菌的归属。系统发育树的构建通过MEGA 6.0软件采用邻接法(Neighbor-joining method)进行。
1.4 耐重金属细菌对Cd和Zn的去除作用
将菌株按照无菌操作法接入装有30 mL灭菌液体LB培养基的50 mL锥形瓶内,在37℃、160 r·min-1下于恒温摇床内活化14 h获得原菌液;按照1∶300体积比的接种量将原菌液接入3组装有750 mL灭菌LB培养基的摇瓶,每组3个重复;将摇瓶置于37℃、160 r·min-1下培养5 h后加入Cd母液和Zn母液使得培养液内 Cd2+、Zn2+浓度分别为 0.5 mg·L-1和 20 mg·L-1;继续振荡培养,分别于 12、24、36 h 进行取样,将悬菌液在4℃、8000 r·min-1下离心30 min,分离上清液和菌体沉淀;上清液通过0.45 μm滤膜抽滤保存,菌体沉淀在105℃下烘干至恒重保存。细菌对重金属的去除率:

式中:C1、C2分别为细菌富集重金属的量和上清液剩余重金属的量,mg。
1.5 细菌中Cd和Zn含量的测定分析
烘干后的样品采用HNO3-HClO4消解,将消解好的溶液转移至50 mL容量瓶中,用去离子水定容。过滤后采用原子吸收光谱仪(AA240FS GTA120)测定Cd、Zn 含量[10]。
1.6 凤眼莲-微生物联合培养
首先对凤眼莲根系进行灭菌处理[11],后将CdCl2·2.5H2O或ZnCl2母液按照一定的比例与灭菌霍格兰植物营养液混合,得到浓度为0.5 mg·L-1Cd2+和20 mg·L-1Zn2+的1 L培养液。重金属的实验设计按照如下处理进行:①对照组,培养液中不含有重金属和根际细菌。②Cd或Zn处理组,在培养液中分别加入Cd或Zn使培养液浓度为0.5 mg·L-1Cd2+或 20 mg·L-1Zn2+,不添加根际细菌。③根际细菌+Cd或Zn处理组,在含有重金属的培养液中,分别投入根际细菌R12、R15、R16,细菌密度为 106CFU·mL-1。每组设置 3 个重复。整个培养试验在植物生长培养箱中进行,光暗比为12 h∶12 h,温度为25℃,湿度为80%,光照强度为 20 000 lx,CO2浓度 9.1 μmol·L-1,培养时间分为 4周和7周。
培养结束后将凤眼莲从营养液中取出,先用自来水冲洗,再用去离子水冲洗3次,将植物分为根、茎、叶三部分。其中根在20 mmol·L-1的Na2-EDTA溶液中浸泡15 min以去除吸附在根表面的重金属,用吸水纸吸干样品表面的水分。将植物鲜样在105℃杀青30 min,然后在65℃下烘干至恒重。
1.7 凤眼莲中Cd和Zn含量的测定分析
植物干样研磨过60目筛,供重金属含量分析,测定方法同1.6。
转移系数(Transfer factor,TF)=地上部分所累积的重金属的含量(g·kg-1)/根部所累积的重金属的含量(g·kg-1)[12-13]。
1.8 统计分析方法
实验数据采用Excel 2013和Origin Pro 8.0分析,利用SPSS 20.0进行单因素方差分析(ANOVA)和Duncan检验多重比较(P<0.05),结果以平均值±标准差表示。
2 结果与分析
2.1 菌株对Cd和Zn的耐受性
由图1可见,R12、R15、R16对重金属Cd耐受能力良好,Cd2+浓度在10 mg·L-1以下时,随着Cd2+添加浓度的增加,R12、R15的生长受到轻微的抑制,而R16生长受到明显抑制,但仍能顽强生存。在3种菌对Zn的耐受实验中,20 mg·L-1Zn2+对3种菌的生长几乎没有影响,100 mg·L-1Zn2+对菌的生长影响微弱,300 mg·L-1Zn2+对菌的生长抑制作用明显,当Zn2+浓度达到500 mg·L-1时,3种菌均无法生长。
2.2 菌株的16S rRNA基因测序分析
通过对这3种菌进行16S rRNA基因测序,并将测序结果构建系统发育树对细菌进行进一步的种属鉴定(图2)。结果表明R12和R15在系统发育上可以划分到假单胞菌属(Pseudomonas),这两株菌与铜绿假单胞菌(Pseudomonas aeruginosa)在系统进化树上处于同一分支,序列同源性达到100%。R16在系统发育上可以划分到寡养单胞菌属(Stenotrophomonas),寡养单胞菌属目前仅有一个菌种即嗜麦芽寡养单胞菌(Stenotrophomonas maltophilia),R16 与寡养单胞菌属的Stenotrophomonas maltophilia strain MHF ENV 20(HM625746.1)在进化树上处于同一分支,序列同源性达到99%。由此可初步确定R12、R15为两株铜绿假单胞菌,R16为一株嗜麦芽寡养单胞菌。
2.3 耐重金属细菌对Cd、Zn的去除作用
随着培养时间的变化,单位质量3种细菌对Cd和Zn的去除情况类似,R12、R16均表现为随着培养时间的增加而增加,在培养36 h时达到最大,其中Cd 分别为 0.076 mg·g-1和 0.17 mg·g-1,Zn 分别为0.57 mg·g-1和2.71 mg·g-1(表1和表2)。而单位质量R15对Cd和Zn的去除量表现为随培养时间增加先减少后增加的趋势,在培养36 h达到峰值,分别为0.065 mg·g-1和 0.52 mg·g-1。

图1 R12、R15、R16对Cd和Zn的耐受性Figure 1 Tolerance to cadmium and zinc of R12,R15,R16
从3种细菌对培养液中Cd和Zn的整体去除率来看,随培养时间的增加,R12、R15、R16对Cd和Zn的去除率均表现为随培养时间增加而增加(图3)。3种细菌在培养12 h时对Cd和Zn的去除率没有明显差异,其中Cd在10%左右,Zn在2%左右。而在培养24 h时,R12对Cd的去除率明显高于另外两种,达到了23%。在培养36 h后,R16对Cd的去除率高达41%。在培养24 h和36 h时,R16对Zn的去除率均最大,分别达5%和16%。
2.4 凤眼莲-微生物联合培养对Cd、Zn的富集
2.4.1 耐重金属细菌对凤眼莲富集Cd的影响
培养4周后,除对照组的根、茎、叶中均未检测到Cd外,其余处理组各部位均检测到Cd,且都表现为根部对Cd的富集量最高,说明凤眼莲根部对Cd的富集能力明显高于茎、叶部(图4)。同等条件下,根际细菌R12、R15、R16的加入使得凤眼莲根部的Cd含量显著降低,分别为单一Cd处理组的24%、61%、51%,说明根际微生物的加入抑制了凤眼莲根部对Cd的富集,但微生物的加入并未对凤眼莲茎、叶部富集Cd的能力产生显著影响。同时根际细菌的加入引起了凤眼莲对Cd转移系数的变化,相较于Cd处理组的 TF 值(27.6%),R12、R15、R16的加入分别使 TF值提高到了118.0%、41.9%、53.5%,说明R12、R15、R16加入培养4周提高了凤眼莲将Cd从根部转移到茎、叶部的能力。

图2 R12、R15、R16的16S rRNA基因序列系统发育树Figure 2 Phylogenetic tree of 16S rRNA gene sequence of R12、R15、R16

表1 单位质量细菌对Cd的去除量(10-2mg·g-1DW)Table 1 Removal of cadmium by bacteria in unit quality(10-2mg·g-1DW)
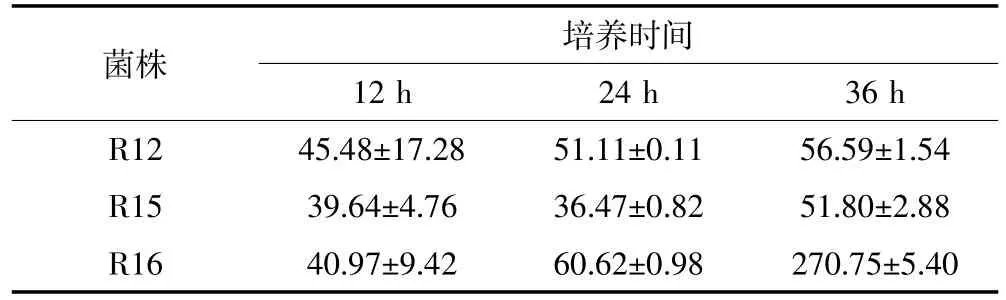
表2 单位质量细菌对Zn的去除量(10-2mg·g-1DW)Table 2 Removal of zinc by bacteria in unit quality(10-2mg·g-1DW)
培养7周后,对照组的各部位仍未检测到Cd,而其余处理组均有检出,仍表现为根部富集量最高且显著高于茎、叶部。其中,R15的加入使得凤眼莲根部和茎部的Cd含量显著提高,分别为单一Cd处理组的1.14倍和1.26倍,而叶部Cd含量没有发生显著变化;R12的加入显著抑制了凤眼莲根部对Cd的富集,根部富集量仅为单一Cd处理组的21.4%,同时R12的加入显著提高了凤眼莲茎部对Cd的富集量,茎部富集量为单一Cd处理组的1.18倍,但对叶的Cd积累影响不显著;R16的加入显著抑制了凤眼莲各部位对Cd的富集,根、茎、叶三部分的Cd含量分别为单一Cd处理组的23.6%、79.4%、84.1%。从凤眼莲对Cd的TF值来看,根际细菌R15的加入对TF值未产生明显影响;R12、R16的加入均显著提高了TF值,相较于单一Cd处理组的22.5%,分别增加至116.7%和78.3%。Cd胁迫处理7周后,根际细菌R15促进了凤眼莲对Cd的富集,对Cd在凤眼莲内部的迁移影响微弱,根际细菌R12、R16虽然抑制了凤眼莲根部对Cd的富集,但却促进了重金属Cd从凤眼莲根部向地上部的迁移。

图3 不同时间细菌对Cd和Zn的去除率Figure 3 Removal rate of cadmium and zinc by bacteria at different time
对比培养4周和培养7周后凤眼莲对Cd的富集情况可以发现,对照组各部位均未检测到Cd。培养7周的Cd处理组的茎、叶部Cd含量相较于培养4周未出现显著变化,但根部Cd含量却提高了0.36倍。培养7周的Cd+R12处理组根部和茎部Cd含量显著提高,分别为培养4周时的1.26倍和1.86倍,叶内Cd含量无显著变化。培养7周的Cd+R15处理组凤眼莲根、茎、叶部的Cd含量分别为培养4周时的2.57、1.27、1.28倍。培养7周的Cd+R16处理组,茎部和叶部的Cd含量与培养4周相比没有显著变化,但是根部的Cd积累量略有降低。
2.4.2 耐重金属细菌对凤眼莲富集Zn的影响
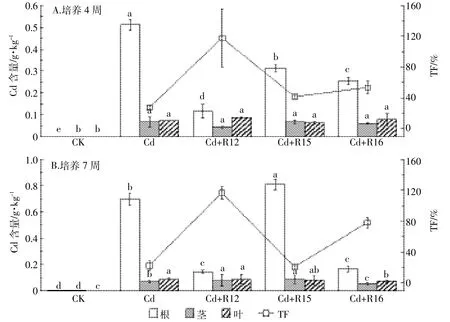
图4 Cd胁迫下R12、R15、R16对凤眼莲中Cd含量的影响Figure 4 The effect of R12,R15,R16 on Cd content in Eichhornia crassipes under cadmium treatments
培养4周后,在对照组中检测到低水平的Zn存在,可能是因为Zn作为植物生长发育的营养元素,在没有外源添加的情况下也能在凤眼莲体内保存有一定的含量。加入Zn后,各处理组凤眼莲各部位对Zn的富集量显著提升,且均表现为根部对Zn的富集量明显高于茎、叶部,说明凤眼莲对Zn的富集也同样集中在根部。同时根际微生物R12、R15、R16的加入较于单一Zn处理组,凤眼莲根部对Zn的富集量几乎未受影响,但是都显著削弱了茎部对Zn的富集量,R12、R16的加入对凤眼莲叶内Zn含量未造成显著影响,而R15的加入降低了凤眼莲叶内的Zn含量。从凤眼莲对Zn的转移系数来看,单一Zn处理和对照相比,TF值从155.2%下降到55.8%,表明Zn胁迫显著抑制了Zn从凤眼莲根部向地上部的迁移。R12、R15、R16的加入进一步降低了凤眼莲对Zn的TF,与单一Zn处理组相比降低了 15.3%、21.5%、18%(差值),表明根际微生物的加入抑制了Zn从凤眼莲根部向茎、叶部分的迁移(图5)。
培养7周后,在对照组中依然检测到低水平Zn的存在,各处理组也仍表现为根部富集的Zn含量最高。相对于对照组,凤眼莲不同部位对Zn的富集量均显著提高。R12、R15、R16的加入对凤眼莲富集Zn的能力并未造成显著影响,但是对凤眼莲内部的Zn迁移却有重要的贡献。相较于单一Zn处理组TF值(73.6%),R12、R15的加入使得TF值下降到55.8%和56.8%,说明R12、R15的加入抑制了Zn在凤眼莲内部的迁移能力。而R16的加入却使得TF值从73.6%提升到92.4%,表明R16促进了Zn在凤眼莲内的迁移。
综合培养4周和培养7周的结果可以发现,不同处理组培养7周后的TF值相较于培养4周时均有显著提高,单一Zn处理组TF值从55.8%提高到了73.6%,表明随着凤眼莲的生长,更多的Zn从凤眼莲根部迁移到地上部。R12、R15、R16的加入没有对凤眼莲富集Zn的能力造成显著影响,但是却能够调节Zn在凤眼莲内部的迁移情况,Zn+R12处理组TF值从40.5%提高到了55.8%,Zn+R15处理组TF值从34.3%提高到了 56.8%,Zn+R16处理组 TF值从37.8%提高到了92.4%,表明随着处理时间的增加,R12、R15、R16对Zn在凤眼莲体内迁移能力的促进越来越强。
3 讨论

图5 Zn胁迫下R12、R15、R16对凤眼莲中Zn含量的影响Figure 5 The effect of R12,R15,R16 on Zn content in Eichhorniacrassipes under zinc treatments
从已有的针对凤眼莲的研究结果来看,凤眼莲被证实对镉、锌、铜、铅、铬、汞等多种重金属都有出色的富集能力,是一种优秀的环境修复植物,在改善水质、修复环境方面有着杰出贡献[14]。而凤眼莲对重金属的去除作用不仅仅依靠其本身的富集能力,在凤眼莲盘根交错的根系上生活着的各种微生物对整个凤眼莲体系富集重金属的作用也有着重要的贡献[15],但目前国内外对这方面的探究较少。本研究尝试从凤眼莲根系分离筛选出耐重金属 Cd、Zn的细菌 R12、R15、R16,结果证实3株菌均可以耐受10 mg·L-1的Cd2+和300 mg·L-1的Zn2+,这表明长期处于高浓度Cd和Zn的生存环境下,自然选择可能使得凤眼莲根际细菌具备了耐受这些重金属的能力。通过鉴定,R12、R15、R16分属于Pseudomonas和Stenotrophomonas 2个不同的属,这两个属的细菌已经被证实具有良好的Cd、Zn耐受能力,而且可以对环境当中的Cd、Zn进行去除[16-17],这与我们的研究结果是一致的。
凤眼莲-微生物的联合培养实验证明,菌株的加入确实会对凤眼莲富集Cd、Zn产生不同程度的影响。根际细菌R12、R16在Cd暴露处理4周和7周时,均降低了凤眼莲对Cd的吸收,提高了凤眼莲对Cd的转运系数;R15则在培养4周时,表现出降低凤眼莲对Cd的吸收,提高凤眼莲对Cd的转运系数,在培养7周时却提高了凤眼莲对Cd的富集量,对Cd在凤眼莲内部的转运影响较小。这表明不同细菌种类、不同培养时间都会影响凤眼莲对Cd的富集,这种影响表现在凤眼莲对Cd的吸收量以及Cd在凤眼莲体内的迁移。
在Zn暴露处理下,随着培养时间的延长,R12、R15、R16并未对凤眼莲富集Zn的量产生显著影响,而且随培养时间延长,R12、R15均有效降低了凤眼莲对Zn的转运系数,R16随着培养时间的延长却促进了Zn在凤眼莲内部的迁移。这表明不同细菌种类、不同培养时间也会影响凤眼莲对Zn的富集,但这种影响不同于Cd,只表现为Zn在凤眼莲体内迁移的变化。因此可以初步得出细菌对凤眼莲富集重金属过程的调控受到重金属类型、细菌种类和时间的共同影响。
而对于Pseudomonas和Stenotrophomonas这两种属细菌在植物富集重金属过程中的作用已有部分探讨,菌株通过产生吲哚乙酸(IAA)、分泌铁载体以及转化金属形态等作用对植物生长和金属富集造成影响[18-19]。Sinha 等[20]的研究显示 Pseudomonas aeruginosa KUCd1分泌的铁载体可以抑制植物对Cd的吸收。同时也有研究显示Pseudomonas aeruginosa产生的铁载体PVD和PCH可以通过增加Cr的生物有效性来提高Cr在玉米内的含量[21]。
由于凤眼莲根际微生物的多样性和微生物对重金属作用原理的复杂性,目前对凤眼莲根际微生物促进其重金属富集的机理研究还在不断地完善当中,根际微生物在凤眼莲富集重金属方面的广谱性和特异性作用还有待明确。
4 结论
(1)从凤眼莲根际筛选出的耐重金属细菌R12、R15、R16均可以耐受较高浓度Cd和Zn,经鉴定3株菌分属假单胞菌属(Pseudomonas)和寡养单胞菌属(Stenotrophomonas)。
(2)3株菌均具有一定去除Cd和Zn的能力,但总体来说R16的去除效果最好。
(3)R12、R16可以通过抑制Cd进入凤眼莲根部从而提高凤眼莲对Cd的耐受性,R15通过调节Cd进入凤眼莲根部及其在植株中的迁移影响植物对Cd的富集;R12、R15、R16对凤眼莲富集Zn的影响主要体现在对凤眼莲内部Zn迁移的调控。
[1]Gao Q,Li Y,Cheng Q Y,et al.Analysis and assessment of the nutrients,biochemical indexes and heavy metals in the Three Gorges Reservoir,China,from 2008 to 2013[J].Water Research,2016,92:262-274.
[2]Li C,Song C W,Yin Y Y,et al.Spatial distribution and risk assessment of heavy metals in sediments of Shuangtaizi estuary,China[J].Marine Pollution Bulletin,2015,98(1/2):358-364.
[3]Ma X L,Zuo H,Tian M J,et al.Assessment of heavy metals contamination in sediments from three adjacent regions of the Yellow River using metal chemicalfractionsand multivariate analysistechniques[J].Chemosphere,2015,144(3):264-272.
[4]Zhang Z Y,Li J,Mamat Z,et al.Sources identification and pollution evaluation of heavy metals in the surface sediments of Bortala River,Northwest China[J].Ecotoxicology&Environmental Safety,2016,126:94-101.
[5]赖彩秀,潘伟斌,张太平,等.苹果酸和草酸对两种植物吸收土壤中Cd、Zn 的影响[J].生态科学,2016,35(4):31-37.LAI Cai-xiu,PAN Wei-bin,ZHANG Tai-ping,et al.Effects of malic acid and oxalic acid application on the uptake of Cd and Zn by two plants[J].Ecological Science,2016,35(4):31-37.
[6]赵转军,南忠仁,王兆炜,等.Cd,Zn复合污染菜地土壤中重金属形态分布与植物有效性[J].兰州大学学报(自科版),2010,46(2):1-5.ZHAO Zhuan-jun,NAN Zhong-ren,WANG Zhao-wei,et al.Form distribution of Cd,Zn and bioavailability in arid contaminated oasis soil[J].Journal of Lanzhou University,2010,46(2):1-5.
[7]马 莹,骆永明,滕 应,等.内生细菌强化重金属污染土壤植物修复研究进展[J].土壤学报,2013,50(1):195-202.MA Ying,LUO Yong-ming,TENG Ying,et al.Effects of endophytic bacteria enhancing phytoremediation of heavy metal contaminated soils[J].ActaPedologicaSinica,2013,50(1):195-202.
[8]Abou-Shanab R A I,Angle J S,Berkum P V.Chromate-tolerant bacteria for enhanced metal uptake by Eichhorniacrassipes(Mart.)[J].International Journal of Phytoremediation,2007,9(2):91-105.
[9]Padmapriya G,Murugesan A G.Biosorption of copper ions using rhizoplane bacterial isolates isolated from Eicchornia crassipes((Mart.)solms)with kinetic studies[J].Desalination&Water Treatment,2014,53(13):1-8.
[10]谭彩云,林玉满,陈祖亮.凤眼莲净化水中重金属的研究[J].亚热带资源与环境学报,2009,4(1):47-52.TAN Cai-yun,LIN Yu-man,CHEN Zu-liang.The use of Eichhornia crassipes for the removal of heavy metals from aqueous solutions[J].Journal of Subtropical Resources&Environment,2009,4(1):47-52.
[11]张雨婷,王 贤,王永勤,等.次氯酸钠用于植物培养基灭菌方法初探[J].中国农学通报,2012,28(4):263-268.ZHANG Yu-ting,WANG Xian,WANG Yong-qin,et al.The study on sodium hypochlorite for sterilization of plant culture medium[J].Chinese Agricultural Science Bulletin,2012,28(4):263-268.
[12]Stoltz E,Greger M.Accumulation properties of As,Cd,Cu,Pb and Zn by four wetland plant species growing on submerged mine tailings[J].Environmental&Experimental Botany,2002,47(3):271-280.
[13]韦韩阳,陈同斌,黄泽春,等.大叶井边草:一种新发现的富集砷的植物[J].生态学报,2002,22(5):777-778.WEI Chao-yang,CHEN Tong-bin,HUANG Ze-chun,et al.Cretan brake(Pteris creticaL.):An arsenic-accumulating plant[J].ActaEcologicaSinica,2002,22(5):777-778.
[14]Yadav A K,Pathak B,Fulekar M H.Rhizofiltration of heavy metals(cadmium,lead and zinc)from fly ash leachates using water hyacinth[J].International Journal of Environment,2014,4(1):179-195.
[15]El-Deeb B,Gherbawy Y,Hassan S.Molecular characterization of endophytic bacteria from metal hyperaccumulator aquatic plant(Eichhornia crassipes)and its role in heavy metal removal[J].Geomicrobiology Journal,2012,29(10):906-915.
[16]Upadhyay A,Kochar M,Rajam M V,et al.Players over the surface:Unraveling the role of exopolysaccharides in zinc biosorption by fluorescent Pseudomonas strain Psd[J].Frontiers in microbiology,2017,8.doi:10.3389/fmicb.2017.00284.
[17]Shi P L,Zhu K X,Zhang Y X,et al.Growth and cadmium accumulation of Solanum nigrum L.seedling were enhanced by heavy metal-tolerant strains of Pseudomonas aeruginosa[J].Water,Air,&Soil Pollution,2016,227(12):459.
[18]Li K,Ramakrishna W.Effect of multiple metal resistant bacteria from contaminated lake sediments on metal accumulation and plant growth[J].Journal of Hazardous Materials,2011,189(1/2):531-539.
[19]Ullah A,Sun H,Munis M F H,et al.Phytoremediation of heavy metals assisted by plant growth promoting(PGP)bacteria:A review[J].Environmental&Experimental Botany,2015,117:28-40.
[20]Sinha S,Mukherjee S K.Cadmium-induced siderophore production by a high Cd-resistant bacterial strain relieved Cd toxicity in plants through root colonization[J].Current Microbiology,2008,56(1):55-60.
[21]Braud A,Geoffroy V,Hoegy F,et al.Presence of the siderophores pyoverdine and pyochelin in the extracellular medium reduces toxic metal accumulation in Pseudomonas aeruginosaand increases bacterial metal tolerance[J].Environmental Microbiology Reports,2010,2(3):419-425.

