切花小菊绿心性状杂种优势与混合遗传分析
赵倩茹,钟兴华,张飞,房伟民,陈发棣,滕年军
切花小菊绿心性状杂种优势与混合遗传分析
赵倩茹,钟兴华,张飞,房伟民,陈发棣,滕年军
(南京农业大学园艺学院/农业部景观设计重点实验室,南京 210095)
【目的】绿心性状是单瓣切花小菊重要的观赏性状,研究切花小菊绿心性状杂种优势和遗传基础以利于指导绿心切花小菊的选育工作。【方法】分别以‘南农丰收’(黄心小菊)ב南农红霞’(绿心小菊)的81个杂交后代和‘南农红云’(绿心小菊)ב南农小清新’(绿心小菊)的70个杂交后代作为遗传群体,选取花心颜色等级得分值(简称花心颜色值,下同)、绿心相对面积和绿心持续期等3个指标对F1代绿心性状杂种优势进行分析,同时运用单个世代主基因+多基因混合遗传模型对绿心性状进行遗传分析。【结果】2个组合F1代群体各指标变异系数范围为24.88%—90.76%,组合I(黄心×绿心)各指标变异程度普遍大于组合II(绿心×绿心),组合II各指标平均值普遍优于组合I。组合I花心颜色值、绿心相对面积和绿心持续期的中亲优势分别为-0.14、-3.42和0.11,除绿心持续期杂种优势为正值,其他指标杂种优势均为负值;组合II花心颜色值、绿心相对面积和绿心持续期的中亲优势分别为-0.11、-10.61和-1.02,绿心持续期的超亲优势为-0.52。2个组合F1群体均存在正向和负向超亲个体。组合I和组合II的F1代花心颜色中绿色占比分别为3.70%和2.86%,父本颜色和比母本颜色低一等级的颜色在后代中占比接近且较大,均大于等于20.00%。2个组合绿心颜色得分、绿心相对面积和绿心持续期均由2对主基因控制,除花心颜色值为负向效应外,其他指标表现为正向增效效应。花心颜色值、绿心相对面积和绿心持续期的主基因遗传力分别为98.64%—98.83%、95.04%—96.54%和66.73%—92.52%。2个组合花心颜色值、绿心相对面积与绿心持续期两两之间均呈显著正相关。【结论】F1代超亲分离现象普遍存在,可选取其中有利个体进行选育,绿色花心颜色遗传能力弱,选择花心颜色为绿色的品种做父本,有利于提高后代出现绿色花心的可能性。花心颜色值、绿心相对面积和绿心持续期均具有高遗传力,适于早期世代选择,各指标之间的正相关性有利于集中优势选育绿心小菊。
切花小菊;绿心性状;杂种优势;主基因+多基因;遗传分析
0 引言
【研究意义】菊花是中国十大传统名花和世界四大切花之一,切花小菊因其花型多样、花色丰富、株型紧凑、花期较长等特点深受世界各国人民喜爱[1-4]。传统的切花小菊盛花期花心表现为黄色,而绿心切花小菊花心表现为绿色,相比前者,更显清新素雅、秀丽脱俗,观赏价值更高[5],但市场上优质的绿心切花小菊仍然较少[6-7]。目前对绿心切花小菊进行选育的最直接、有效的手段仍是杂交育种,因此,了解切花小菊绿心性状的杂种优势和遗传规律对指导菊花育种工作具有重要意义[8-10]。【前人研究进展】传统的菊花花色遗传规律分析主要按照质量性状进行分析:1)各种花色的遗传潜力由大到小依次为:紫色>红色>黄色>白色>粉色>绿色[11-14]。2)菊花花色遗传红色呈现偏母性遗传的现象,白色和黄色一般不表现偏母性遗传[11]。3)杂交后代较易出现和亲本类似的花色或过渡花色[13]。4)花色遗传因杂交组合、亲本表型的不同,会出现不同的遗传规律[14]。随着色差仪等测量仪器的使用和测量方法的改进,发现可对连续变化的花色性状进行数量性状遗传分析,有利于更加客观地反映花色的分离变化[15]。植物数量性状遗传体系是指控制植物数量性状的基因体系,根据控制植物数量性状的基因数目,各对基因的效应,以及环境对其表现的影响,可分为主基因和微效多基因,它们共同存在,影响植物的表型[16]。目前已成功建立了主基因+多基因混合遗传模型分离分析的方法,用于鉴别数量性状的主-多基因混合遗传模型并估计相关遗传参数[16-17]。该方法包括单个分离世代(F2)与多个分离世代联合两种情形,在很多植物的遗传分析中得到了广泛应用[18-20]。由于菊花经过长期杂交选育,无性繁殖,遗传物质高度杂合化,两个亲本杂交得到的F1代就能发生广泛的性状分离,林木、果树和草坪草中也存在类似的现象,有研究者认为这些异交植物的F1代相当于近交作物的F2代[8,21-22]。【本研究切入点】本研究定义了绿心性状,设定了绿心指标,并选配具有不同绿心等级差异的2个杂交组合,得到2个F1代杂交群体,然后通过中亲优势计算及植物数量性状主基因+多基因混合遗传模型——单个分离世代(F2)的分离分析方法,从花心颜色值、绿心相对面积和绿心持续期等3个指标,对2个F1代杂交群体绿心性状进行杂种优势、遗传特性和相关性分析。【拟解决的关键问题】确定切花小菊绿心性状的遗传模型和基因作用方式,估计主基因的遗传效应和遗传方差,指导切花小菊杂交亲本选配工作,同时为菊花遗传基础研究提供理论依据,为今后菊花优良绿心性状的QTL定位和分子标记辅助育种的深入研究奠定基础。
1 材料与方法
试验于2015—2016年在南京农业大学湖熟花卉基地进行。
1.1 试验材料
试验材料为南京农业大学自主选育的切花小菊品种‘南农红霞’‘南农红云’‘南农小清新’和‘南农丰收’,现保存于南京农业大学湖熟花卉基地。其中‘南农红霞’‘南农红云’和‘南农小清新’为绿心小菊,单花序盛花期的初始阶段(简称盛花初,下同)花心接近全绿,花心颜色偏绿色,绿心持续期6—9 d,观赏价值较高;‘南农丰收’为黄心小菊,盛花初绿心相对面积为50.64%,花心颜色浅黄绿色,绿心持续期3 d,观赏价值较低。将4个品种配成2个组合,组合I:‘南农丰收’(黄心小菊)ב南农红霞’(绿心小菊);组合II:‘南农红云’(绿心小菊)ב南农小清新’(绿心小菊)。
1.2 人工杂交和田间性状调查
2015年11月盛花期间,进行人工杂交。母本选取发育良好的花蕾,于花序初开期去除花心管状花,剪去舌状花花瓣至可见柱头(不伤及柱头),用硫酸纸套袋;父本选取发育良好的花蕾,于散粉前套袋,至母本柱头伸出成“Y”字时(去雄后3—5 d),收集父本花粉,给母本授粉、套袋,次日重复授粉,4—5 d后在袋子上剪口,防止潮湿发霉。组合I授粉21株,共70个花序;组合II授粉26株,共90个花序。当花梗变黄枯萎时进行采收、脱粒,共获得F1代杂交种子835粒,其中组合I获得251粒,组合II获得584粒,于次年3月经穴盘点播,5月上旬连同亲本扦插苗一起定植于基地苗圃大棚,常规管理同大田。组合I获得81株实生苗,组合II获得70株实生苗。
2016年6—7月分别对组合I和组合II的81株和70株实生苗进行编号,连同亲本一起采穗扦插,每个F1代个体和亲本品种分别获得数量不少于3株的无性系,定植后同大田常规管理。同年秋季11—12月花序初开期,观测并计算亲本和F1群体的花心颜色值、绿心相对面积和绿心持续期等3个绿心指标,具体方法见1.3,每个F1代株系选取大小一致、发育正常的花序进行观测,每个指标设置3个重复,取平均值。观测期间棚内温度5—23℃,11月阴雨天14 d,12月阴雨天9 d。
1.3 绿心性状定义及各指标测定方法
朱安超[5]对绿心切花小菊管状花绿色形成机理的研究结果表明,绿心小菊中间两性管状花为绿色,而传统黄心小菊中心管状花为黄色;在盛花期初始阶段绿心小菊管状花变黄率为0,黄心小菊管状花变黄率为46.7%;绿心小菊从初开期花心露出至达到或超过40%的花心变黄的时间大于13.1 d,黄心小菊从初开期花心露出至达到或超过40%花心变黄的时间小于等于2.4 d。结合前期对切花小菊绿心性状的观察,本研究定义绿心性状为:切花小菊管状花表现绿色的特性,主要通过绿色深浅程度、绿色所占比例和绿色持续时间等3个方面进行描述和评价,切花小菊主要指单瓣或半重瓣露心切花小菊品种。在此基础上,定义黄心小菊和绿心小菊:盛花期初始阶段管状花变黄比例大于等于40%的品种是黄心小菊;盛花期初始阶段管状花变黄比例小于40%的品种是绿心小菊。同时,设定花心颜色等级得分值(简称花心颜色值,下同)、绿心相对面积和绿心持续期等3个指标表征绿心性状。
1.3.1 花心颜色的测定和分级 花心颜色:指盛花初的花心颜色,即整个盛花期花心颜色表型最优值,是判定绿心小菊和黄心小菊的关键指标之一,主要通过目测法和仪器测量法进行测定。
目测法:根据菊花DUS测试指南[23],结合比色卡(Royal horticultural society color chart,R.H.S.C.C.)比对花心颜色[24-25],发现花心颜色范围主要集中在绿色-黄绿色-黄色区域。
仪器测量法:参照孙卫等[26]提出的菊花舌状花颜色测定方法,选取同一开花发育时期的花序上颜色稳定的部位,多次测量取平均值。选取盛花初花心主要颜色进行测量,即测量盛花初期占花心面积最大的颜色。用KONICA MINOLTA CR-400色差仪在标准光源D65下测定盛花初花心颜色,测量口径为0.8 cm,如测量部位面积大于测量口,则直接测量取平均值,如测量部位小于测量口,则取多个颜色相似的部位拼成等于或略大于测量口径的面积进行测量;记录测量结果L、a、b、C的数值,每个试验材料选取3个重复,取平均值。
L—亮度,值越大表明所测样品表面越亮。
a—红色或绿色值,最大值为199.99,正值为红色,负值偏绿。
b―黄色或蓝色值,最大值同a,正值为黄色,负值偏蓝。
―色相角或色调角,表示具体颜色的变化。0°(360°)附近是红色区域,90°附近是黄色区域,180°(-180°)和270°(-90°)分别代表绿色和蓝色,而90°—180°是由黄色到黄绿色,再逐渐转变成绿色的过程;值与红色值(a)和黄色值(b)的关系为=arctan(b/a)。
C—色饱和度或色强度,表示距离原点的长度,越大越艳丽,越小越暗淡。C值与红色值(a)和黄色值(b)的关系为C=(a)2+(b)2[27-29]。
对杂交亲本和F1代的测量值L、a、b、C进行聚类分析,可聚为5类,结合对应的比色卡目测结果,得到绿色、浅绿色、黄绿色、浅黄绿色和黄色5个等级,花心颜色分级得分标准见表1,得到花心颜色等级得分值(简称花心颜色值)[30]。

表1 花心颜色分级得分标准
1.3.2 绿心相对面积测定 绿心相对面积:指盛花初花心绿色区域的面积占整个花心面积的百分比,用P表示,是判定绿心小菊和黄心小菊的另一个关键指标。通过比色卡目测变黄范围,再借助数显游标卡尺测量花心直径(d1)和绿心直径(d2),测量方法见《植物新品种特异性、一致性和稳定性测试指南——菊花》(2012)[23],所有测量由同一个人完成,将d1、d2代入式(1)得到绿心相对面积,每个试验材料选取3个重复,取平均值。
P=(d2/d1)2×100% (1)
1.3.3 绿心持续期测定 绿心持续期:指花心保持绿色的时间,即从初开期(外轮舌状花初步展开,成直立状,花心部分露出)到花心达到或超过40%管状花变黄的时间(d)。绿心持续期越长,绿心观赏性越高。观测方法:选取3朵大小一致,发育正常,刚露色的花序挂牌,标注株系或品种名、序号和日期,每天观察花序开放状态、花心颜色和绿心相对面积,当出现40%或以上的花心面积变成黄色进入变黄阶段时,记录花心变黄阶段日期,代入式(2)计算,取平均值。
绿心持续期=变黄阶段日期-初开期日期 (2)
1.4 杂种优势分析及显著性检验
杂种优势分别以中亲优势和中亲优势率来表示[31-33],各性状的中亲优势(m)定义为杂交F1群体的平均数(m)与中亲值(mid-parents value,)之差,即m=m-。中亲优势率(m)定义为中亲优势(m)与中亲值()的比值,即m[(m-)/]×100%。其中,中亲值()为双亲某性状的平均值。采用Excel 2010和IBM SPSS Statistics 20.0统计软件进行基本描述性数据的统计分析及样本均值检验[34]。
1.5 绿心性状的混合遗传分析
本研究以2个杂交组合的花心颜色值、绿心相对面积以及绿心持续期等3个绿心指标的平均值为基础数据进行遗传分析。采用盖钧镒等建立的植物数量性状主基因+多基因混合遗传模型分析方法中的单个F2世代分离分析方法,对杂交F1(假F2)代株系测量数据用A(一对主基因)、B(两对主基因)两类共11种遗传模型配合表型次数分布求出各种遗传模型的极大似然函数值(maximum likelihood value,MLV),由极大似然函数值计算出AIC(Akaike’s information criterion)值[16-17]。通过AIC值选择出相对最佳模型及备选模型,同时进行一组适合性检验,包括均匀性检验122232,Smirnov检验(n2)和Kolmogorov检验(n),根据AIC值最小原则和适合性检验的结果确定最优模型。根据最优模型,采用最小二乘法估计出主基因的效应值、方差、主基因遗传率等遗传参数。主基因遗传率:2mg=2mg/2p(2mg:主基因遗传率;2p:表型方差;2mg:主基因方差)。分析软件由南京农业大学国家大豆改良中心提供[32]。
2 结果
2.1 切花小菊F1代绿心性状的表型分布与杂种优势表现
由表2可以看出,2个组合F1代花心颜色值的变异系数为64.88%—90.76%,绿心相对面积指标变异系数为24.88%—28.04%,绿心持续期指标变异系数为30.96%—50.33%。各指标后代分离情况均较大,为进一步的遗传分析提供了较好的遗传差异基础。组合II的F1代各指标平均值普遍优于组合I,组合I变异程度普遍大于组合II。
从表2中的偏度和峰度以及2个组合F1群体花心颜色值、绿心相对面积和绿心持续期的次数分布图(图1、图2)可知,F1代绿心性状指标值分离广泛,基本表现为由多个正态分布组成的混合正态分布,连续性较好,表明花心颜色值、绿心相对面积和绿心持续期等绿心性状均属于由多基因控制的数量性状。
由表3发现,组合I中花心颜色值、绿心相对面积和绿心持续期的中亲优势均未达到显著水平,为-0.14、-3.42和0.11,绿心持续期出现有利的中亲优势,其他指标均未表现出有利的中亲优势。从图1可以看出,F1群体中各性状均存在正向或负向超亲个体,表明杂交后代超亲分离现象普遍存在。但是F1群体3个绿心性状的平均值均介于双亲之间(表3),说明这种超亲分离现象并未形成超亲优势。
由表4发现,组合II中花心颜色值、绿心相对面积和绿心持续期的中亲优势分别为-0.11、-10.61和-1.02,均表现为显著的负向优势,绿心持续期甚至形成负向超亲优势,超亲优势值为-0.52。组合II的绿心相关性状均表现不利的中亲或超亲优势,表明杂交F1代整体的绿心优势相比亲本未得到提高。从图2中可以看出,组合II的F1群体中各性状均存在正向或负向超亲个体,表明杂交后代超亲分离现象普遍存在,且其中有少量有利的正向超亲个体。

表2 2个杂交组合F1代绿心性状的表型特征值

图1 切花小菊‘南农丰收’ב南农红霞’杂交F1代分离群体绿心性状的频次分布图

图2 切花小菊‘南农红云’ב南农小清新’杂交F1代分离群体绿心性状的频次分布图
结合图1、图2对切花小菊2个杂交组合F1代花心颜色值的性状分离情况进行分析(表5),结果发现浅绿色和浅黄绿色杂交,无论母本是哪个颜色,后代浅黄绿色所占的比例都是最高的,到达50%左右,说明浅黄绿色遗传力较高。2个组合浅绿色与黄色的分离比例比较接近,组合I浅绿色与黄色的分离比例分别为25.93%和23.46%,组合II浅绿色与黄色的分离比例均为10%。2个组合父本颜色和母本颜色低一个等级的颜色在后代中所占比例也较高,组合I后代中父本颜色和母本颜色低一个等级的颜色所占比例分别为25.93%和23.46%,组合II后代中父本颜色和母本颜色低一个等级的颜色所占比例分别为20.00%和57.14%。2个组合后代中绿色所占比例都最低,组合I和组合II分别为3.70%和2.86%。未发现偏母性遗传的现象。
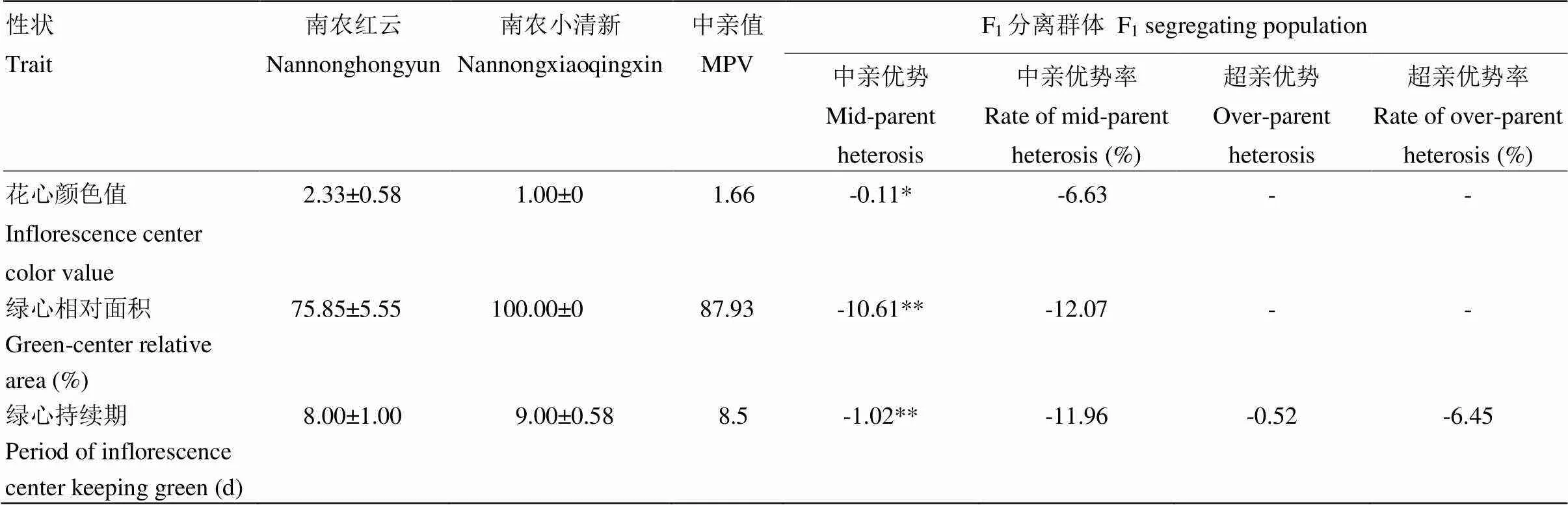
表4 切花小菊绿心性状在‘南农红云’ב南农小清新’杂交组合F1代的杂种优势表现
*表示显著差异(<0.05),**表示极显著差异(<0.01)。下同
* Indicates significant difference at<0.05 level, ** Indicates significant difference at<0.01 level. The same as below

表5 切花小菊2个杂交组合F1代花心颜色值的性状分离情况
2.2 切花小菊绿心性状最适遗传模型的适合性分析
利用植物数量性状主基因+多基因混合遗传模型单个分离世代的分离分析方法,对本研究中切花小菊2个杂交组合F1群体3个绿心性状指标表型数据均值进行混合遗传模型分析。首先计算A和B两类共11种模型与表型资料的配伍情况,得到AIC值(表6)。根据AIC最小准则,选取AIC值最小的模型以及与最小AIC值接近的模型作为备选模型。以组合II的绿心相对面积为例,比较各遗传模型下的AIC值,发现B-1模型的AIC值最小(3519.04),B-6模型(3635.3)和B-5模型(3637.3)的AIC值与最小AIC值比较接近,可将B-6模型和B-5模型作为备选最适模型,进行下一步适合性检验。
利用12、22、32、n2、n对备选模型进行适合性检验(表7、表8),选择统计量达到显著个数最少的模型作为最适模型,如果发现2个模型未达到显著水平的统计量个数相同,如组合II的绿心相对面积适合性检验,则选择AIC值最小的B-1模型,该模型比其他模型适合性更高,能够对组合I切花小菊绿心相对面积的遗传作出充分解释,可以作为组合I切花小菊绿心相对面积的最适模型,即在本研究中切花小菊绿心相对面积由2对主基因控制,主基因表现为加性-显性-上位性。同理,对2个组合3个指标进行AIC值计算及适合性检验,发现2个组合花心颜色值最适遗传模型均为B-2模型,由2对主基因控制,主基因表现为加性-显性效应;绿心相对面积和绿心持续期的最适遗传模型都是由2对主基因控制的遗传模型,但2个组合的基因效应不同,组合I绿心相对面积由B-3模型控制,2对主基因表现为加性-显性-上位性效应,绿心持续期由B-1模型控制,2对主基因表现为加性效应;绿心持续期则正好相反,绿心相对面积由B-1模型控制,绿心持续期由B-3模型控制。本研究中3个绿心性状相关指标的适合性检验统计量几乎都没有达到显著水平,说明该模型与分离群体分布吻合度非常好,有利于得到准确的遗传分析结果。

表6 2个组合F1代群体绿心性状分离分析的AIC值

表7 组合I入选模型的适合性检验
122232n2和n是适合性检验的3个统计量,其中122232为均匀性检验,n2为Smirnov检验,n为Kolmogorov检验。括号内的数值为各检验概率值。下同
12,22,32,n2andnare three statistic values for fitness test;12,22,32are the values of homogeneity testing;n2is the value of Smirnov test;nis the value of Kolmogorov test. The values in the bracket mean probability. The same as below

表8 组合II入选模型的适合性检验
2.3 切花小菊绿心性状的遗传参数估计
根据各个绿心性状或指标遗传模型参数的极大似然估计值,估计最优遗传模型的遗传参数(表9)。由表9可知,组合I中,控制花心颜色值的第1对主基因的加性效应为1.34,第2对主基因的加性效应为0.73,说明第1对主基因的加性效应显著大于第2对,加性效应以第1对为主;第1对主基因的显性效应为-1.89,第2对主基因的显性效应为-0.28,以第1对主基因的负向显性效应为主;花心颜色值总体表现负向效应,以第一对基因的显性效应为主。绿心相对面积符合2对主基因-加性模型,2对主基因只有正向加性效应,且以第1对主基因为主。绿心持续期符合2对主基因-加性-显性-上位性模型,第1对主基因加性效应为2.45,显性效应为-3.53;第2对主基因加性效应为1.23,显性效应为-0.83。两对主基因之间的加-加效应、加-显效应,显-加效应、显-显效应分别为1.22、-0.83、0.11和1.99,表明绿心持续期总体表现为增效效应,第1对主基因以负向显性效应为主,第2对主基因以正向加性作用为主,2对主基因上位性作用总体为正向增效作用。花心颜色值、绿心相对面积和绿心持续期的主基因遗传力分别为:98.64%、96.54%和66.73%。
按照同样的方法分析组合II的遗传特性,花心颜色值符合2对主基因-加性-显性模型,总体表现负向效应,以第1对主基因的负向显性效应为主;绿心相对面积符合2对主基因-加性-显性-上位性模型,总体表现正向增效效应,以第1对主基因的加性效应和2对主基因显-加效应为主。绿心持续期符合2对主基因-加性模型,2对主基因均表现正向加性效应,以第2对主基因的加性效应为主;花心颜色值、绿心相对面积和绿心持续期的主基因遗传力分别为:98.83%、95.04%和92.52%。
2个组合只有花心颜色值遗传特性基本一致,表现为负向效应,绿心相对面积和绿心持续期不同组合基因效应不同,但总体均表现为正向增效效应。
2.4 切花小菊绿心性状的相关性分析
Pearson相关分析表明3个绿心指标之间均存在极显著相关关系(表10),花心颜色值、花心相对面积和绿心持续期两两之间均呈极显著的正相关,表明花心颜色越绿,绿心相对面积越大,绿心持续期越长。
3 讨论
近年来,人们对花色遗传的研究已经很多,但普遍将花色当做质量性状进行遗传分析[11-15],研究发现花心颜色在不同的亲本之间杂交后代中有着由黄到绿丰富的过渡颜色,且通过色差仪能够准确测量出每个颜色对应的颜色参数L、a、b、、C值,这些数据连续性较好,类似数量性状的连续变异[15,29-30]。但是,这些颜色参数值无法单独表征一种颜色,又难以统一,因此在比色卡目测结果的基础上将测量的颜色值进行聚类分析,最终分为5类,采用花心颜色等级得分值进行遗传分析,既能保证数据的准确性,又能统一指标进行遗传分析[15]。对花心颜色杂种优势分析发现,在‘南农丰收’ב南农红霞’组合F1代群体中,花心颜色值中亲优势都未达到显著水平,且中亲优势是负向的,偏向母本黄心小菊;‘南农红云’ב南农小清新’组合中花心颜色值中亲优势也为负向,均偏向黄心方向,2个组合均呈现杂种优势衰退趋势。这可能是由于菊花高度杂合性,使杂交F1代基因广泛分离,继而导致F1代杂种优势衰退[11-12,14,35],也可能与不同花色的遗传能力有关。研究发现各种花色的遗传潜力由大到小依次为:紫色>红色>黄色>白色>粉色>绿色[12-14],绿色的遗传能力较低,黄色的遗传能力较高。这一点从花心颜色值性状分离情况(表5)中得到印证,F1代中浅黄绿色的个体最多,绿色个体占的比例最小。同时,父本颜色及比母本颜色低一级别的颜色也在后代中占有较大比例,与前人发现花色遗传易出现与亲本类似的颜色或过渡色的结论相一致[13],但是未发现偏母性遗传的现象。在花心颜色育种工作中选配杂交亲本时,应选择花心绿色的品种为父本,母本也应尽可能选择绿色品种或浅绿色品种。此外,从杂交后代花心颜色值的次数分布图中可以看出,花心颜色值有正向和负向的超亲个体出现,超亲优势广泛存在,为F1代优质绿心个体的选择提供了有利条件,对扩大菊花优良遗传资源具有重要意义[36]。对2个组合花心颜色指标值进行主基因+多基因混合遗传模型分析,发现2个组合花心颜色值均由2对主基因控制,2对主基因总体均表现为负向效应,主基因遗传力为98.64%—99.83%,说明花心颜色值受环境影响相对较小,适于早期选择。花心颜色值、绿心相对面积和绿心持续期两两之间均具有正相关关系,有利于集中绿心优势进行高效选育。

表9 切花小菊不同绿心性状在最优模型下遗传参数估计值
:群体均方;a:第1对主基因加性效应;b:第2对主基因加性效应;a:第1对主基因显性效应;b:第2对主基因显性效应;:加-加效应;ab:加-显效应;ba:显-加效应;:显-显效应;2p:表型方差;2mg:主基因方差;2mg:主基因遗传率
: Population mean value;a: The first couple of major-gene additive effect;b: The second major-gene additive effect;a: The first couple of major-gene dominant effect;b: The second major-gene dominant effect;: Additivity×additivity effect;ab: Additivity × dominance effect;ba: Dominance×additivity effect;: Dominance ×dominance effect;2p: Phenotypic variance;2mg: Major-gene variance;2mg: Major-gene heritability

表10 3个绿心指标的Pearson相关系数
对绿心持续期和绿心相对面积的杂种优势进行分析发现,组合I绿心持续期的中亲优势虽偏向父本绿心小菊,但没有达到显著差异,绿心相对面积的中亲优势偏向母本黄心小菊;组合II绿心相对面积和绿心持续期中亲优势均达到负向极显著差异,推测可能由于菊花高度杂合性,两亲本杂交后,其F1代基因广泛分离,从而导致F1代杂种优势衰退[11-12,14,35]。同时,在绿心持续期和绿心相对面积方面,F1代存在很多正向或负向超亲个体,为后续绿心持续期长、绿心相对面积大的单株优选提供了良好的条件。对绿心持续期和绿心相对面积等绿心相关性状进行数量性状主基因+多基因混合遗传分析,发现2个性状均由2对主基因控制,且2对主基因总体都表现为正向增效效应,绿心持续期的主基因遗传力为66.73%—92.52%,绿心相对面积的主基因遗传力为95.04%—96.54%,遗传力均较大,受环境影响小,可以在早世代进行选择[37],该结果与张飞等[34]的花期性状主基因+多基因混合遗传分析的研究结果较一致,均由2对主基因控制,但遗传模型和参数不完全一致,最终在杂种优势上的表现存在较大差异。虽然利用单个分离世代不能像多个世代联合分析方法一样可以估算多基因和环境的遗传效应,但是本研究检测到控制菊花绿心相关性状的主基因将有助于进一步理解菊花绿心性状的遗传基础,随着分子育种技术的发展,通过分子标记辅助选择会有效提高主基因选择效率,加快分子育种研究[36,38-39]。通过各指标相关性分析发现,绿心相对面积和绿心持续期呈正相关,二者与花心颜色值也呈正相关,这些相关系数大的显著相关指标可用于育种实践中的间接选择。性状的表型相关是由遗传相关和环境相关组成的[40],进一步研究分析各性状间的相关性对明确花心颜色、绿心持续期和绿心相对面积间的关系,提高育种效率起到促进作用。
4 结论
本研究对黄心×绿心(组合I)、绿心×绿心(组合II)切花小菊杂交组合F1代3个绿心性状(花心颜色值、绿心相对面积和绿心持续期)进行了杂种优势分析和数量性状主基因+多基因混合遗传分析,结果发现F1代杂种优势除组合I绿心持续期外都呈衰退趋势,但正向和负向的超亲个体普遍存在,为优株筛选提供了有利条件。花心颜色中浅黄绿色的遗传力最大,绿色遗传力最小,父本颜色及比母本颜色低一等级的颜色在后代中出现频率也较大,绿心小菊选育时应尽可能选取绿色花心品种做父母本。花心颜色值受2对主基因控制,整体表现负向效应,绿心相对面积和绿心持续期均由2对主基因控制,总体表现为正向增效效应,花心颜色值、绿心相对面积和绿心持续期的遗传力较高,受环境影响小,适于早期选择。通过相关性分析发现,花心颜色值、绿心相对面积和绿心持续期两两之间有一定正相关性,可用易测指标,如花心颜色值代替其他指标,也可以利用变异系数高且与其显著相关的性状作为指示性状,代替变异系数小的性状进行间接选择,提高育种效果。数量性状混合遗传分析有助于进一步理解切花小菊绿心性状的遗传特性,为菊花绿心性状QTL定位以及分子标记辅助育种的研究奠定基础。
[1] 李鸿渐. 中国菊花. 南京: 江苏科学技术出版社, 1993.
LI H J.. Nanjing: Jiangsu Science and Technology Press, 1993. (in Chinese)
[2] 王小光, 房伟民, 陈发棣, 滕年军. 切花小菊41个品种花粉量的测定与散粉特性分析. 园艺学报, 2013, 40(4): 703-712.
WANG X G, FANG W M, CHEN F D, TENG N J. Determination of pollen quantity and features of pollen dispersal for 41 spray cut chrysanthemum varieties., 2013, 40(4): 703-712. (in Chinese)
[3] Wang X G, WANG H B, CHEN F D, JIANG J F, FANG W M, LIAO Y, TENG N J. Factors affecting quantity of pollen dispersal of spray cut chrysanthemum ()., 2014, 14: 5.
[4] 周厚高, 王文通, 乔志钦, 王燕君, 王鸿昌, 王凤兰, 黄子锋, 何泽明. 切花小菊新品种‘缤纷’. 园艺学报, 2015, 42(1): 201-202.
ZHOU H G, WANG W T, QIAO Z Q, WANG Y J, WANG H C, WANG F L, HUANG Z F, HE Z M. A new chrysanthemum cultivar ‘Binfen’., 2015, 42(1): 201-202. (in Chinese)
[5] 朱安超. 绿心切花小菊管状花绿色形成机理研究[D]. 南京: 南京农业大学, 2014.
ZHU A C. Investigation on green-center formation mechanism of spray cut chrysanthemum [D]. Nanjing: Nanjing Agricultural University, 2014. (in Chinese)
[6] ANDERSON N O.. Berlin: Springer, 2006: 389-437.
[7] LIM J H, SHIN H K, PARK K, CHO H R, RHEE H K, KIM M S, JOUNG H Y. A new spray chrysanthemum cultivar, ‘Cherry Blossom’ with resistant to white rust, single flower type and bright pink petals for cut flower., 2008, 40(4): 439-442.
[8] 张飞, 陈发棣, 房伟民, 陈素梅, 李风童. 菊花花器性状杂种优势与混合遗传分析. 中国农业科学, 2010, 43(14): 2953-2961.
ZHANG F, CHEN F D, FANG W M, CHEN S M, LI F T. Heterosis and mixed genetic analysis of inflorescence traits of chrysanthemum., 2010, 43(14): 2953-2961. (in Chinese)
[9] SHIM S I, LIM K B, KIM C K, CHUNG M Y, KIM K M, CHUNG J D. Morphological characteristics, and coefficient of variation, heritability and genetic advance of major cultivars of spray chrysanthemum., 2016, 34(2): 269-281.
[10] CAI C C, TU J X, FU T D. The genetic basis of flowering time and photoperiod sensitivity in rapeseedL., 2008, 44(3): 326-333.
[11] 陈发棣, 蒋甲福, 郭维明. 小菊花器若干性状在F1代的表现. 园艺学报, 2003, 30(2): 175-182.
CHEN F D, JIANG J F, GUO W M, Heredity of several flower characters inwith small inflorescences., 2003, 30(2): 175-182. (in Chinese)
[12] 夏伯顺. 菊花杂交育种及后代遗传规律研究[D]. 武汉: 华中农业大学, 2009.
XIA B S. Study on cross breeding of chrysanthemum and heredity of hybrid [D]. Wuhan: Huazhong Agricultural University, 2009. (in Chinese)
[13] 陈俊愉. 园林植物品种分类学. 北京: 高等教育出版社, 2001.
CHEN J Y.. Beijing: Higher Education Press, 2001. (in Chinese)
[14] 杨云燕, 温超, 王珂永, 马男, 赵梁军. 切花菊杂交F1代若干性状的遗传分析. 中国农业大学学报, 2015, 20(5): 179-187.
Yang Y Y, WEN C, WANG K Y, MA N, ZHAO L J. Heredity analysis of several characters in F1hybrid generation of cut flower chrysanthemums., 2015, 20(5): 179-187. (in Chinese)
[15] 庞文龙, 刘富中, 陈钰辉, 连勇. 茄子果色性状的遗传研究. 园艺学报, 2008, 35(7): 979-986.
PANG W L, LIU F Z, CHEN Y H, LIAN Y. Genetic study on fruit color traits of eggplant., 2008, 35(7): 979-986. (in Chinese)
[16] 盖钧镒, 章元明, 王建康. 植物数量性状遗传体系. 北京: 科学出版社, 2003: 96-102.
GAI J Y, ZHANG Y M, WANG J K.. Beijing: Science Press, 2003: 96-102. (in Chinese)
[17] WANG J, PODLICH D W, COOPER M. Power of the joint segregation analysis method for testing mixed major-gene and polygene inheritance models of quantitative traits., 2001, 103: 804-816.
[18] 王建康, 盖钧镒. 利用杂种 F2世代鉴定数量性状主基因-多基因混合遗传模型并估计其遗传效应. 遗传学报, 1997, 24(5): 432-440.
WANG J K, GAI J Y. Identification of major gene and polygene mixed inheritance model and estimation of genetic parameters of a quantitative trait from F2progeny., 1997, 24(5): 432-440. (in Chinese)
[19] GUO Z H, DING P, HE L Y, XU C G. Genetic analysis of agricultural traits in rice related to phosphorus efficiency., 2006, 33(7): 634-641.
[20] ZHANG S F, MA C Z, ZHU J C, WANG J P, WENY C, FU T D. Genetic analysis of oil content inL. using mixed model of major gene and polygene., 2006, 33(2): 171-180.
[21] 陈四龙, 李玉荣, 程增书, 廖伯寿, 雷永, 刘吉生. 花生含油量杂种优势表现及主基因+多基因遗传效应分析. 中国农业科学, 2009, 42(9): 3048-3057.
CHEN S L, LI Y R, CHENG Z S, LIAO B S, LEI Y, LIU J S. Heterosis and genetic analysis of oil content in peanut using mixed model of major gene and polygene., 2009, 42(9): 3048-3057. (in Chinese)
[22] GRATTAPAGLIA D, SEDEROFF R. Genetic linkage maps ofandusing a pseudo-testcross: Mapping strategy and RAPD markers., 1994, 137(4): 1121-1137.
[23] 中华人民共和国农业部.植物新品种特异性、一致性和稳定性的测试指南-菊花. 2012, NY/T 2228-2012.
MINISTRY OF AGRICULTURE OF THE PEOPLE’S REPUBLIC OF CHINA. Guidelines for the conduct of tests for distinctness, uniformity and stability-chrysanthemum” (Ramat./Ramat.). 2012, NY/T 2228-2012. (in Chinese)
[24] VOSS D H. Relating colorimeter measurement of plant color to the Royal Horticultural Society Colour Chart., 1992, 27: 1256-1260.
[25] 洪艳, 白新祥, 孙卫, 贾锋炜, 戴思兰. 菊花品种花色表型数量分类研究. 园艺学报, 2012, 39(7): 1330-1340.
HONG Y, BAI X X, SUN W, JIA F W, DAI S L. The numerical classification of chrysanthemum flower color phenotype., 2012, 39(7): 1330-1340. (in Chinese)
[26] 孙卫, 李崇晖, 王亮生, 戴思兰. 菊花舌状花花色测定部位的探讨. 园艺学报, 2010, 37(5): 777-784.
SUN W, LI C H, WANG L S, DAI S L. Analysis on measuremental position of ligulate floret color of chrysanthemum., 2010, 37(5): 777-784. (in Chinese)
[27] 白新祥. 菊花花色形成的表型分析[D]. 北京: 北京林业大学, 2007.
BAI X X. Phenotype analysis of flower coloration of×Rama. [D]. Beijing: Beijing Forestry University, 2007. (in Chinese)
[28] 白新祥, 胡可, 戴思兰, 王亮生不同花色菊花品种花色素成分的初步分析. 北京林业大学学报, 2006, 28(5): 84-89.
BAI X X, HU K, DAI S L, WANG L S. Components of flower pigments in the petals of different colorRamat. cultivars., 2006, 28(5): 84-89. (in Chinese)
[29] TORSKANGERPOLL K, nØRbÆK R, NODLAND E, ØVSTEDAL D, ANDERSEN Ø. Anthocyanin content ofspecies and cultivars and its impact on petal colours., 2005, 33(5): 499-510.
[30] 王建科, 方小雪, 李雪红, 陈瑶, 万正杰, 徐跃进. 黄瓜嫩果皮颜色的遗传研究. 园艺学报, 2013, 40(3): 479-486.
WANG J K, FANG X X, LI X H, CHEN Y, WAN Z J, XU Y J. Genetic study on immature fruit color of cucumber., 2013, 40(3): 479-486. (in Chinese)
[31] 刘晓阳, 卫晓轶, 陈浩, 刘坤, 谢惠玲, 郭战勇, 付志远, 李卫华. 玉米主要植株性状的杂种优势位点分析. 中国农业科学, 2017, 50(7): 1179-1188.
LIU X Y, WEI X Y, CHEN H, LIU K, XIE H L, GUO Z Y, FU Z Y, LI W H. Identification of heterotic loci for plant traits using chromosomal segment substitution lines test population in maize., 2017, 50(7): 1179-1188. (in Chinese)
[32] 王利民, 张建平, 党照, 裴新梧, 党占海. 胡麻两系杂交亲本的配合力及杂种优势分析. 中国农业科学, 2016, 49(6): 1047-1059.
WANG L M, ZHANG J P, DANG Z, PEI X W, DANG Z H. The analysis of the parental combining ability and heterosis on two-line hybrid flax., 2016, 49(6): 1047-1059. (in Chinese)
[33] LI B L, WU R L. Heterosis and genotype×environment interactions of juvenile aspens in two contrasting sites., 1997, 27(10): 1525-1537.
[34] 张飞, 陈发棣, 房伟民, 陈素梅, 刘浦生, 尹冬梅. 菊花花期性状的杂种优势与混合遗传分析. 南京农业大学学报, 2011, 34(4): 31-36.
ZHANG F, CHEN F D, FANG W M, CHEN S M, LIU P S, YIN D M. Heterosis and mixed genetic analysis for florescence-related traits of chrysanthemum., 2011, 34(4): 31-36. (in Chinese)
[35] 彭辉, 陈发棣, 房伟民, 蒋甲福, 陈素梅, 管志勇, 廖园. 切花小菊分枝性状杂种优势表现与遗传分析. 园艺学报, 2013, 40(7): 1327-1366.
PENG H, CHEN F D, FANG W M, JIANG J F, CHEN S M, GUAN Z Y, LIAO Y. Heterosis and mixed genetic analysis of branch traits of cut chrysanthemum., 2013, 40(7): 1327-1366. (in Chinese)
[36] 许莉莉, 陈发棣, 陈素梅, 房伟民, 朱文莹, 王海滨, 李佩玲. 栽培菊花与菊属-近缘属属间杂种杂交后代耐盐性的遗传分析. 生态学报, 2013, 33(16): 4902-4908.
Xu L L, Chen F D, Chen S M, Fang W M, Zhu W Y, Wang H B, Li P L. Genetic analysis of salt tolerance of F1progenies between chrysanthemum and the intergeneric hybrid of chrysanthemum and crossostephium., 2013, 33(16): 4902-4908. (in Chinese)
[37] 张飞, 陈发棣, 房伟民, 陈素梅, 李风童. 菊花营养性状杂种优势表现与主基因+多基因混合遗传分析. 林业科学, 2011, 47(2): 46-52.
ZHANG F, CHEN F D, FANG W M, CHEN S M, LI F T. Heterosis and major gene plus polygene mixed genetic analysis for vegetative traits in chrysanthemum., 2011, 47(2): 46-52. (in Chinese)
[38] 狄佳春, 陈旭升, 赵亮, 章元明. 利用主基因+多基因混合遗传分析解析陆地棉铃重与铃壳率杂种优势的遗传基础. 棉花学报, 2016, 28(2): 115-121.
DI J C, CHEN X S, ZHAO L, ZHANG Y M. Genetic foundation of heterosis for boll weight and shell ratio in upland cotton (L.) using mixed major-genes plus polygenes inheritance analysis., 2016, 28(2): 115-121. (in Chinese)
[39] 张飞, 陈发棣, 房伟民, 陈素梅, 张鲜艳, 尹冬梅. 菊花开花持续期的QTL定位. 园艺学报, 2011, 38(8): 1557-1564.
ZHANG F, CHEN F D, FANG W M, CHEN S M, ZHANG X Y and YIN D M. QTL Mapping for flowering duration stage of chrysanthemum., 2011, 38(8): 1557-1564. (in Chinese)
[40] 孔繁玲. 植物数量遗传学. 北京: 中国农业大学出版社, 2006.
KONG F L.. Beijing: China Agricultural University Press, 2006. (in Chinese)
(责任编辑 赵伶俐)
Heterosis and Mixed Genetic Analysis of Green-center Trait of Spray Cut Chrysanthemum
ZHAO QianRu, ZHONG XingHua, ZHANG Fei, FANG WeiMin, CHEN FaDi, TENG NianJun
(College of Horticulture, Nanjing Agricultural University/Key Laboratory of Landscaping Agriculture, Ministry of Agriculture, Nanjing 210095)
【Objective】 Green-center trait is an important ornamental trait of spray cut chrysanthemum, and the study of heterosis and genetic basis of green-center trait will provide an invaluable guidance for breeding program of spray cut chrysanthemum with green center. 【Method】In this study, inheritance and heterosis analyses were carried out for three green-center traits of spray cut chrysanthemum, i.e. the score of inflorescence center color (referred to as the inflorescence center color value, the same as below), the green-center relative area, and the period of inflorescence center keeping green, respectively. They were based on phenotypic data of 81 F1population derived from yellow-center chrysanthemum cultivar ‘Nannongfengshou’ (female parent) and green-center chrysanthemum cultivar ‘Nannonghongxia’ (male parent), and 70 F1population derived from green-center chrysanthemum cultivar ‘Nannonghongyun’ (female parent) and green-center chrysanthemum cultivar ‘Nannongxiaoqingxin’ (male parent) by using single generation segregation analysis method of major gene plus polygene mixed genetic model. 【Result】 The coefficient of variation of the two F1hybrids was 24.88%-90.76%. The variation degree of Cross Combination I (yellow-center × green-center) was generally higher than that of Cross Combination II (green-center × green-center), but the average of Cross Combination II was generally better than that of Cross Combination I. In addition, the predominance of the inflorescence center color value, the green-center relative area, and the period of inflorescence center keeping green from Cross Combination I were -0.14, -3.42, and 0.11, respectively. The period of inflorescence center keeping green was positive, whereas other indicators of heterosis were negative. The predominance of the inflorescence center color value, the green-center relative area, and the period of inflorescence center keeping green from Cross Combination II were -0.11 -10.61 and -1.02, respectively. The over-parent heterosis of the period of inflorescence center keeping green was -0.52, which was worse than those of parents. There were positive and negative super-individuals in the two groups. The green inflorescence center color of F1in Cross Combination I and Cross Combination II were 3.70% and 2.86%, respectively. The paternal flower color and the color which was one level lower than maternal flower color accounted for a similar proportion in the offspring and the proportion was more than 20.00%. The inflorescence center color value, the green-center relative area, and the period of inflorescence center keeping green were controlled by two pairs of major genes. The inflorescence center color value showed the negative effect, whereas the other two indicators showed positive effect. Furthermore, the inflorescence center color value, the green-center relative area, and the period of inflorescence center keeping green were 98.64%-98.83%, 95.04%-96.54%, and 66.73%-92.52%, respectively. Finally, there was a significant positive correlation among the inflorescence center color value, the green-center relative area, and the period of inflorescence center keeping green.【Conclusion】 The heterosis and transgressive segregation of inflorescence traits commonly existed in F1hybrid progenies of chrysanthemum, so we could choose individuals that were beneficial to the breeding.The genetic potential of the green inflorescence center color was weak, and we choose the cultivars as pollen donors in order to increase the numbers of green-center offspring. In addition, the heritabilities of the inflorescence center color value, the green-center relative area, and the period of inflorescence center keeping green were high, which was suitable for the selection in early generation. Finally, the positive correlation among the indicators was useful green-center chrysanthemum breeding.
spray cut chrysanthemum; green-center traits; heterosis; major gene plus polygene; genetic analysis
2017-07-05;
2017-12-11
国家自然科学基金(31672182,31471901)、中央高校基本业务费重大专项(KYTZ201602)
赵倩茹,E-mail:582058192@qq.com。
滕年军,E-mail:njteng@njau.edu.cn

