PCI术后1年依维莫司、佐他莫斯药物涂层支架内新生内膜反应情况比较
孟培娜,叶飞,尤威,吴志明,谢渡江,张航
(南京医科大学附属南京医院 南京市第一医院,南京 210006)
经皮冠状动脉支架置入术(PCI)是冠心病的重要治疗手段,然而,支架内膜增生导致的病理生理学改变及其继发的临床不良事件大大削弱了手术疗效,是支架内再狭窄及晚期支架内血栓形成的重要原因,是评价手术疗效的重要指标之一。Xience-V依维莫司及Resolute佐他莫斯药物涂层支架是PCI术中最常用的两类支架,具有良好的安全性及有效性[1~4],然而PCI术后两者的支架内膜增生情况尚不明了。光学断层显像(OCT)可清晰观察PCI术后支架内膜增生情况。本研究通过OCT观察这两种支架PCI术后1年新生内膜反应的差异,进一步评价两种支架对手术疗效的影响。
1 资料与方法
1.1 临床资料 选择2014年1月~2016年1月在我院心内科行冠状动脉造影+PCI治疗,并在1年后进行冠状动脉造影复查+OCT检查的患者。患者在PCI术前均签署知情同意书,在术后1年复查冠状动脉造影及OCT操作前也签署知情同意书,本研究通过南京市第一医院伦理委员会审批通过。入选标准:年龄18~80岁;左心室射血分数超过40%;靶病变处单个支架可以完全覆盖病变长度;置入支架为Xience系列或Resolute支架。排除标准:严重的钙化,扭曲,开口或分叉病变;左主干病变;弥漫性病变;需要二次手术解决残留病变。依据术中置入的支架类型为依维莫司还是佐他莫斯分为X-EES组及R-ZES组。41例患者41个支架纳入该项研究,其中X-EES组23例,R-ZES组18例。X-EES组男14例、女9例,年龄(63.04±8.03)岁,高血压病史14例,糖尿病史7例,吸烟史8例,靶血管分布为前降支16例、回旋支4例、右冠状动脉3例;术中置入支架的直径为(3.18±0.38)mm,支架长度为(23.74±4.19)mm,最大预扩张压力(11.56±3.95)atm,最大预扩球囊直径(2.47±0.34)mm,后扩张22例,最大后扩压力(18.91±2.20)atm,最大后扩球囊直径(3.53±0.65)mm;术后1年总胆固醇(3.74±0.87)mmol/L,甘油三酯(1.49±0.51)mmol/L,低密度脂蛋白(1.86±0.51)mmol/L,高密度脂蛋白(1.03±0.23)mmol/L,非高密度脂蛋白(2.71±0.89)mmol/L,空腹血糖(5.35±1.18)mmol/L。R-ZES组男16例、女2例、年龄(62.56±11.59)岁,高血压病史8例,糖尿病史5例,吸烟史6例,靶血管分布为前降支12例、回旋支2例、右冠状动脉4例;术中置入支架的直径为(3.38±0.35)mm,支架长度(21.06±5.48)mm,最大预扩张压力(11.86±1.99)atm,最大预扩球囊直径(2.36±0.23)mm,后扩张18例,最大后扩压力(18.44±3.47)atm,最大后扩球囊直径(3.75±0.46)mm;术后1年总胆固醇(3.68±0.76)mmol/L,甘油三酯(1.46±0.61)mmol/L,低密度脂蛋白(1.83±0.41)mmol/L,高密度脂蛋白(1.17±0.21)mmol/L,非高密度脂蛋白(2.50±0.82)mmol/L,空腹血糖(5.56±0.95)mmol/L。两组上述资料比较P均>0.05。本研究经医院伦理委员会批准,所有患者知情同意。
1.2 新生内膜反应观察 在行冠脉造影复查术后即刻观察两组新生内膜反应情况。使用FD-OCT,在注射普通肝素后,将0.014-inch的PCI导丝放置在靶血管远端,然后腔内注射200 μg硝酸甘油。将OCT导管沿该导丝送至目标病变段以远10 mm以上,后将造影剂注入目标血管,由有经验的技师确定OCT图像质量满意后以20 mm/s的速度回撤OCT导管。在图像获取过程中,冠状动脉血流被持续注射的造影剂替代。图像获取需包括距离支架靶病变近端及远端各5 mm的区域组织。OCT靶目标选取:选取新生内膜增生最厚的横截面病变为分析截面;所有的影像资料均有数字化存储及备份,最后统一由我科核心实验室线下整理并分析,使用的线下分析软件为LightLab Imaging Inc.Westford,MA。所有的OCT图像由两位分析者独立完成,有意见不一致处重新分析并请第三位分析者讨论后给出最终结果。OCT图像分析参数包括最小管腔面积(MLA)、最小管腔直径(MLD)、最大新生内膜厚度(MNT)、最大新生内膜面积(MNA)、再狭窄率(再狭窄率=新生内膜面积/支架内管腔面积)、新生内膜同质性(OCT图像显示光学信号均匀且背散射模式无明显差异)或异质性(光学信号不均匀且背散射模式有差异)。
1.3 炎性因子检测 所有患者在PCI术后1年复查冠脉造影前3 d内完成以下指标的检测,包括IL-2、IL-6、TNF-α、超敏C反应蛋白(hs-CRP)以及血浆脂蛋白磷脂酶A2(Lp-PLA2),操作由南京市第一医院检验科统一完成。
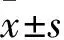
2 结果
2.1 两组PCI术后1年新生内膜反应情况比较 X-EES组、R-ZES PCI术后1年MLA分别为(6.00±0.56)、(6.29±0.61)mm2,MLD分别为(2.64±0.54)、(2.86±0.60)mm,MNT分别为(317.39±71.81)、(335.56±70.23)μm,MNA分别为(1.23±0.15)、(1.32±0.15)mm2,支架内再狭窄率分别为0.20%±0.01%、0.21%±0.01%,同质化新生内膜分别为18、10例,两组相比P均>0.05。
2.2 两组血清炎症因子水平比较 两组血清Lp-PLA2水平分别为(233.09±44.18)、(256.11±50.98)ng/mL,hs-CRP分别为(1.38±0.40)、(1.55±0.34)μg/mL,IL-2分别为(4.07±0.79)、(4.16±0.95)pg/mL,IL-6分别为(4.05±0.97)、(4.37±0.82)pg/mL,TNF-ɑ分别为(8.81±1.64)、(9.58±2.14)pg/mL,两组相比P均>0.05。
3 讨论
支架内新生内膜增生是支架置入术后必经的血管修复过程,然而,内膜的不均匀增生可能造成支架丝覆盖不全、支架内血栓、支架内再狭窄及其继发的新生内膜粥样硬化性改变,造成靶病变处理失败乃至再血管化等。因此,研究新生内膜特点对评估血管的修复反应至关重要。OCT能够清晰识别新生内膜特点,分辨率高达10~15 μm,能依据新生内膜组织成分不同导致的光学背散射和衰减系数的差异,将其分为同质性及异质性,且与不同的临床事件终点相关联[5]。同质性内膜在OCT影像上表现为高度一致的光学信号,被认为是相对稳定的新生内膜形态,预示着良好的血管修复反应;而异质性则表现为不均一的光学信号区域,被认为是不稳定性的内膜形态,预示着不成熟的血管修复反应,存在较强的可变性,与支架内血栓及新生动脉粥样硬化形成等相关[6,7]。炎症反应也可延缓血管修复过程,是参与支架内血栓及支架内再狭窄等不良反应的重要因素。本研究仅提供了术后1年随访时的炎症因子水平,无术前基础数据,无法动态观察炎症变化;其次,无法获得支架内局部炎症反应水平,这也是本项研究的局限性所在。
支架内膜增生有多种因素参与,除了患者本身的疾病特点,服药的依从性、冠状动脉病变的特点、PCI操作的差异[8,9]、支架本身构造的不同也是重要因素之一[10,11]。Xience-V及Resolute支架均是新型二代药物涂层支架,具有良好的生物相容性、柔韧性及传送性,在近十年的临床应用中有着良好的安全性及有效性[1~4]。两类支架的设计有些许不同,如两者的支架钢梁厚度不同,Xience-V支架钢梁厚度约81 μm,Resolute支架钢梁厚度约91 μm; Xience-V支架80%的依维莫司涂层在术后30 d内释放,而Resolute支架85%的佐他莫斯在术后2个月内释放。有研究[10~13]表明,新生内膜增生与钢梁厚度密切相关,钢梁越厚,新生内膜增生越明显;而支架表面的涂层药物释放的稳定性及释放时间的长短也是影响血管修复的重要因素。尽管两类支架构造存在一定的差异,但本研究两组支架内MLA、MLD、MNT、MNA、再狭窄率、同质性新生内膜比例及血清IL-2、IL-6、TNF-α、hs-CRP、Lp-PLA2水平比较差异无统计学意义,可见两组术后1年支架内膜形态学无明显差异。
本研究是一项回顾性研究,存在以下局限性:样本量相对较小,入选标准相对严格,基于回顾性研究的弊端,存在各种偏倚;同一个患者同一支架内有多个截面,本研究选取的是新生内膜增生最厚的截面,缺乏多个截面分析数据,因此缺少平均值;随访时间相对较短,而新生内膜的量与质并非一成不变,会随着时间的延长而发生变化;本研究未随访两组主要临床不良事件的差异,未能在影像学结果与临床事件结果的关联上进一步分析。因此,本研究结果需要更大规模、更长随访期的随机对照研究进一步验证。
[1] Park KW, Lee JM, Kang SH, et al. Safety and efficacy of second-generation everolimus-eluting Xience V stents versus zotarolimus-eluting Resolute stents in real-world practice: patient-related outcomes from the multicenter prospective EXCELLENT and RESOLUTE-Korea registries[J]. J Am Coll Cardiol, 2013,61(5):536-544.
[2] von Birgelen C, Basalus MW, Tandjung K, et al. A randomized controlled trial in second-generation zotarolimus-eluting Resolute stents versus everolimus-eluting Xience V stents in real-world patients: the TWENTE trial[J]. J Am Coll Cardiol, 2012,59(15):1350-1361.
[3] Serruys PW, Silber S, Garg S, et al. Comparison of zotarolimus-eluting and everolimus-eluting coronary stents[J]. N Engl J Med, 2010,363(2):136-146.
[4] Gutiérrez-Chico JL, van Geuns RJ, Regar E, et al. Tissue coverage of a hydrophilic polymer-coated zotarolimus-eluting stent vs. a fluoropolymer-coated everolimus-eluting stent at 13-month follow-up: an optical coherence tomography substudy from the RESOLUTE All Comers trial[J]. Eur Heart J, 2011,32(19):2454-2463.
[5] Kim JS, Afari ME, Ha J, et al. Neointimal patterns obtained by optical coherence tomography correlate with specific histological components and neointimal proliferation in a swine model of restenosis[J]. Eur Heart J Cardiovasc Imaging, 2014,15(3):292-298.
[6] Hou J, Jia H, Liu H, et al. Neointimal tissue characteristics following sirolimus-eluting stent implantation: OCT quantitative tissue property analysis[J]. Int J Cardiovasc Imaging, 2012,28(8):1879-1886.
[7] Ino Y, KuboT, Kitabata H, et al. Difference in neointimal appearance between early and late restenosis after sirolimus-eluting stent implantation assessed by optical coherence tomography[J]. Coron Artery Dis, 2013,24(2):95-101.
[8] Welt FG, Rogers C. Inflammation and restenosis in the stent era[J]. Arterioscler Thromb Vasc Biol, 2002,22(11):1769-1776.
[9] Inoue T, Croce K, Morooka T, et al. Vascular inflammation and repair: implications for re-endothelialization, restenosis, and stent thrombosis[J]. JACC Cardiovasc Interv, 2011,4(10):1057-1066.
[10] Fujii K, Kawasaki D, Oka K, et al. Endothelium-dependent coronary vasomotor response and neointimal coverage of zotarolimus-eluting stents 3 months after implantation[J]. Heart, 2011,97(12):977-982.
[11] Kotani J, Awata M, Nanto S, et al. Incomplete neointimal coverage of sirolimus-eluting stents: Angioscopic findings[J]. J Am Coll Cardiol, 2006,47(10):2108-2111.
[12] Mauri L, Hsieh WH, Massaro JM, et al. Stent thrombosis in randomized clinical trials of drug-eluting stents[J]. N Engl J Med, 2007,356(10):1020-1029.
[13] Soucy NV, Feygin JM, Tunstall R, et al. Strut tissue coverage and endothelial cell coverage: A comparison between bare metal stent platforms and platinum chromium stents with and without everolimus-eluting coating[J]. Eurointervention, 2010,6(5):630-637.

