α胰蛋白酶H4重链在病毒性肝炎相关性原发性肝细胞癌早期预警中的价值
胡高娃,李 波,徐 飞
肝细胞癌(hepatocellular carcinoma, HCC)是原发性肝癌中最常见的类型,占原发性肝癌的70%~90%,在恶性肿瘤中病死率居于第3位,仅次于胃癌和食道癌。90%以上的HCC病例是由慢性肝病发展而来,而其中最主要的是肝炎肝硬化,约占80%以上[1]。美国肝病研究协会推荐采用血清学标志物AFP和超声检查对肝硬化人群进行普查,以提高早期肝癌的检出率,但AFP对HCC的诊断灵敏度只有39%~65%,仅通过AFP进行普查可能会导致漏检[2]。另外,在许多慢性非恶性肿瘤患者血清中AFP浓度也有升高,采用AFP进行HCC筛查也可能导致5%假阳性。早期筛查方法灵敏度不足导致60%以上的HCC患者在晚期才被确诊,错过了治疗的最佳时期,这些被晚期确诊的HCC患者5年生存率<16%,早期接受治疗的患者5年生存率可达到75%以上[3]。如果能及时发现甚至在尚未发生HCC时对肝硬化患者进行预警,进行合适的干预,可以显著降低HCC的病死率。目前,AFP和其他HCC血清标志物在早期预警方面的价值尚不明确。
α胰蛋白酶H4重链(inter-alpha-trypsin inhibitor heavy chain 4, ITIH4)是分子量为120 kDa的血清糖蛋白,由肝脏分泌至血循液环中,属于急性时相反应蛋白。ITIH4在功能上主要参与细胞外基质(extracellular matrix, ECM)成分的分泌和形成调节。目前文献报道,ITIH4可能通过下调IL-6表达从而参与HCC的发生和发展。IL-6通过与其受体结合,继而活化胞内一系列信号蛋白分子,最终实现IL-6反应基因的表达。目前认为IL-6及其受体介导的信号通路与肿瘤的发生、发展、侵袭及转移密切相关[4-5]。在本研究中,通过对病毒性肝炎导致的肝硬化患者进行随访,验证ITIH4作为HCC早期预警和诊断标志物的应用价值。
1 对象与方法
1.1 对象 109例患者均为解放军第三〇二医院门诊和住院患者,开始研究时间为2013年1月,经过2年随访,研究结束时间为2015年12月。患者纳入标准:①具有5年以上HBV或HCV感染史;②年龄>35岁;③临床明确诊断为肝硬化且排除恶性肿瘤的患者。排除标准:①患者伴随严重的并发症和其他系统性疾病;②接受过与肝病相关的侵入性治疗方案;患者最终诊断通过MRI检查确认,所有患者均签署知情同意书,由医院伦理委员会批准实施。患者经过2年的随访,观察患者是否进展为HCC,诊断结果以MRI检测结果作为金标准,进展为HCC的患者为HCC组,未进展为HCC的患者为非HCC组。
1.2 随访方案 患者在首次纳入本研究后即进行血清样本采集,随后进行随访,每隔半年进行1次MRI检查,如确诊已进展为HCC,则随访结束,并于确诊时间点再次采集血清样本,如2年内未进展为HCC,则随访研究结束。
1.3 样本采集 清晨空腹禁水状态下抽取肘静脉血约3~5 ml于带分离胶的真空采血干燥管, 离心后分离血清备用。
1.4 实验操作 ITIH4酶联免疫吸附试剂购自武汉伊艾博科技有限公司,按试剂使用说明书操作,将试剂平衡至室温,加样孔加入样本100 μl,并设置标准孔、空白孔,混匀后,37 ℃孵育120 min,弃去液体,加溶液A100 μl,37 ℃孵育60 min,弃去液体,洗板3次,每孔加溶液B100 μl,37 ℃孵育60 min,洗板5次,加入底物液90 μl,37 ℃避光显色15 min,加终止液50 μl,用酶联仪在450 nm波长检测各孔OD值,并根据标准曲线计算ITIH4浓度。
1.5 统计学处理 用SPSS 17.0软件进行统计分析。定量资料呈正态分布者用±s表示,非正态分布者用中位数(最小值,最大值)表示,2组比较用成组t检验或Wilcoxon秩和检验,发生HCC前后比较用自身配对t检验。用ROC曲线分析ITIH4和AFP对HCC的预测价值。P<0.05表示差异有统计学意义。
2 结 果
2.1 随访结果 2组患者入组时基本情况见表1。109例患者随访2年后,共有29例发展为HCC(腹部MRI增强确诊),发病率为26.6%。患者年龄(53.9±9.7)岁,男66例(60.6%),女43例(39.4%)。103例为HBV感染导致肝硬化(94.5%),见表1。
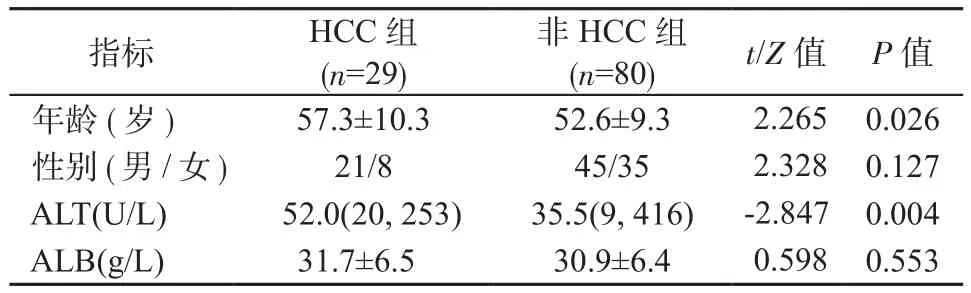
表1 HCC组与非HCC组基本情况Table 1 Basic data of group HCC and non-HCC group
2.2 ROC曲线分析 HCC组ITIH4水平低于非HCC组(P=0.000),ROC曲线显示其预测HCC的AUC为0.726(P=0.000)。HCC组AFP水平高于非HCC组(P=0.021)。AFP预测HCC的AUC为0.657(P=0.013),小于ITIH4的AUC(P=0.000),见表2和图1。
从ROC曲线获得ITIH4预警HCC的诊断界值为12.27 ng/ml,其灵敏度为40.0%,特异度为93.1%;AFP预警HCC的诊断界值为4.76 ng/ml,其灵敏度为86.2%,特异度为41.3%。
2.3 17 例患者发生HCC前后ITIH4和AFP水平变化 将17例发展为HCC的患者入组时首次检测血清和确诊为HCC时的血清ITIH4和AFP水平进行比较,发现患者ITIH4水平在发展为HCC后有所下降(P<0.05),而AFP变化差异无统计学意义。见表3。
3 讨 论
鉴于AFP的灵敏度(39%~65%)难以满足临床需求,而影像学和病理学检查价格昂贵,患者依从性差,所以近年来对HCC新的诊断标志物研究成为肿瘤诊断领域的热点。
在本文的研究中,我们通过2年的随访和样本采集检测工作,积累了HCC患者完整的序列样本,对随访患者血清进行ITIH4浓度检测,发现ITIH4在发展为HCC和未发展为HCC的肝硬化患者血清中存在显著差异,提示ITIH4具有潜在的HCC预警价值。我们同时将ITIH4与临床常用的AFP进行比较,发现ITIH4预警AUC大于AFP,但AFP灵敏度高于ITIH4,而ITIH4的特异度要高于AFP。
ITIH4属于急性时相反应蛋白,是胰蛋白酶抑制物(inter-alpha-trypsin inhibitor, ITI)的一条重链。ITI的重链包括ITIH1~ITIH5,其中ITIH4基因定位于3号染色体短臂,目前被发现与多种实体肿瘤的发生、发展及侵袭以及转移密切相关。ITIH4主要参与ECM的分泌和形成调节。我们在肝硬化患者血清中发现了该蛋白的高表达,可能与该蛋白参与ECM形成有关。ITIH4可能通过下调IL-6表达从而参与HCC的发生和发展,属于丝氨酸蛋白酶抑制剂家族成员,通过与透明质酸结合参与ECM稳定形成的过程,该蛋白由肝脏分泌至血液循环中,通过免疫学方法可以测量其在血清中的浓度。很多报道证实ITIH4在各种实体肿瘤中的表达具有差异,有研究发现,通过蛋白质组学定量技术观察大肠腺癌鼠模型血清中的差异蛋白质,发现血清ITIH4浓度在肿瘤发生过程中有显著改变,证实该蛋白具有早期诊断价值[6]。Subbannayya等[7]通过iTRAQ技术发现在胃腺癌的患者中,血清ITIH4水平显著升高。Yang等[8]则通过蛋白质谱技术发现ITIH4是乳腺癌的潜在诊断标志物。Gangadharan等[9]采用2D电泳技术对肝纤维患者和正常对照患者血清蛋白质成分进行研究,也发现了在肝纤维化患者血清中ITIH4浓度也显著升高。Noh等[10]发现ITIH4水平与HCC患者预后显著相关,其数据显示ITIH4浓度在正常对照、肝硬化和HCC患者血清中浓度存在显著差异,肝硬化和HCC患者血清浓度高于正常对照,但HCC患者血清浓度也低于肝硬化患者,说明在HCC发生后,ITIH4表达可能下调,但该报道采用的是横断面研究,其结果缺乏说服力。

表2 HCC组和非HCC组血清AFP及ITIH4水平[中位数(最小值,最大值), ng/ml]Table 2 Serum AFP and ITIH4 levels in group HCC and non-HCC group [M(min, max), ng/ml]
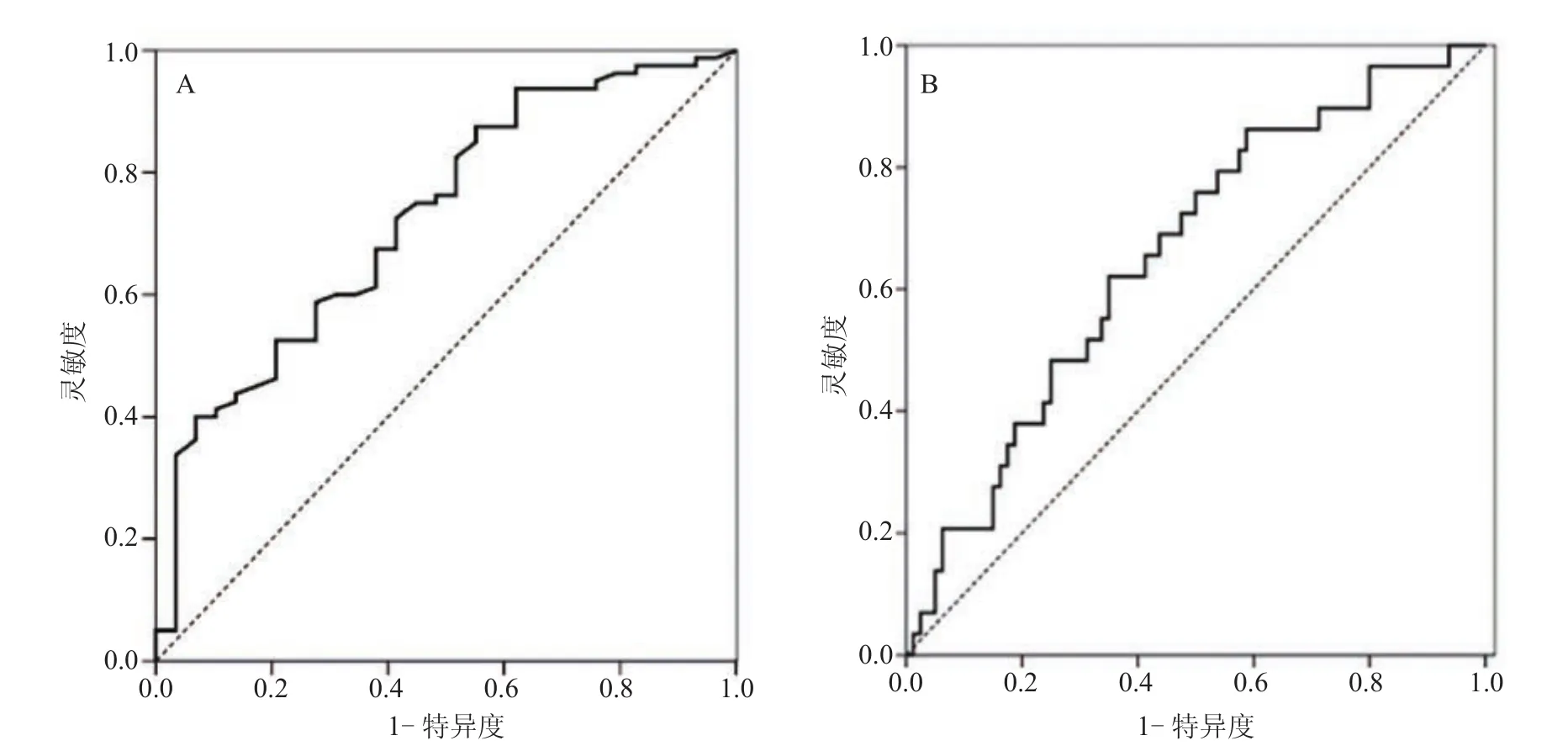
图1 ITIH4和AFP预测HCC的ROC曲线Figure 1 ROC curve of ITIH4 and AFP for predicting HCC

表3 17例患者进展为HCC前后体内ITIH4和AFP水平[中位数(最小值,最大值),ng/ml]Table 3 Serum ITIH4 and AFP levels before and after the progression of HCC in 17 patients [M(min, max), ng/ml]
本文采用前瞻性的随访研究,观察了患者在动态发展过程中ITIH4血清浓度的变化,进一步证实了该蛋白水平在发展为HCC后会显著降低,同时对不同结局的样本检测表明,HCC高风险的患者中也存在ITIH4低表达的情况。因此,该蛋白可以作为预警标志物,定期监测可以实现HCC的早发现,对肝硬化患者的预后也可以起到一定的指导意义。但本研究受样本量的影响,其结果存在一定的偏倚,后续研究须进一步扩大样本量,进行大样本、多中心和长期的随访研究,进一步明确ITIH4在HCC早期诊断和预警中的价值。
[1]Zhang Z, Zhang Y, Wang Y, et al. Alpha-fetoprotein-L3 and Golgi protein 73 may serve as candidate biomarkers for diagnosing alpha-fetoprotein-negative hepatocellular carcinoma[J]. Onco Targets Ther, 2015, 9:123-129.
[2]中华人民共和国国家卫生和计划生育委员会. 原发性肝癌诊疗规范(2017 年版). 传染病信息,2017,30(3): I-XVII.
[3]Hernandez-Gea V, Turon F, Berzigotti A, et al. Management of small hepatocellular carcinoma in cirrhosis:focus on portal hypertension[J]. World J Gastroenterol, 2013, 19(8):1193-1199.
[4]Tang Y, Kitisin K, Jogunoori W, et al.Progenitor/stem cells give rise to liver cancer due to aberrant TGF-beta and IL-6 signaling[J].Proc Natl Acad Sci USA, 2008, 105(7):2445-2450.
[5]Bhanumathy CD, Tang Y, Monga SP, et al.Itih-4, a serine protease inhibitor regulated in interleukin-6-dependent liver formation: role in liver development and regeneration[J]. Dev Dyn, 2002, 223(1):59-69.
[6]Ivancic MM, Irving AA, Jonakin KG, et al.The concentrations of EGFR, LRG1, ITIH4, and F5 in serum correlate with the number of colonic adenomas in ApcPirc/+ rats[J]. Cancer Prev Res (Phila),2014, 7(11):1160-1169.
[7]Subbannayya Y, Mir SA, Renuse S, et al. Identification of differentially expressed serum proteins in gastric adenocarcinoma[J]. J Proteomics, 2015, 127(Pt A):80-88.
[8]Yang J, Xiong X, Liu S, et al. Identification of novel serum peptides biomarkers for female breast cancer patients in Western China[J].Proteomics, 2016 , 16(6):925-934.
[9]Gangadharan B, Antrobus R, Dwek RA, et al. Novel serum biomarker candidates for liver fibrosis in hepatitis C patients[J].Clin Chem, 2007, 53(10):1792-1799.
[10]Noh CK, Kim SS, Kim DK, et al.Inter-alpha-trypsin inhibitor heavy chain H4 as a diagnostic and prognostic indicator in patients with hepatitis B virus-associated hepatocellular carcinoma[J].Clin Biochem, 2014, 47(13-14):1257-1261.

