超声内镜鉴别胃内间质瘤和平滑肌瘤的价值
李梦颖,喻 军,谢 扬,齐 健
武汉大学中南医院消化内科 武汉大学第二临床学院 湖北省肠病医学临床研究中心 肠病湖北省重点实验室,湖北 武汉 430000
胃肠道间质瘤和平滑肌瘤均为消化道黏膜下病变,在临床表现上均无特异性。平滑肌瘤是良性病变,间质瘤具有潜在恶性,两者在治疗和随访方案上存在明显区别,明确诊断可以指导患者选择合适的治疗方案。常规胃镜仅能观察到胃内黏膜下隆起型病变,无法明确其病变性质[1];CT对胃内间质瘤和平滑肌瘤的诊断有一定的价值,但由于对胃内型和微小病变检出率低,限制其应用[2]。超声内镜(endoscopic ultrasonography,EUS)可以通过病变大小、形状、起源层次、回声特征、病变与周围脏器的关系及周围是否有淋巴结肿大等特征来描述和鉴别病变[3]。本研究总结胃内间质瘤和平滑肌瘤的普通胃镜和EUS影像学资料,旨在探讨EUS对两者鉴别的诊断价值。
1 资料与方法
1.1一般资料选取武汉大学中南医院2013年3月至2015年12月经病理检查和免疫组化确诊,且病例资料完整的胃内间质瘤和平滑肌瘤患者。其中胃内间质瘤患者53例,男26例,女27例,年龄(57.9±9.5)岁(18~73岁);平滑肌瘤患者26例,男12例,女14例,年龄(50.5±14.0)岁(36~80岁)。
1.2仪器和方法采用日本Olympus公司生产260、290胃镜,记录病变部位、大小、形态、性状。采用EUS Olympus UF260,探头频率为7.5 MHz与20 MHz可调,扫查方法采用水囊法和(或)脱气水充盈法,记录病灶EUS图像特征(病变部位、起源层次、回声性质、内部回声特点等)。患者隔夜空腹,检查前口服去泡剂,检查时采取左侧卧位。先行常规内镜检查,发现胃内隆起性病变后再行EUS检查。
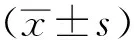
2 结果
胃内间质瘤和平滑肌瘤在普通胃镜及EUS下表现见表1。两者病变部位均以胃底和胃体多见,其病变部位分布差异无统计学意义(P=0.32)。间质瘤直径较平滑肌瘤大,两者差异有统计学意义(P<0.05)。间质瘤和平滑肌瘤在表面形态上均可表现为光滑、糜烂或溃疡,差异无统计学意义(P=0.61)。固有肌层是间质瘤最常见的起源部位,其次是黏膜肌层;而平滑肌瘤的起源部位与间质瘤相同,也是以固有肌层和黏膜肌层为主,差异无统计学意义(P=1.0)。在EUS下,间质瘤表现为低回声病灶;平滑肌瘤表现为低回声和等回声病变。在回声均匀度上,与平滑肌瘤比较,间质瘤回声非均匀度更为明显(P<0.05)。
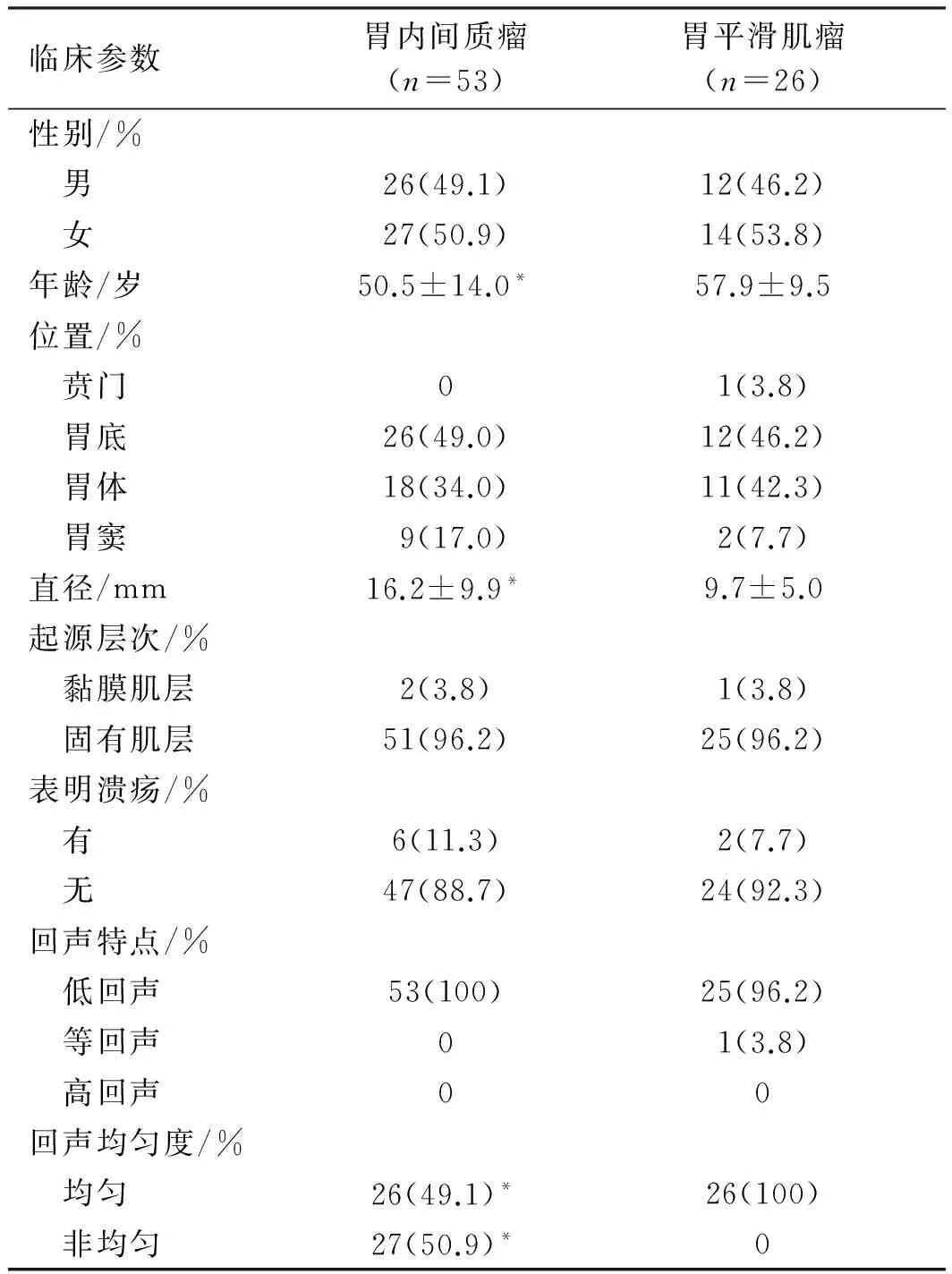
表1 胃间质瘤和平滑肌瘤在普通胃镜及EUS下表现Tab 1 Manifestations of gastric stromal tumor and leiomyoma under gastroscopy and EUS
注:与胃平滑肌瘤相比,*P<0.05。
3 讨论
胃肠道间质瘤和平滑肌瘤是胃肠道最常见的间叶源性肿瘤,也是导致黏膜下病变最常见的原因。间质瘤起源于胃肠道的卡哈尔细胞或间充质干细胞,当前认为C-kit或PDGFRA基因活化突变是引起间质瘤的重要原因。间质瘤具有动态的非定向分化和潜在恶性特点,即使是恶性潜能极低的间质瘤也有转移可能[4]。TANAKA等[5]发现1例直径为1 cm生长迅速并早期肝转移的胃内间质瘤。间质瘤在大体上多为无包膜单个结节,切面呈灰白色或灰红色,质嫩且细腻,可伴出血、坏死、囊性变等继发性改变。镜下细胞丰富,胞质淡,轻-中度嗜伊红,略嗜碱,细胞形态多变,排列结构多样。根据细胞形态特征可将其分为梭型细胞型(70%),上皮样细胞型(20%)和混合型(10%)[6]。行免疫组化检查发现,97%的胃肠道间质瘤CD117阳性,99%的DOG1阳性,81%的CD34阳性[7]。而平滑肌瘤是一种良性肿瘤,无恶变倾向。病变好发于食管中下段,瘤体常边界清楚,部分可有包膜,切面为灰白色,质地硬或韧,出血、坏死等继发性改变少见。镜下瘤细胞稀少核小,常为圆点状短梭形或长梭形,胞质极为丰富,可见强嗜伊红的斑块状或纤维状,细胞形态及排列方式几乎无多样性,间质往往可见钙化[8]。免疫组化染色后可见SMA、desmin阳性,S100、CD117、DOG1、bcl-2、ALK阴性。在临床表现方面,两者均无特异性,可出现上腹部不适、乏力、厌食等症状[9],无法从临床症状上将两者进行鉴别。
正因为两者生物学行为上差异巨大,使其诊疗策略上存在显著差异。当前NCCN、ESMO指南和中国专家共识都强调对于胃内间质瘤患者,应在临床评估基础上综合考虑后决定治疗方式,主张对于直径≥2 cm局限性胃内间质瘤,在无手术禁忌证时行手术切除;对于直径<2 cm局限性胃内间质瘤,则可先行EUS检查评估是否有高危表现(例如:边界不规整、囊性、溃疡、强回声及异质性)。若存在高危表现,建议行手术治疗;若无高危表现可以定期随访观察,若在随访中发现肿瘤变大,或患者出现腹痛、出血等临床表现则需行手术治疗。虽然当前开腹手术完整切除肿瘤是治疗胃肠道间质瘤的首选方案,但因为胃肠道间质瘤呈外生性生长,很少发生淋巴结转移,一般无需进行淋巴结清扫且肿瘤切缘距离与患者生存率之间无明显关系等特点,使内镜下治疗胃肠道间质瘤成为可能。尤其近年来,随着消化内镜器械和内镜下治疗技术不断进步发展,越来越多关于内镜下治疗胃肠道间质瘤研究得到开展。众多研究[10-11]表明,对于直径<5 cm呈胃内型生长、活动度可,并且无邻近或远处器官淋巴结转移的间质瘤可行内镜下切除治疗,且该治疗方案相较与传统开腹手术和腹腔镜手术相比,具有治疗创伤性小、费用低、术后恢复快、可保留正常解剖结构等优点,有望成为新的选择。平滑肌瘤是良性肿瘤,无复发转移风险,无需术前、术后辅助治疗,若非瘤体增长过大或产生压迫症状需行内镜下治疗或外科手术治疗外,一般无特殊处理。因此,术前间质瘤和平滑肌瘤鉴别诊断十分重要。
病理检查和免疫组化是鉴别间质瘤和平滑肌瘤的金标准。超声内镜下细针穿刺技术(EUS-FNA)是鉴别诊断黏膜下肿瘤的一个重要方法,现已用于间质瘤术前诊断[12-13]。AKAHOSHI等[13]发现,对于直径>2 cm的胃肠道间质瘤,EUS-FNA诊断的正确率在81%以上。对于直径>2 cm的局限性胃内间质瘤和平滑肌瘤,行EUS-FAN有重要鉴别诊断价值。但是LEVY等[14]在对EUS-FNA用于术前黏膜下病变诊断准确性进行研究时发现,对于直径<2 cm的黏膜下病变,EUS-FAN存在操作困难、合格病理标本获取率低、假阴性率过高等问题。因为胃肠道间质瘤质脆且易出血或播散,无论是NCCN指南还是国内专家共识,对于原发能切除的病灶不推荐活检。因此,对于直径<2 cm的病变性质不明的黏膜下占位性病变是否需要进行特殊干预难以给出明确的指导。EUS为无创检查方法,可通过观察病变起源层次、大小、回声特点协助病变性质诊断及治疗方式的选择。如能通过比较胃内间质瘤和平滑肌瘤EUS特点,发现其中不同,为鉴别诊断提供有利的依据,则可使平滑肌瘤患者免于切除治疗,而对直径较小的间质瘤则可早期诊断、早期干预。
本研究数据显示,在胃的隆起性病变中,间质瘤较平滑肌瘤多见,与国内报道[15]一致。两者在普通内镜下均表现为圆形或椭圆形黏膜下肿块,部分可见表面糜烂或溃疡,鉴别诊断困难。在EUS下,间质瘤多起源于固有肌层,少数起源于黏膜肌层,呈圆形或椭圆形团块,可出现均匀低回声、不均匀回声、低回声中有高回声等诸多表现;而平滑肌瘤常表现为起源于黏膜肌层或固有肌层的低回声病变,内部回声均匀,包膜完整。对两者内镜下特点进行仔细分析发现,两者在胃内病变部位分布及起源层次上差异无统计学意义。在肿瘤大小方面,间质瘤直径大于平滑肌瘤,差异有统计学意义。表面溃疡是鉴别良恶性胃肠道间质瘤重要依据,常常作为鉴别间质瘤和平滑肌瘤的标准[16],但在本研究中间质瘤和平滑肌瘤在此方面差异无统计学意义,考虑可能是因为胃内间质瘤多为小间质瘤,呈惰性生长,行为上偏良性,故而未表现出特殊差异。在内部回声特点上,两者差异有统计学意义,特别是低回声中有高回声这一超声影像学表现仅见于间质瘤,而平滑肌瘤中未发现。根据超声学基本原理,我们分析由于超声的回声特点是由界面声阻抗差决定,而介质的密度和声速是影响阻抗差的重要因素,界面两侧密度相差越大,声速越快,则声阻抗越高,回声图信号越高。而完全均质的介质因不产生反射和散射,声像图表面为无回声或均匀低回声图[17],因此,在黏膜下肿瘤中,细胞的多少,排列是否紧密,有无液化坏死、钙化及纤维细胞成分的多少是构成超声界面的因素,也是构成超声图像的病理基础。正如前文中所述,与平滑肌瘤比较,间质瘤细胞更为丰富,细胞的形态和排列方式更为多变,且发生继发性改变更为多见,因而导致两者在回声特点上的差异。孙世伟等[18]、王丹娜等[19]等对上消化道间质瘤和平滑肌瘤EUS图像的计算机分析也发现,间质瘤回声较平滑肌瘤强,且回声比平滑肌瘤更不均匀。
综上所述,EUS可以准确定位显示病变特点,在EUS下胃内间质瘤和平滑肌瘤在回声特点上有显著差异,间质瘤回声图像更为多样,其回声不均匀更为明显。鉴于直径<2 cm的胃肠道间质瘤也可发生早期转移,对于胃内EUS下表明为起源于固有肌层回声不均匀,尤其是低回声中高回声病变考虑胃肠道间质瘤可能性大,建议行内镜下切除治疗以明确诊断并同时达到治疗目的或行更为密切的随访;而对于回声均匀、边界清晰、直径<2 cm的固有肌层病灶,诊断考虑平滑肌瘤可能性大,可建议患者随访。总之,EUS可为胃内直径<2 cm的间质瘤和平滑肌瘤的鉴别和临床决策提供有力依据。
[1] MIETTINEN M, LASOTA J. Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis [J]. Arch Pathol Lab Med, 2006, 130(10): 1466-1478. DOI: 10.1043/1543-2165(2006)130[1466:GSTROM]2.0.CO;2.
[2] 翁军伟, 王健, 厉锋, 等. CT在胃平滑肌瘤和胃间质瘤鉴别诊断中的价值[J]. 中华肿瘤杂志, 2017, 39(2): 139-144. DOI: 10.3760/cma.j.issn.0253-3766.2017.02.013.
WENG J W, WANG J, LI F, et al. Value of CT imaging in the differentiation of gastric leiomyomas from gastric stromal tumors [J]. Chin J Oncol, 2017, 39(2): 139-144. DOI: 10.3760/cma.j.issn.0253-3766.2017.02.013.
[3] PAPANIKOLAOU I S, TRIANTAFYLLOU K, KOURIKOU A, et al. Endoscopic ultrasonography for gastric submucosal lesions [J]. World J Gastrointest Endosc, 2011, 3(5): 86-94. DOI: 10.4253/wjge.v3.i5.86.
[4] JO V Y, DOYLE L A. Refinements in sarcoma classification in the current 2013 World Health Organization classification of tumours of soft tissue and bone [J]. Surg Oncol Clin N Am, 2016, 25(4): 621-643. DOI: 10.1016/j.soc.2016.05.001.
[5] TANAKA J, OSHIMA T, HORI K, et al. Small gastrointestinal stromal tumor of the stomach showing rapid growth and early metastasis to the liver [J]. Dig Endosc, 2010, 22(4): 354-356. DOI: 10.1111/j.1443-1661.2010.01032.x.
[6] VIRANI N, PANG J, LEW M. Cytologic and immunohistochemical evaluation of low-grade spindle cell lesions of the gastrointestinal tract [J]. Arch Pathol Lab Med, 2016, 140(10): 1038-1044. DOI: 10.5858/arpa.2016-0235-RA.
[7] TAN Y, TRENT J C, WILKY B A, et al. Current status of immunotherapy for gastrointestinal stromal tumor [J]. Cancer Gene Ther, 2017, 24(3): 130-133. DOI: 10.1038/cgt.2016.58.
[8] 侯英勇, 陶琨, 谭云山, 等. 消化道平滑肌肿瘤临床病理及形态学研究[J]. 诊断病理学杂志, 2002, 9(5): 277-280. DOI: 10.3969/j.issn.1007-8096.2002.05.009.
HOU Y Y, TAO K, TAN Y S, et al. Clinicopathologic and morphologic study on smooth muscle tumors in alimentary tract [J]. J Diag Pathol, 2002, 9(5): 277-280. DOI: 10.3969/j.issn.1007-8096.2002.05.009.
[9] 宁建文, 季峰, 王丽君, 等. 265例胃肠道间叶源性肿瘤的临床病理特征及超声内镜诊断价值[J]. 中华消化杂志, 2006, 26(6): 381-385. DOI: 10.3760/j.issn:0254-1432.2006.06.006.
NING J W, JI F, WANG L J, et al. The clinicopathologic characteristics of gastrointestinal mesenchymal tumor and the diagnostic value of endoscopic ultrasonography [J]. Chin J Dig, 2006, 26(6): 381-385. DOI: 10.3760/j.issn:0254-1432.2006.06.006.
[10] 马娟娟, 谢芳, 白岚. 胃小间质瘤的内镜治疗价值对比研究[J]. 中华消化内镜杂志, 2016, 33(4): 215-218. DOI: 10.3760/cma.j.issn.1007-5232.2016.04.004.
MA J J, XIE F, BAI L. Therapeutic value of endoscopical therapy for small gastric stromal tumor [J]. Chin J Dig Endosc, 2016, 33(4): 215-218. DOI: 10.3760/cma.j.issn.1007-5232.2016.04.004.
[11] 郭花, 汤姗, 王晓伟, 等. 消化道黏膜下肿物内镜下切除及其并发症防治[J]. 胃肠病学和肝病学杂志, 2014, 23(10): 1220-1223. DOI: 10.3969/j.issn.1006-5709.2014.10.032.
GUO H, TANG S, WANG X W, et al. Endoscopic resection of gastrointestinal submucosal tumor and the prevention of complications [J]. Chin J Gastroenterol Hepatol, 2014, 23(10): 1220-1223. DOI: 10.3969/j.issn.1006-5709.2014.10.032.
[12] AKAHOSHI K, OYA M. Gastrointestinal stromal tumor of the stomach: how to manage? [J]. World J Gastrointest Endosc, 2010, 2(8): 271-277. DOI: 10.4253/wjge.v2.i8.271.
[13] AKAHOSHI K, SUMIDA Y, MATSUI N, et al. Preoperative diagnosis of gastrointestinal stromal tumor by endoscopic ultrasound-guided fine needle aspiration [J]. World J Gastroenterol, 2007, 13(14): 2077-2082.
[14] LEVY M J, JONDAL M L, CLAIN J, et al. Preliminary experience with an EUS-guided trucut biopsy needle compared with EUS-guided FNA [J]. Gastrointest Endosc, 2003, 57(1): 101-106. DOI: 10.1067/mge.2003.49.
[15] 齐志鹏, 钟芸诗, 周平红, 等. 上消化道不同部位黏膜下肿瘤的临床病理学特征[J]. 中华消化内镜杂志, 2016, 33(6): 362-366. DOI: 10.3760/cma.j.issn.1007-5232.2016.06.004.
QI Z P, ZHONG Y S, ZHOU P H, et al. Clinicopathological features of submucosal tumors in different upper gastrointestinal locations [J]. Chin J Dig Endosc, 2016, 33(6): 362-366. DOI: 10.3760/cma.j.issn.1007-5232.2016.06.004.
[16] RODRIGUEZ S A, FAIGEL D O. Endoscopic diagnosis of gastrointestinal stromal cell tumors [J]. Curr Opin Gastroenterol, 2007, 23(5): 539-543. DOI: 10.1097/MOG.0b013e32829fb39f.
[17] 陈思平, 牛凤岐. 超声医学基础[J]. 中华医学超声杂志(电子版), 2009, 6(1): 206-212. DOI: 10.3969/j.issn.1672-6448.2009.01.047.
CHEN S P, NIU F Q. Ultrasound medical foundation [J]. Chin J Med Ultrasound (Electronic Edition), 2009, 6(1): 206-212. DOI: 10.3969/j.issn.1672-6448.2009.01.047.
[18] 孙世伟, 孙思予, 葛楠, 等. 食管贲门部间质瘤和平滑肌瘤内镜超声图像的计算机分析[J]. 中华消化内镜杂志, 2010, 27(9): 469-471. DOI: 10.3760/cma.j.issn.1007-5232.2010.09.009.
SUN S W, SUN S Y, GE N, et al. Computer assisted analysis of EUS images from stromal tumor and leiomyoma in esophagus and cardia [J]. Chin J Dig Endosc, 2010, 27(9): 469-471. DOI: 10.3760/cma.j.issn.1007-5232.2010.09.009.
[19] 王丹娜, 方维丽, 李姝, 等. 上消化道黏膜下病变超声内镜诊断与内镜黏膜下剥离术后病理结果的对比研究[J]. 中华消化内镜杂志, 2016, 33(6): 367-370. DOI: 10.3760/cma.j.issn.1007-5232.2016.06.005.
WANG D N, FANG W L, LI S, et al. A comparative study of endoscopic ultrasonography and pathology for upper gastrointestinal submucosal lesions [J]. Chin J Dig Endosc, 2016, 33(6): 367-370. DOI: 10.3760/cma.j.issn.1007-5232.2016.06.005.

