黏蛋白1表达与β-连环蛋白异位在结直肠癌中的临床意义
韩 波,贾 政,耿 宇
乌兰察布市中心医院普外科,内蒙古 集宁 012000
结直肠癌是一种最常见的消化道恶性肿瘤,发病率在所有恶性肿瘤中已跃居第2位[1]。结直肠癌发病隐匿、表现不典型,确诊时已有超过25%Ⅱ期患者发生转移,其5年存活率低于65%。结直肠癌的治疗在Ⅰ期、Ⅱ期患者以手术切除为主,Ⅲ期辅以放疗和化疗[2-3]。但患者由于身体素质、局部复发和全身转移等因素的影响,使得尽管传统结直肠癌临床分期或分型相同的患者,其术后结局差别也很大。因此,寻找判断结直肠癌患者术后结局和预后的生物标志物显得尤其重要。
黏蛋白1(mucin 1, MUC1)是一种结构性跨膜蛋白,具有高度糖基化的胞外结构域。生理状态下,MUC1主要表达于各种腺体或腔道,如乳腺、食管、胃、十二指肠、空回肠、结肠、胰腺、前列腺和肺等上皮细胞的顶缘,从而对上皮细胞起到保护作用,并在信号传导过程中发挥重要作用。近年的研究[4-6]发现, MUC1在多种肿瘤细胞内存在过表达的情况,并且由于癌巢内瘤细胞极性的丧失,MUC1呈现全细胞膜和胞浆共同分布的现象。但MUC1在癌细胞内表达和分布改变的临床意义仍不清楚。β-连环蛋白(β-catenin)是一种上皮细胞间连接分子,通常表达于细胞膜上,如果出现于胞浆或胞核,称为异位表达。生理情况下,β-catenin与E-cadherin结合锚定在细胞膜上,构成细胞间连接的主要结构基础,在调控细胞间黏附中发挥重要作用。肿瘤细胞内发现,β-catenin与E-cadherin解离细胞间链接破坏,除此之外,异位的β-catenin入核后,通过启动Wnt信号通路加快肿瘤的上皮-间质转化,在肿瘤浸润、侵袭和转移中发挥作用[7-8]。本研究以67例结直肠癌患者的石蜡标本为研究对象,通过免疫组织化学染色,结合患者的临床数据,探讨MUC1在结直肠癌中表达的临床意义及是否与Wnt/β-catenin信号通路有关。
1 资料与方法
1.1一般资料选取乌兰察布市中心医院2010年8月1日至2013年8月1日病理检查确诊为结直肠癌且临床资料齐全的石蜡组织标本67例纳入本研究。男35例,年龄(62.7±9.2)岁;女32例,年龄(63.7±9.4)岁;其中结肠癌45例,直肠癌22例;高分化腺癌34例,中分化腺癌23例,低分化腺癌10例;所有患者术前均未接受任何放疗或化疗。
1.2免疫组化检测MUC1和β-catenin的表达所有标本用质量浓度为40 g/L的多聚甲醛缓冲液固定,石蜡包埋,4 μm连续切片,HE染色确定标记部位。应用MUC1兔抗人单克隆抗体(福州迈新生物有限公司)和β-catenin兔抗人单克隆抗体(福州迈新生物有限公司),严格按照试剂盒操作步骤,全自动免疫组化机进行染色操作。
1.3判定标准MUC1阳性表达判定[6]:细胞膜和(或)细胞质内有棕黄色颗粒沉着为阳性细胞。根据阳性细胞数和阳性细胞着色深度进行综合评分:未见阳性细胞为0分,<30%计1分,30%~ 60%计2分,61%~74%计3分,≥75%计4分;基本不着色为0分,淡黄色计1分,黄色计2分,棕色计3分。MUC1阳性评分值=阳性细胞数×染色强度,每例标本至少计数3个视野,求平均数,<3分为阴性,≥3分为阳性。
β-catenin异位阳性判定[9]:β-catenin表达于正常肠上皮细胞膜上,如果细胞膜表达下降,细胞浆和(或)细胞核出现棕黄色颗粒沉着为异位阳性表达。评分标准:≥70%细胞膜染色阳性计0分,<70%细胞膜染色阳性或≥70%细胞膜染色阳性但<10%胞质染色阳性计1分,≥10%细胞质染色阳性计2分,≥10%细胞核染色阳性计3分,≥10%细胞质和细胞核染色阳性计4分。每例标本至少计数3个视野,求平均数,<2分为阴性,≥2分为阳性。
1.4统计学处理采用SPSS 19.0软件包进行处理。计数资料采用χ2检验;计量资料采用t检验;MUC1与β-catenin阳性表达评分的相关性采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
2.1MUC1阳性表达和β-catenin异位与患者临床特征的关系结直肠癌组织中肠上皮细胞极性排列的分布状态在部分区域丧失,且有丝分裂象明显。MUC1的表达不再局限于肠上皮细胞面向腔道的顶端细胞膜,而是向全细胞扩散,并在胞浆中出现(见图 1A~1B)。与癌周正常组织比较,MUC1的阳性表达显著增加(20.9%vs64.2%,P<0.05),并显著影响肿瘤的分化程度(χ2=8.696,P=0.013)和淋巴结转移情况(χ2=3.963,P=0.047)。结直肠癌组织中局限于肠上皮细胞膜上表达的β-catenin向胞浆,甚至细胞核异位(见图 1C~1D)。癌周正常组织β-catenin几乎全部集中表达在细胞膜上,很少出现异位现象(4.5%vs68.7%,P<0.05)。癌组织中β-catenin的表达显著影响肿瘤的分化程度(χ2=9.393,P<0.05)、浸润深度(χ2=5.235,P<0.05)和淋巴结转移情况(χ2=11.015,P<0.05)(见表1)。
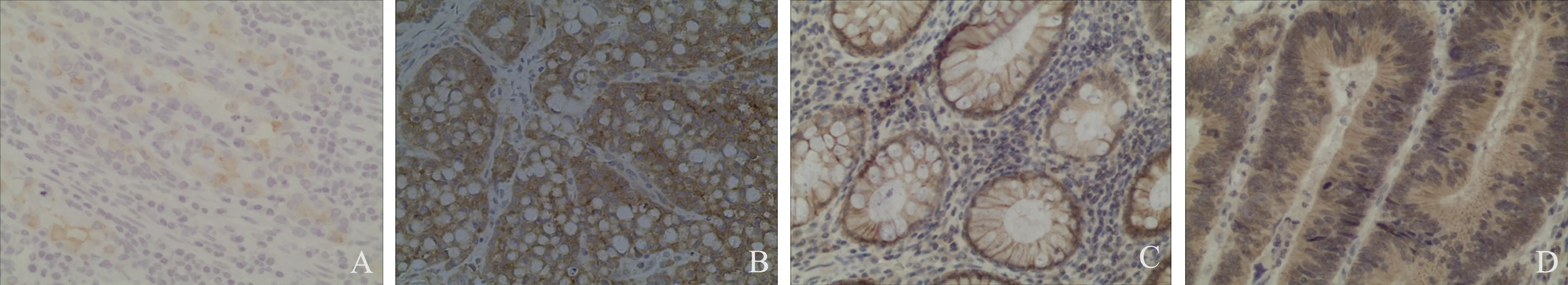
图1 MUC1表达和β-catenin异位情况(200×) A:MUC1在结直肠癌旁正常组织的阴性表达;B:MUC1在结直肠癌中的阳性表达;C:β-catenin在结直肠癌旁正常组织的正常表达;D:β-catenin在结直肠癌中的阳性异位表达Fig 1 The expressions of MUC1 and β-catenin heterotopia(200×) A: the negative expression of MUC1 in peritumoral normal tissue of colorectal carcinoma; B: the positive expression of MUC1 in colorectal carcinoma; C: the normal expression of β-catenin heterotopia in peritumoral normal tissue of colorectal carcinoma; D: the positive ectopic expression of β-catenin heterotopia in colorectal carcinoma
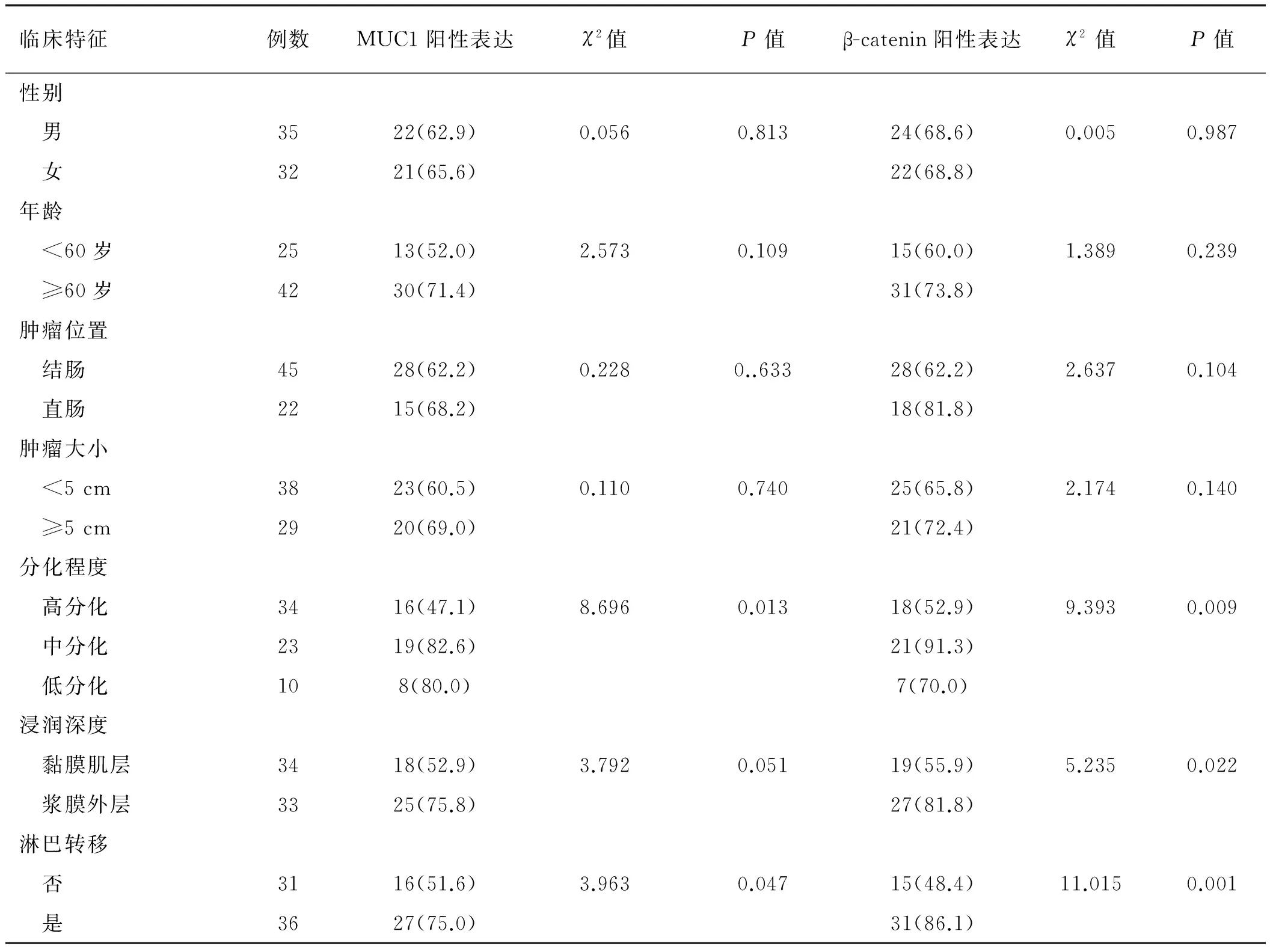
Tab 1 The influence of MUC1 expression and β-catenin heterotopia on clinical and pathological features of patients with colorectal carcinoma 比例/%
2.2结直肠癌组织中MUC1表达与β-catenin异位的相关性分析结直肠癌组织中MUC1表达的积分值与β-catenin异位阳性积分值的Pearson相关分析表明,MUC1的表达与β-catenin异位呈显著正相关(R2=0.208,P<0.05,见图2)。
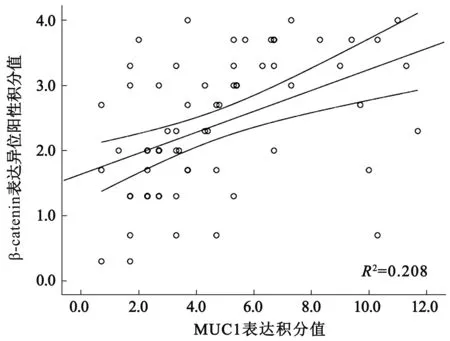
图2 结直肠癌组织中MUC1表达与β-catenin异位相关性分析Fig 2 The analysis of Pearson between MUC1 expression and β-catenin heterotopia in colorectal carcinoma tissue
3 讨论
大量基础和临床研究[2,4-6, 10]发现,MUC1在肺癌、肾癌、胰腺癌、前列腺癌中表达显著升高,并通过Wnt信号通路启动上皮-间质转化,参与癌细胞的浸润、侵袭、转移等过程,与患者的不良预后密切相关。我们以结直肠癌患者手术切除组织石蜡标本为对象的研究发现,结直肠癌组织中肠上皮细胞极性排列状态破坏,MUC1的表达不再局限于肠上皮细胞面向腔道的顶端细胞膜,而是向全细胞扩散,并在胞浆中出现,与癌周组织比较,MUC1的阳性表达大量增加,并显著影响肿瘤的分化程度和淋巴结转移情况;此外,癌组织中β-catenin表达向胞浆,甚至细胞核异位。β-catenin的异位表达显著影响肿瘤的分化程度、浸润深度和淋巴结转移情况。因此,MUC1的表达上调和β-catenin的异位表达都预示患者的不良预后。MUC1表达与β-catenin异位的相关性分析显示,两者呈显著正相关。这些结果提示,MUC1可能通过Wnt信号传导的关键分子β-catenin异位参与结直肠癌患者不良预后的进展过程。
MUC1是一种结构性跨膜糖蛋白,参与机体的多种生物学过程。但MUC1并没有直接DNA结合结构域,而是通过多种核转录因子启动基因的表达与调控。近年研究[7-10]发现,多种肿瘤细胞内MUC1表达增加,可抑制β-catenin与E-cadherin的结合,破坏细胞间连接的稳定性,出现抗细胞间黏附效应,促进癌细胞的逃逸和转移。此外,MUC1与β-catenin相互作用的结果引起β-catenin由细胞膜向细胞核转移,然后β-catenin作为核转录因子启动Wnt信号的传导。大量基础研究[10-11]发现,细胞核内的β-catenin与DNA结合蛋白,如T细胞因子/淋巴增强因子家族,形成复合物,进而调控c-myc、cyclin D1、MMP-7等基因的转录[10]。β-catenin由细胞膜转移入核启动基因转录的过程也即开始肿瘤细胞的上皮-间质转化,在肿瘤细胞的增殖、浸润、侵袭和转移的过程中发挥重要作用。这种现象已在乳腺癌、肝癌等肿瘤的进展过程中得到证实[12-13]。我们的研究也发现,结直肠癌组织中MUC1表达显著增加,并与β-catenin异位密切相关,这些改变也影响着肿瘤的侵袭行为。但目前的研究仅局限于临床观察,还缺乏MUC1和β-catenin之间相互作用的直接实验证据。此外,报道[10]证实,肾癌细胞MUC1表达显著增加,通过Wnt信号经典的SNAIL机制,引起上皮-间质转化,促进肿瘤的侵袭和浸润。考虑到β-catenin和SNAIL信号传导过程中具有共同的调控分子GSK3β,结直肠癌瘤细胞的侵袭与浸润是否也会有MUC1/SNAIL机制启动Wnt信号传导进程,值得进一步探讨。
总之,本研究在结直肠癌患者手术切除标本中证实,MUC1高表达与β-catenin异位呈显著正相关,二者显著影响肿瘤的侵袭行为,并可作为判断结直肠癌患者不良预后的危险因素。
[1] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65(1): 5-29.DOI: 10.3322/caac.21254.
[2] ZENG Y, ZHANG Q, ZHANG Y,et al. MUC1 predicts colorectal cancer metastasis: a systematic review and meta-analysis of case controlled studies[J]. PLoS One, 2015, 10(9): e0138049.DOI: org/10.1371/journal.pone.0138049.
[3] 温国华, 李燕玲, 陈倩雅. 环氧合酶-2 蛋白和核因子κB在结肠癌中的表达及相关性研究[J]. 胃肠病学和肝病学杂志, 2017, 26(8): 879-881. DOI: 10.3969/j.issn.1006-5709.2017.08.010.
WEN G H, LI Y L, CHEN Q Y. Expressions of cyclooxygenase-2 protein and nuclear factor-kappa B in colon cancerand their correlation[J].Chin J Gastroenterol Hepatol, 2017, 26(8): 879-881. DOI: 10.3969/j.issn.1006-5709.2017.08.010.
[4] RIVALLAND G, LOVELAND B, MITCHELL P. Update on Mucin-1 immunotherapy in cancer: a clinical perspective[J]. Expert Opin Biol Ther, 2015, 15(12): 1773-1787.DOI:10.1517/14712598.2015.1088519.
[5] GROVER P, NATH S, AHMAD M, et al. In pancreatic cancer, MUC1 regulates function of TGF-β and thus enhances metastasis [J]. Cancer Res, 2015, 75(15): 2054-2054. DOI: 10.1158/1538-7445.
[6] KESARI M V, GAOPANDE V L, JOSHI A R, et al. Immunohistochemical study of MUC1, MUC2 and MUC5AC in colorectal carcinoma and review of literature [J]. Indian J Gastroenterol, 2015, 34(1): 63-67.DOI: 10.1007/s12664-015-0534-y.
[7] NAGARAJ A B, JOSEPH P, KOVALENKO O, et al. Critical role of Wnt/β-catenin signaling in driving epithelial ovarian cancer platinum resistance[J]. Oncotarget, 2015, 6(27): 23720-23734.DOI: 10.18632/oncotarget.4690.
[8] 戚红霞, 潘晓燕. CD133、β-catenin 和 hTERT 在胃癌及癌前病变中的表达及相关性研究[J]. 胃肠病学和肝病学杂志, 2017, 26(9): 981-985. DOI: 10.3969/j.issn.1006-5709.2017.09.006.
QI H X, PAN X Y. Correlation study of CD133, β-catenin and hTERT expressions in gastric cancer and precancerous lesion [J]. Chin J Gastroenterol Hepatol, 2017, 26(9): 981-985. DOI: 10.3969/j.issn.1006-5709.2017.09.006.
[9] 刘娟, 欧玉荣, 景桂英, 等. β-catenin和E-cadherin 在结直肠癌中的表达及其临床意义[J]. 中国组织化学与细胞化学杂志, 2013, 22(3): 234-240. DOI: 10.3870/zgzzhx.2013.03.012.
LIU J, OU Y R, JING G Y, et al. Expression of β-catenin and E-cadherin in colorectal cancer and their clinical significance [J].Chinese Journal of Histochemistry and Cytochemistry, 2013, 22(3): 234-240. DOI: 10.3870/zgzzhx.2013.03.012.
[10] GNEMMI V, BOUILLEZ A, GAUDELOT K, et al. MUC1 drives epithelial-mesenchymal transition in renal carcinoma through Wnt/β-catenin pathway and interaction with SNAIL promoter [J]. Cancer Letters, 2014, 346(2): 225-236. DOI: 10.1016/j.canlet.2013.12.029.
[11] BRUUN J, KOLBERG M, NESLAND J M, et al. Prognostic significance of β-catenin, E-cadherin, and SOX9 in colorectal cancer: results from a large population-representative series [J]. Front Oncol, 2014, 5(4): 118-133. DOI: 10.3389/fonc.2014.00118.
[12] ZHANG Q, BAI X, CHEN W, et al. Wnt/β-catenin signaling enhances hypoxia-induced epithelial-mesenchymal transition in hepatocellular carcinoma via crosstalk with hif-1α signaling [J]. Carcinogenesis, 2013, 34(5): 962-973.DOI: 10.1093/carcin/bgt027.
[13] KUMAR K J, VANI M G, CHUEH P J, et al. Antrodin C inhibits epithelial-to-mesenchymal transition and metastasis of breast cancer cells via suppression of Smad2/3 and β-catenin signaling pathways [J]. PLoS One, 2015, 10(2): e0117111. DOI:10.1371/journal.pone.0117111.

