透明帽辅助的内镜黏膜下切除术与内镜黏膜下剥离术治疗直肠神经内分泌肿瘤效果的回顾性分析
杨永涛,李连勇,陈 琰,钟长青,王晓英,梁淑文,屈昌民
中国人民解放军第306医院消化内科,北京 100101
神经内分泌肿瘤(neuroendocrine tumors, NETs)起源于上皮下的神经内分泌细胞或多能细胞,又被称为类癌,容易穿透黏膜肌层侵及到黏膜下层,是一种低度恶性的肿瘤。约60%的NETs发生于胃肠道,其中尤以直肠多发[1]。近年来,随着内镜技术的进步及内镜筛查的增加,无症状直肠NETs的发现率显著提高。直径<1 cm分化良好的直肠NETs很少发生转移,内镜下局部切除被认为是标准的根治性治疗措施[2]。多项研究[3-6]表明,改良的内镜黏膜下切除术(endoscopic mucosal resection, EMR)与内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)等内镜切除的技术相较于传统的EMR技术能够明显降低局部残留风险。透明帽辅助的EMR(EMR with a cap, EMR-C)是通过将病变吸引至透明帽,然后进行黏膜下病变切除,具有简便、省时、高效的特点。ESD沿着黏膜下层剥离切除黏膜肿瘤,具有完整切除率高、局部复发率低、精确的病理分析等优点,但其存在费时、技术要求高、手术风险大等缺点。目前,对于何种技术更适合小的直肠NETs的切除还存在一定的争议[7-8],本文将对EMR-C及ESD治疗直肠NETs的效果及安全性进行回顾性分析。
1 资料与方法
1.1一般资料收集2012年1月至2016年12月在解放军306医院行内镜治疗的直肠NETs患者的临床资料。直肠NETs的诊断结合临床、内镜和影像学表现及组织病理学,并通过突触素、嗜铬粒蛋白A等免疫组化染色证实。病理组织行Ki67染色进行病理分级。患者临床资料包括:性别、年龄、病灶位置、大小、内镜表现(亚蒂、广基)、治疗方法、病理切缘、侵入深度、随访时间、局部复发等。
1.2内镜治疗入选标准所有接受内镜治疗的患者内镜直视下肿瘤均无溃疡及凹陷,所有病例术前均行小探头超声(频率12 MHz)检查排除肿瘤侵犯固有肌层,且腹部CT证实无淋巴结及远处转移。内镜下治疗由经验丰富的医师进行操作,治疗方式由内镜医师自行选择。
1.3手术操作步骤采用单通道结肠镜 (CF-H260AL,奥林巴斯) 和 ERBE电切装置(ERBE VIO 200 D)进行操作。EMR-C:首先注射含质量浓度为0.5 g/L靛胭脂的甘油果糖氯化钠注射液使病变周围黏膜抬举,然后将透明帽固定在肠镜前端,缓慢张开新月形电切圈套器使其在透明帽尖端内贴壁成环,通过吸引将病变吸引至透明帽中,然后圈套后通电切除病变,残端APC灼烧预防出血。ESD:使用Dual刀在距离肿瘤边界3~5 mm处进行标记,然后在黏膜下注射含质量浓度为0.5 g/L靛胭脂的甘油果糖氯化钠注射液使黏膜周围黏膜抬起。使用Dual刀或IT刀沿着标记点的外侧进行黏膜切开。环周黏膜充分切开后进行黏膜下层剥离操作。为了使垂直切缘阴性,剥离切开尽量沿着固有肌层进行。使用APC灼烧对术后创面进行局部保护。手术时间记录为从黏膜下注射至切除完成的时间。术后出血包括术后即刻出血及迟发型出血。
1.4病理分析所有切除标本都按照2 mm的间隔切片进行严格的病理分析,记录病理类型、侵犯深度、水平及垂直切缘是否阴性、淋巴结及血管有无浸润。根治性切除满足下列标准:(1)整块切除;(2)分化良好的内分泌肿瘤(G1);(3)肿瘤侵犯限于黏膜下层;(4)无血管、淋巴管浸润,垂直及水平切缘阳性。非根治性切除的高风险患者术后6个月复查内镜及CT,此后每年复查内镜及CT检查,普通患者术后每年复查内镜及CT随访,观察有无局部复发及转移。

2 结果
2.1临床及内镜特征表1中显示收集的42例患者的基本临床特征。24例(57.1%)为男性,18例(42.9%)为女性。年龄(49±7.2)岁(32~75岁)。其中接受EMR-C治疗27例,接受ESD治疗15例。27例内镜下表现为隆起型病变,15例内镜下表现为平坦型病变。EMR-C组的病变大小为(5.1±1.2)mm(3~10 mm),而ESD组的病变大小为(6.8±2.1)mm(4~13 mm),两组比较,差异有统计学意义(P<0.05)。EMR-C组手术时间显著短于ESD组[(5.83 ± 1.32)minvs(31.43 ±8.12)min],两组比较,差异有统计学意义(P<0.05)。未发现肿瘤浸润至固有肌层。

表1 患者的基本临床特征Tab 1 Characteristics of the patients
2.2内镜治疗结果如表2所示,两组在垂直切缘阳性、水平切缘阳性、脉管浸润及根治性切除方面差异均无统计学意义(P>0.05)。病理分析显示,所有病例Ki-67指数均<2%,均为分化良好的G1型内分泌肿瘤。主要并发症是出血、穿孔,EMR-C组有1例即刻出血及1例迟发型出血,ESD组有1例迟发型出血及1例穿孔,所有并发症均经内镜下电凝及止血夹钳夹后成功处置。所有病例通过6~58个月的随访均未见明显复发。
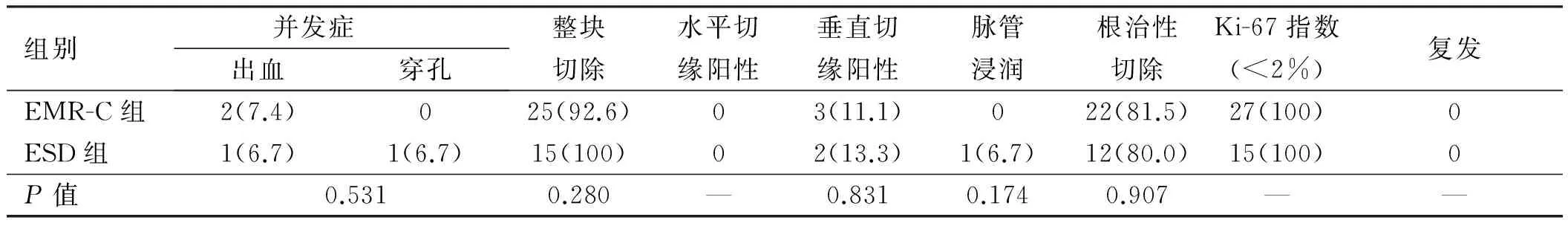
表2 两组内镜治疗结果Tab 2 Clinical outcomes of EMR-C group and ESD group 比例/%
2.3高风险病例临床病理特征病理提示有6例高风险病例(见表3),在ESD组中1例存在脉管浸润,后追加外科手术,其余5例存在基底切缘阳性患者均未行追加治疗。所有6例高风险患者在随后的内镜及CT定期复查中均未发现局部复发及远处转移。

表3 高复发及转移风险病例的临床病理特征Tab 3 Clinicopathologic characteristics of patients with non-curative resection
3 讨论
直肠NETs在内镜下表现为宽基底的淡黄色黏膜隆起型病变,与普通息肉存在一定差别。对于这类病变应避免直接通过活检钳取平或采用传统的EMR切除病变,因为存在肿瘤残留的风险[9]。有报道[1, 10]显示,对于直径<1 cm的直肠NETs的转移风险<3%,而直径为1~2 cm的直肠NETs的转移风险为10%~15%。欧洲神经内分泌肿瘤协会建议直径<1 cm的G1分化的直肠NETs可行内镜下治疗,而1~2 cm无固有肌层浸润的G1分化的直肠NETs可以做局部的内镜下治疗[2]。而对于固有肌层受累或G2与G3分化的直肠NETs可考虑经肛门局部切除或全肠系膜切除的根治性手术治疗[2]。肿瘤大小是评价肿瘤有无转移的重要危险因素。本研究对于所有接受内镜治疗的病例术前均完善了超声内镜及腹部CT检查,排除远处转移及固有肌层浸润风险,这对筛选合适患者接受内镜治疗方式有重要意义。但对于不同肿瘤大小的患者术前应该完善哪些术前影像学检查没有明确的标准,甚至有研究[11]显示,术前超声内镜检查并没有改善治愈性切除率。
传统EMR基础上改良的新技术,例如EMR-C及套扎辅助的EMR技术(EMR-L),能够协助通过辅助装置在病变部位的黏膜下层形成一个亚蒂,扩大水平及垂直切缘的广度和深度,提高病变的完全切除率,这对于保证直肠NETs的根治性治疗至关重要。有报道[12]显示,EMR-C较传统EMR能够明显降低切缘阳性率,且其与ESD相比,更简单、省时。ONOZATO等[13]研究发现,ESD相比EMR并不能提高完整切除率,且其穿孔并发症显著升高。PARK等[7]研究发现,与ESD相比,EMR-C与ESD在切缘阳性率、术后并发症发生风险等方面差异均无统计学意义。与此相似,我们研究也发现,尽管ESD组发生1例穿孔,但两组之间在水平切缘、垂直切缘、完整切除率、并发症发生风险、术后复发率等主要临床结局方面差异无统计学意义。接受ESD治疗的肿瘤大小明显大于EMR-C组,这种病例的选择性偏倚可能会引起治疗结果的偏差。由于本研究病例数较少,不能根据肿瘤的大小进行更进一步的亚组分析以明确肿瘤大小对治疗结局的影响,仍需大样本的对照性前瞻性研究明确两者治疗效果的差异。
脉管浸润是淋巴结转移的高危因素,本研究1例术后病理提示有脉管浸润后追加根治性手术治疗。其余5例垂直切缘阳性的患者并没有追加额外治疗,在随后半年1次的内镜及CT随访中并未发现复发迹象,这可能与直肠NETs是一种惰性肿瘤、随访时间尚短有关,也不除外在电切过程中的电流及术后的APC处理创面损伤了残留的肿瘤细胞。但对于这类患者的术后最佳随访时间目前没有明确的共识意见,仍需进一步的探讨。
[1] ITO T, SASANO H, TANAKA M, et al. Epidemiological study of gastroenteropancreatic neuroendocrine tumors in Japan [J]. J Gastroenterol, 2010, 45(2): 234-243. DOI: 10.1007/s00535-009-0194-8.
[2] CAPLIN M, SUNDIN A, NILLSON O, et al. ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: colorectal neuroendocrine neoplasms [J]. Neuroendocrinology, 2012, 95(2): 88-97. DOI: 10.1159/000335594.
[3] ZHONG D D, SHAO L M, CAI J T. Endoscopic mucosal resection vs endoscopic submucosal dissection for rectal carcinoid tumours: a systematic review and meta-analysis [J]. Colorectal Dis, 2013, 15(3): 283-291. DOI: 10.1111/codi.12069.
[4] ZHOU X, XIE H, XIE L, et al. Endoscopic resection therapies for rectal neuroendocrine tumors: a systematic review and meta-analysis [J]. J Gastroenterol Hepatol, 2014, 29(2): 259-268. DOI: 10.1111/jgh.12395.
[5] 李晓露, 夏璐. 直肠类癌的诊断及治疗现状[J]. 胃肠病学和肝病学杂志, 2011, 20(6): 495-497. DOI: 10.3969/j.issn.1006-5709.2011.06.002.
LI X L, XIA L. The diagnosis and treatment of rectal carcinoid tumor [J]. Chin J Gastroenterol Hepatol, 2011, 20(6): 495-497. DOI: 10.3969/j.issn.1006-5709.2011.06.002.
[6] 杨根源, 郭晓红, 施茜,等. 结扎装置辅助内镜下黏膜下层切除术与黏膜下层剥离术治疗直肠神经内分泌肿瘤的对照研究[J]. 胃肠病学和肝病学杂志, 2016, 25(2):155-158. DOI: 10.3969/j.issn.1006-5709.2016.02.010.
YANG G Y, GUO X H, SHI Q, et al. A control study of endoscopic submucosal resection with ligating device and endoscopic submucosal dissection in treating rectal neroendocrine tumors [J]. Chin J Gastroenterol Hepatol, 2016, 25(2):155-158. DOI: 10.3969/j.issn.1006-5709.2016.02.010.
[7] PARK S B, KIM H W, KANG D H, et al. Advantage of endoscopic mucosal resection with a cap for rectal neuroendocrine tumors [J]. World J Gastroenterol, 2015, 21(31): 9387-9393. DOI: 10.3748/wjg.v21.i31.9387.
[8] ZHOU P H, YAO L Q, QIN X Y, et al. Advantages of endoscopic submucosal dissection with needle-knife over endoscopic mucosal resection for small rectal carcinoid tumors: a retrospective study [J]. Surg Endosc, 2010, 24(10): 2607-2612. DOI: 10.1007/s00464-010-1016-z.
[9] SUN W, WU S, HAN X, et al. Effectiveness of endoscopic treatment for gastrointestinal neuroendocrine tumors: a retrospective study [J]. Medicine (Baltimore), 2016, 95(15): e3308. DOI: 10.1097/MD.0000000000003308.
[10] GARCIA-CARBONERO R, CAPDEVILA J, CRESPO-HERRERO G, et al. Incidence, patterns of care and prognostic factors for outcome of gastroenteropancreatic neuroendocrine tumors (GEP-NETs): results from the National Cancer Registry of Spain (RGETNE) [J]. Ann Oncol, 2010, 21(9): 1794-1803. DOI: 10.1093/annonc/mdq022.
[11] SON H J, SOHN D K, HONG C W, et al. Factors associated with complete local excision of small rectal carcinoid tumor [J]. Int J Colorectal Dis, 2013, 28(1): 57-61. DOI: 10.1007/s00384-012-1538-z.
[12] YANG D H, PARK Y, PARK S H, et al. Cap-assisted EMR for rectal neuroendocrine tumors: comparisons with conventional EMR and endoscopic submucosal dissection (with videos) [J]. Gastrointest Endosc, 2016, 83(5): 1015-1022. DOI: 10.1016/j.gie.2015.09.046.
[13] ONOZATO Y, KAKIZAKI S, IIZUKA H, et al. Endoscopic treatment of rectal carcinoid tumors [J]. Dis Colon Rectum, 2010, 53(2): 169-176. DOI: 10.1007/DCR.0b013e3181b9db7b.

