LCZ696对血管紧张素Ⅱ诱导小鼠心肌肥厚的作用及其机制
李晓增,赵凯,潘磊,乔香玲,张青青,李欣
(邢台市第三医院,河北邢台054000)
心肌肥厚是心脏在各种刺激下产生的适应性改变。心力衰竭通常是心肌肥厚的终末病变, 严重的心肌肥厚甚至可导致猝死[1]。心肌肥厚形成机制至今尚未研究清楚。信号转导与转录激活因子(STAT)是细胞内一类非受体型酪氨酸激酶蛋白家族,STAT3作为该家族中的重要成员,在胚胎早期发育、肿瘤发生、发展及凋亡等生理病理过程中发挥着重要的作用[2]。国外实验证明,在STAT3高表达的T3-TG小鼠中,心肌呈向心性肥大等病理改变,提示STAT3在心肌细胞肥大中起重要作用[3]。LCZ696作为第一个在临床试验获得成功的AR-NI类药物,在抑制血管紧张素受体的同时,能够加强内源性脑钠肽的血管舒张作用[4]。然而其对心肌肥厚的作用尚未明确。本实验于2016年10月~2017年7月,探讨了LCZ696对血管紧张素Ⅱ(AngⅡ)诱导心肌肥厚的作用及其与STAT3通路之间的关系。
1 材料与方法
1.1 动物、试剂与仪器 野生型C57BL/6小鼠(10~12周)60只,购自北京唯尚立德公司生物科技有限公司。人AngⅡ醋酸盐(Sigma公司生产);植入式微渗透泵2004(ALZET)泵(美国通用医疗器械公司生产);乙醚(分析纯,广州试剂厂);LCZ696(诺华制药);AG490(北京大科为生物技术公司);masson三色染色液(北京索莱宝科技有限公司);STAT3、磷酸化STAT3(p-STAT3)、tublin抗体(Santa Cruz,美国);Annexin V-FITC/PI细胞凋亡检测试剂盒(上海博谷生物科技有限公司)。HPSSOO型超声诊断仪;压力换能器(上海益联医学仪器发展有限公司);佳能EOS1200D单反照相机;Li-COR荧光扫膜仪(美国Li-COR有限公司);Accurl C6流式细胞仪(美国BD公司)。
1.2 动物分组及其处理 将动物采用完全随机法分为A、B、C、D组,每组15只。①A组:持续给C57BL/6小鼠吸入乙醚,无菌条件下皮下埋植仅灌注有生理盐水的ALZET泵,并用缝合线缝合切口;②B组:在无菌条件下称取AngⅡ(以1 000 ng/kg/min连续28 d的剂量计算),并溶于200 μL的0.9%生理盐水,取出微渗透泵,将AngⅡ注入ALZET泵中,无菌条件下将含AngⅡ的ALZET泵埋入皮下,用缝合线缝合切口;③C组:皮下埋入含AngⅡ的ALZET泵的方法同B组,术后1周接受LCZ696(50 mg/kg)治疗4次;④D组:皮下埋入含AngⅡ的ALZET泵的方法同B组,术前3 h注射AG490(4 μg/g)1次。待小鼠清醒后,洁净条件下喂养28 d。
1.3 心功能检测 小鼠术后28 d时,行超声心动图检测,小鼠持续吸入乙醚进行麻醉,胸部备皮。使用超声仪,将频率为5 MHz的超声探头置于小鼠左胸进行测量。检测指标包括左室后壁舒张末厚度(LVPWD)、舒张早晚期的最大血流速度比值(E/A)、左心室射血分数(LVEF)和短轴缩短率(FS)。
1.4 血流动力学检测 麻醉小鼠仰卧固定后取颈前正中切口,小心分离小鼠右侧颈总动脉,行小鼠左心室动脉插管,通过压力换能器采集监测各组小鼠动脉收缩压(SBP)、动脉舒张压(DBP)。
1.5 检测标本制备 称取小鼠体质量。颈椎脱臼法处死小鼠,取心脏, 冰冻PBS清洗,称取小鼠心脏质量,计算心/体质量、心质量/胫骨长度比值,拍摄心脏大体图片,取部分心肌组织留作凋亡检测,切取部分心肌组织,甲醛浸泡24 h,做病理切片,行Masson染色,应用ImagePro Plus(IPP)分析软件于显微镜下观察心肌病理改变。剩余部分立即液氮冷冻, -80 ℃保存。
1.6 STAT3及p-STAT3蛋白表达检测 采用Western blotting法。提取各组小鼠心肌细胞总蛋白,通过10%SDS-PAGE行蛋白凝胶电泳,待蛋白完全分离后,将蛋白以80 V恒定电压转至硝纤膜上,室温下用封闭液(1‰Tween20+50 mL 5%BSA)摇动封闭1 h,加入一抗,4 ℃孵育过夜,TBST洗涤后加入二抗,室温孵育1 h,TBST洗涤后采用Li-COR荧光扫膜仪避光扫描,显像后使用Photoshop分析条带灰度值。
1.7 心肌凋亡检测 充分研磨心肌组织后,用1 mL PBS冲悬细胞并计数(保证细胞数量不少于105),1 000 r/min离心5 min,收集细胞,加入400 μL 1×Binding Buffer 轻轻冲悬细胞;加入5 μL AnnexinV-FITC,轻轻混匀,室温避光孵育15 min,加入10 μL PI染色液,轻轻混匀,冰浴避光放置5 min,在30 min内进行流式细胞仪检测,设定AnnexinV-FITC为绿色荧光,PI为红色荧光。

2 结果
2.1 各组心功能、血流动力学、心/体质量、心质量/胫骨长度比较 见表1。
表1 各组心功能、血流动力学、心/体质量、心质量/胫骨长度比较
注:与A组比较,*P<0.05;与B组比较,#P<0.05。
2.2 各组心脏大体图 与A组比较,B组心脏体积增大,C、D组较B组心脏体积缩小。见图1。
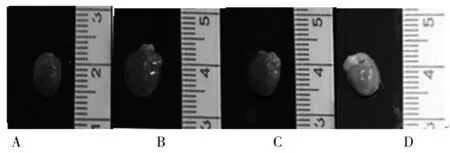
图1 各组心脏大体图
2.3 各组心肌组织病理改变 A组可见少量胶原纤维,散在分布于心肌细胞间隙,B组心肌胶原纤维较A组明显增加,C、D组心肌胶原纤维较B组明显减少。
2.4 各组心肌p-STAT3及STAT3蛋白表达比较 A、B、C、D组p-STAT3蛋白表达灰度值分别为44.75±2.14、107.48±8.77、78.20±4.68、46.25±1.46,STAT3蛋白表达灰度值分别为85.46±1.68、87.13±3.08、94.45±2.55、100.86±4.37。与A组相比,B组p-STAT3蛋白表达水平明显升高(P<0.05);与B组相比,C、D组p-STAT3蛋白表达水平明显降低(P均<0.05)。各组STAT3蛋白表达差异无统计学意义(P均>0.05)。
2.5 各组心肌细胞凋亡率比较 A、B、C、D组心肌细胞凋亡率分别为2.47%±0.22%、17.04%±4.89%、9.77%±2.11%、11.38%±3.05%。与A组相比,B组心肌细胞凋亡率增加(P<0.05);与B组相比,C、D组心肌细胞凋亡率减少(P均<0.05)。
3 讨论
LCZ696是一种全新研制的药物,化学结构中包含缬沙坦和脑咖啡肽抑制剂前体AHU377两种组分。前者为血管紧张素受体阻滞剂类药物,其比血管紧张素转化酶抑制剂更安全,可阻断AngⅡ介导的各种不良作用,在临床上常用于心力衰竭等疾病的治疗[5];后者为脑啡肽酶抑制剂,其参与了各种内源性血管活性多肽的分解,包括血管紧张素、缓激肽、A、B、C型脑钠肽等。有研究表明,通过抑制脑啡肽酶活性可影响小鼠血流动力学[6]。LCZ696通过双重作用机制,在降低心血管病死、心衰住院率等方面有更好的表现[7]。
心肌肥厚是临床上十分常见的疾病,多种心内科疾病(如原发性或继发性高血压、心脏瓣膜病变等)病程中均可呈现心肌肥厚改变。当机体血流动力学过负荷时,心脏机械张力增加[8],继而激活机体肾素-血管紧张素系统、一氧化氮合成系统等[9]。机械性与神经体液性因素相互作用,共同诱导心肌肥厚的发生。在心肌细胞肥大的过程中,心肌组织局部释放AngⅡ,其可以激活心肌细胞表面应力感受器(包括整合素家族等),从而将刺激信号传递至心肌细胞核内[10]。心肌肥厚早期可帮助维持正常心功能, 但长期的心肌肥厚会导致心功能降低、心脏体积增大、心肌顺应性降低等不可逆性改变,最终导致心力衰竭[11]。心肌肥厚的病理改变包括心肌细胞肥大、心肌间质细胞增殖、心肌发生纤维化以及心脏细胞外基质改建等。本研究发现,与A组相比, B组E/A、LVEF、FS降低,SBP、DBP增加,心/体质量,心质量/胫骨长度比值增高,心脏体积增大,心肌组织呈心肌肥厚、心肌纤维化病理改变;与B组相比, C组与D组E/A、LVEF、FS增高,SBP、DBP降低,心/体质量,心质量/胫骨长度比值降低,心脏体积缩小,心肌肥厚、心肌纤维化病理改变明显减轻。提示LCZ696抑制了AngⅡ诱导的小鼠心肌肥厚,其机制可能与抑制STAT3蛋白激活有关。
心脏发生机械牵拉,或当心脏压力负荷急性增高时,心肌细胞内STAT3激活[12];另外在心肌细胞增生、肥大的过程中,肾素-血管紧张素等通过自分泌与旁分泌的形式,与心肌细胞表面细胞因子受体或G蛋白偶联受体结合,受体分子发生二聚化,使得与受体偶联的JAK2激酶相互接近,并通过交互的酪氨酸磷酸化作用而活化,激酶JAK2催化STAT3蛋白发生磷酸化修饰,活化的STAT3蛋白以二聚体形式进入细胞核内,与靶基因特定的序列结合,从而改变相应基因的转录及蛋白的合成。这些研究均表明,STAT3蛋白通路在心肌肥厚的发生、发展过程中发挥了重要作用。通过本实验印证了这一结论。另外我们发现,LCZ696可抑制由AngⅡ引起的小鼠心肌细胞STAT3蛋白激活,继而可能影响其下游基因的激活以及蛋白的表达。
传统观点认为心肌属于永久性细胞,出生后便不能分裂增殖,一旦遭受破坏,则成为永久性缺失,然而有实验表明,在心脏发育及病理过程中,存在凋亡和增殖两种变化, 二者的动态平衡维持了心脏功能的稳态。本研究发现,LCZ696可抑制心肌细胞的凋亡,这一作用可能对治疗心力衰竭等心脏终末期病变有重要作用。
[1] 戴文建,王以光.心肌肥厚分子机制研究进展[J].心血管病学进展,2009,30(1):47-48.
[2] Haghikia A, Stapel B, Hoch M, et al. STAT3 and cardiac remodeling[J]. Heart Fail Rev, 2011,16(1):35-47.
[3] Yamauchi-Takihara K.Gp130-mediated pathway and heart failure[J]. Future Cardiol, 2008,4(4):427-437.
[4] 周沛宁,苏欣,赵水平. LCZ696治疗心衰的研究进展[J].医学临床研究,2015,32(6):1188-1189.
[5] Granger CB, McMurray JJ, Yusuf S, et al. Effects of cande-sartan in patients with chrome heart failure and reduced left-ventricular systolic function intolerant to angiotensin-covering-enzyme inhibitors: the CHARM-Alternative trial[J]. Lancet, 2003,362(9386):772-776.
[6] Van Esch JH, Mohzer E, Van Veghel R, et al. Beneficial cardiac effects of the rennin inhibitors aliskiren in spontaneously hypertensive rats[J]. J Hypertens, 2010,28(10):2145-2155.
[7] Mc Murray JJ, Packer M, Desai AS, et al. Dual angiotensin receptor and neprily-sin inhibition as an alternative to angio-tensin-converting enzyme inhibition in patients with chronic systolic heart failture:rationale for and design of the Prospective comparison of ARN1 with ACEI to Determine Impact on Global Mortality and morbidity in Heart Failure trial (PARA-DIGM-HF)[J]. Eur J Heart Fail, 2013,15(3):1062-1073.
[8] Yamazaki T, Komuro I, Yazaki Y. Signaling pathway for cardiac hypertrophy[J]. Cell Signal, 1998,10(10):693-698.
[9] Calderone A, Thaik CM, Takahashi N, et al. Nitric oxide atrial natriuretic peptide and cyclic GMP inhibit the growth-promoting effects of norepinephrine in cardicac myocytes and fibroblasts[J]. J Clin Invest, 1998,101:812-818.
[10] Johnson JA. An epsilon PKC-selective inhibitor attenuates back phosphorylation of a low molecular weight protein in cardiacmyocytes[J]. Cell Signal, 2003,15:123-130.
[11] Hunter JJ, Chien KR. Signaling pathways for cardiac hypertrophy and failure[J]. N Engl J Med, 1999,341(17):1276-1283.
[12] Hiroki U, Yukio H. gp130 plays a critical role in pressure overloaded-induced cardiac hypertrophy[J]. J Biol Chem, 2001,276(3): 23115-23119.

