槲皮素对大鼠血管平滑肌细胞增殖的影响及其与KCa3.1的关系
蒲欢,刘应才
(西南医科大学附属医院,四川泸州646000)
目前,我国动脉粥样硬化相关心脑血管疾病发病率及病死率居高不下,且支架置入病人也不断增多[1]。血管平滑肌细胞(VSMCs)异常增殖是动脉粥样硬化及支架内再狭窄的重要病理生理过程[2]。中电导钙激活钾通道(KCa3.1)是由6个跨膜区域组成的非电压依赖性离子通道,近年来发现其在心室重塑、动脉粥样硬化等病理生理过程中扮演重要角色[3,4]。槲皮素(Que)是最丰富的膳食黄酮。在心血管方面,Que有抗血小板聚集、降低血压、调节血脂、防治支架术后再狭窄等作用[5]。已知Que对VSMCs增殖具有抑制作用,但是否通过KCa3.1发挥作用尚不明确。2016年12月~2017年6月本实验通过培养大鼠VSMCs,观察Que对血管紧张素Ⅱ(AngⅡ)诱导VSMCs 增殖的影响,并探讨其与KCa3.1的关系。
1 材料与方法
1.1 动物与主要试剂 清洁级SD大鼠,体质量150~180g,由西南医科大学实验动物中心提供。澳洲胎牛血清(Bovogen),DMEM/高糖培养基 (HyClone),Que、CCK-8试剂盒(Sigma),胰蛋白酶(碧云天),TRAM 34(Selleck),KCa3.1 antibody (Abcam),AngⅡ(大连美仑),PBS、BCA蛋白浓度测定试剂盒(APSEN),大鼠Anti-αSMA (博士德)。
1.2 大鼠胸主动脉VSMCs培养及鉴定 采用组织贴块法培养VSMCs,培养3 d换液1次,5~7 d可见细胞从组织块游离出,10~14 d组织块周围的细胞出现融合,呈波峰波谷样生长。采用抗大鼠α-SMA 抗体进行免疫组织化学染色鉴定证实为VSMCs。用台盼蓝染色细胞计数法检测细胞活性。
1.3 实验分组 在37 ℃、5% CO2饱和湿度培养箱中培养VSMCs,待单层细胞铺满培养瓶80%以上时采用酶消化法进行传代。实验均采用3~5代细胞。实验先分为:对照组(只加入培养液)、AngⅡ组(10-6mol/L AngⅡ培养48 h)、AngⅡ+ TRAM 34(KCa3.1特异性阻滞剂)组(加入终浓度100 nmol/L TRAM 34预先处理2 h,再AngⅡ培养48 h)、AngⅡ+20 μmol/L Que组(先加入终浓度分别为20 μmol/L Que培养2 h,再加Ang Ⅱ培养48 h)、AngⅡ+40 μmol/L Que组(先加入终浓度分别为40 μmol/L Que培养2 h,再加Ang Ⅱ培养48 h)、AngⅡ+80 μmol/L Que组(先加入终浓度分别为80 μmol/L Que培养2 h,再加Ang Ⅱ培养48 h)、AngⅡ+TRAM 34+80 μmol/L Que (加入终浓度100 nmol/L TRAM 34及80 μmol/L Que培养2 h,再AngⅡ培养48 h)。
1.4 细胞增殖率检测 采用CCK-8法。选择对数生长期细胞用胰蛋白酶消化,配制成浓度为1×105/mL的细胞悬液,按10 000细胞/孔接种于96孔板,每孔加100 μL,置于5%CO2培养箱中37 ℃下培养24 h以贴壁。换1%FBS-DMEM培养基继续培养24 h后,进行加药100 μL。每组设3个复孔。培养实验所需时间后所有孔中加入10 μL CCK-8溶液,培养箱中孵育1~4 h。使用酶标仪测定450 nm波长下吸光度,以不含细胞的培养基为空白组,按公式计算药物对细胞的增殖率。细胞增殖率=(实验组吸光度-空白组吸光度)/(对照组吸光度-空白组吸光度)×100%。
1.5 Kca3.1通道蛋白表达检测 采用Western blotting法。用TBS缓冲液润洗贴壁细胞2~3次。加入适当体积的细胞总蛋白提取试剂于培养瓶内裂解3~5 min。期间反复晃动培养瓶,使试剂与细胞充分接触。将细胞刮下,收集到1.5 mL离心管中,冰浴30 min,期间用移液器反复吹打。4 ℃ 13 000 g离心5 min,收集上清,即为总蛋白溶液,使用BCA蛋白质浓度测定试剂盒测定样品蛋白浓度。制胶,加入TEMED后立即摇匀灌胶。进行电泳分离(浓缩胶80 V、分离胶120 V)转膜PVDF膜甲醇活化。按照正负极的方向摆放转膜“三明治”结构,300 mA恒流转磨90 min。将转好的膜加入封闭液室温封闭1 h,除去封闭液,加入已稀释好的一抗4 ℃过夜。回收已稀释的一抗,用TBST洗3次,每次5 min。加入稀释好的二抗,室温孵育30 min,用TBST在室温下摇床上洗4次,每次5 min。用化学发光显影法进行显影,以分析软件Alpha Imager 2200分析产物的光密度值(灰度比值=蛋白条带灰度/内参照蛋白条带灰度)。

2 结果
与正常对照组比较,AngⅡ组细胞增殖率明显增加(P<0.05)。与AngⅡ组比较,AngⅡ+TRAM 34组、AngⅡ+20、40、80 μmol/L Que组细胞增殖率降低(P均<0.05)。与Ang Ⅱ+TRAM 34组相比,Ang Ⅱ+TRAM 34+80 μmol/L Que组细胞增殖率降低(P<0.05)。与对照组比较,AngⅡ组Kca3.1通道蛋白表达增加(P<0.05)。与AngⅡ组相比,AngⅡ+TRAM 34组、AngⅡ+20、40、80 μmol/L Que组Kca3.1通道蛋白降低(P均<0.05)。AngⅡ+ TRAM 34 +80 μmol/L Que组与AngⅡ+ TRAM 34组相比,KCa3.1表达未见明显异常(P>0.05)。见表1。
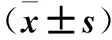
表1 各组VSMCs增殖率及Kca3.1通道蛋白 表达比较
注:与对照组比较,*P<0.05;与AngⅡ比较,#P<0.05;与Ang II+TRAM34组比较,&P<0.05。
3 讨论
动脉粥样硬化是众多心脑血管疾病共同的病理基础,严重危害人类健康,其并发症已然成为全球负担[6]。目前认为探索治疗动脉粥样硬化的新方法,将依赖于对疾病过程中主要细胞的生物学特性及致病机制进行严格认识。对于VSMCs,未来一个重要目标是确定影响其生物学行为的有益的因素和机制,可以增强或取代传统的抗动脉粥样硬化治疗。RAAS系统激活是动脉粥样硬化发病机制之一,AngⅡ通过刺激黏附分子、趋化因子和细胞因子的表达,促进内皮功能障碍、低密度脂蛋白的摄取和细胞增殖等,从而促进动脉粥样硬化的形成。多种病理刺激可以致平滑肌细胞增殖,RASS系统也在其中发挥重要作用。AngⅡ与细胞表面AT1R结合,从而通过Rho激酶、MAPK、NAPDH/ROS等信号通路,改变一氧化氮、Ca2+浓度,调控miR-221, miR-146a等微小RNA表达及影响各种内源性促有丝分裂因子来使平滑肌细胞发生表型转变、增殖、迁移、钙化等[2,7]。目前心血管疾病治疗过程中,抑制RASS系统激活已被指南广泛推荐。
Que是种植物源性五羟基黄酮类化合物。在过去几十年里,越来越多的证据表明健康饮食中天然来源的杂环化合物对调节人的健康有重要作用。流行病学证据也报道,富含黄酮类物质的饮食有益于心血管疾病的一级预防和二级预防[8]。大量研究表明在动脉粥样硬化方面,Que可以通过降低血管内炎症反应、改善内皮功能、抗血小板聚集、降血脂等方面发挥作用[7]。但Que在临床的应用仍有许多方面困扰着我们,如安全性、生物学形式及生物利用度等。关于Que在人体的安全性问题,大量研究表明Que是安全的,人体摄入1 000 mg/d的Que对血压、肝肾功、血常规无明显影响,但其毒副作用仍存在[9,10]。尽管Que作用众多,但其发挥作用需要特定的生物学形式,而其抑制细胞增殖的多种机制在不同系统是否一致仍需进一步研究。我们仍需更多的基础、临床研究及更高的制药技术来解决这些问题。针对VSMCs,已有研究表明Que可以抑制VSMCs增殖和迁移[5,11],与我们此次实验结果一致。在本实验中,与AngⅡ组相比,Que呈浓度依赖性抑制VSMCs增殖,但具体机制仍需进一步探索。目前,关于Que能否通过KCa3.1来抑制VSMCs增殖的研究较少。
KCa3.1即中电导钙激活钾通道,是钙激活钾通道家族中的一员。因细胞内Ca2+升高而激活,可促使K+外流,进而调节细胞膜电位和细胞内钙信号。KCa3.1在参与心血管疾病发生的许多细胞中上调,如激活的T细胞、B细胞、巨噬细胞、血小板、VSMCs和成纤维细胞,提示其可能在动脉粥样硬化、再狭窄和心脏纤维化等发生中起作用[3]。近年来相关研究已表明分化状态、静止、收缩表型的VSMCs优势表达KCa3.1。但在血管增生性疾病,在许多炎症因子、剪切力、氧化应激等作用下,VSMCs发生表型调整,KCa3.1快速上调,从而介导其生物学行为的改变[3,12,13]。KCa3.1能否作为一个治疗动脉粥样硬化及其他心血管疾病新的靶点正在进一步研究。且在阻断该离子通路对小鼠未产生毒副作用,也不影响其对流感病毒的免疫反应,且未在小鼠及服用KCa3.1阻滞剂Senicapoc的人上观察到对血压影响[14],这些使这个通道临床应用成为可能。而我们的研究也表明,与对照组相比,AngⅡ刺激下KCa3.1通道蛋白明显增加。而加入KCa3.1特异性阻滞剂TRAM 34后VSMCs增殖明显被抑制,因此,抑制KCa3.1通路将抑制VSMCs增殖。在本次试验中,我们继续探讨Que抑制AngⅡ诱导的VSMCs增殖是否与KCa3.1有关。结果发现,Que能抑制AngⅡ诱导的Kca3.1通道蛋白的增加,而KCa3.1特异性阻滞剂TRAM 34能消除这种作用。Ang Ⅱ+TRAM 34+80 μmol/L Que组与Ang Ⅱ+TRAM 34组相比,两组的细胞增殖有差异性,说明表明Que可以通过抑制KCa3.1来抑制VSMCs增殖,但并不是其唯一的机制。
综上,Que可以通过调控KCa3.1来调节VSMCs增殖。目前随着制药工艺的进展,使Que生物利用度的提高成为可能,深入研究Que在参与动脉粥样硬化的各类型细胞中的作用有助于运用其防治动脉粥样硬化。
[1] 陈伟伟,高润霖,刘力生,等.中国心血管病报告2016概要[J].中国循环杂志,2017,32(6):521-530.
[2] Chistiakov D, Orekhov A, Bobryshev Y. Vascular smooth muscle cell in atherosclerosis[J]. Acta Physiol (Oxf), 2015,214(1):33-50.
[3] Tharp DL, Bowles DK. The intermediate-conductance Ca2+-activated K+channel (KCa3.1) in vascular disease[J]. Cardiovasc Hematol Agents Med Chem, 2009,7(1):1-11.
[4] Xu R, Li C, Wu Y, et al. Role of KCa3.1 channels in macrophage polarization and its relevance in atherosclertic plaque instabilit[J]. Arterioscler Thromb Vasc Biol, 2017,37(2):226-236.
[5] Gormaz JG, Quintremil S, Rodrigo R. Cardiovascular disease: a target for the pharmacological effects of quercetin[J]. Curr Top Med Chem, 2015,15(17):1735-1742.
[6] Herrington W, Lacey B, Sherliker P, et al. Epidemiology of atherosclerosis and the potential to reduce the global burden of atherothrombotic disease[J]. Circ Res, 2016,118(4):535-546.
[7] Montezano AC, Nguyen DC, Rios FJ, et al. Angiotensin II and vascular injury[J]. Curr Hypertens Rep, 2014,16(6):431-442.
[8] Larson AJ, Symons JD, Jalili T. Therapeutic potential of quercetin to decrease blood pressure: review of efficacy and mechanisms[J]. Adv Nutr, 2012,3(1):39-46.
[9]Jiang YR, Yang J, Liu XW, et al. Effects and related mechanism of quercetin on thrombin-induced proliferation and migration of rat vascular smooth muscle cells[J]. Zhonghua Xin Xue Guan Bing Za Zhi, 2016,44(8):696-699.
[10]Harwood M, Danielewska-Nikiel B, Borzelleca JF, et al. A critical review of the data related to the safety of quercetin and lack of evidence of in vivo toxicity,including lack of genotoxic/carcinogenic properties[J]. Food Chem Toxicol, 2007,45(11):2179-2205.
[11] D'Andrea G. Quercetin: A flavonol with multifaceted therapeutic applications?[J]. Fitoterapia, 2015,106:256-271.
[12] Khler R, Kaistha BP, Wulff H. Vascular KCa-channels as therapeutic targets in hypertension and restenosis disease[J]. Expert Opin Ther Targets, 2010,14(2):143-155.
[13] Gole HK, Tharp DL, Bowles DK. Upregulation of intermediate-conductance Ca2+-activated K+channels (KCNN4) in porcine coronary smooth muscle requires NADPH Oxidase 5 (NOX5) [J]. PLoS One, 2014,9(8):e105337.
[14] Toyama K, Wulff H, Chandy KG, et al. The intermediate-conductance calcium-activated potassium channel KCa3.1 contributes to atherogenesis in mice and humans[J]. J Clin Invest, 2008,118 (9): 3025-3037.

