3种不同剂量来曲唑的促排卵效果及妊娠情况比较
刘 宝,孙文洁,林 奕,郝丽娟,周文正
(重庆市妇幼保健院生殖内分泌科 400013)
促排卵是无排卵患者及辅助生殖技术中重要的一步。目前临床上用于促排卵的药物主要包括两种,即口服的克罗米芬(CC)及肌注的促性腺激素类药物(Gn)。由于CC的抗雌激素作用,使其带来宫颈黏液差、子宫内膜成熟延迟、子宫内膜薄、卵泡未破裂黄素化综合征(LUFS)等不良反应,而Gn则有多胎妊娠率高、卵巢过度刺激综合征(OHSS)发生率高及花费高等缺点。近年来作为第3代芳香化酶抑制剂的来曲唑被越来越多地应用于临床,但来曲唑应用于促排卵的最佳剂量仍不明确。既往文献中使用较多的方案是月经第5天开始口服来曲唑2.5、5.0 mg/d或者7.5 mg/d,共5 d[1-3]。也有研究者使用月经第3天单次口服来曲唑 20 mg的方案[4]。本研究以3种不同剂量的来曲唑用于Ⅱ型排卵障碍的不孕患者,观察其促排卵效果及妊娠情况。
1 资料与方法
1.1一般资料 选择2013年1月至2014年12月于本院生殖内分泌门诊就诊拟行促排卵的患者92例。纳入标准:(1)按世界卫生组织(WHO)标准明确诊断为Ⅱ型排卵障碍的不孕妇女;(2)年龄小于或等于40岁;(3)婚后性生活正常,未避孕,大于或等于1年未育;(4)经子宫输卵管造影或腹腔镜诊治,至少一侧输卵管通畅;(5)检查无子宫畸形、子宫肌瘤及卵巢肿瘤;(6)男方精液检查正常;(7)3个月内未使用任何激素类药物。因来曲唑说明书中并未提及它的促排卵作用,故在患者参与研究前充分告知来曲唑近年来用于促排卵方面的研究进展,讲解其与传统促排卵药(克罗米酚)相比较的优势,取得患者同意,并签署知情同意书。
1.2方法 将患者分为三组,去除失访者后最后入组第1组27例、第2组35例、第3组30例。第1组于月经第3天口服来曲唑 2.5 mg/d(芙瑞每片2.5 mg,江苏恒瑞医药股份公司生产),共5 d;第2组于月经第3天口服来曲唑 5 mg/d,共5 d;第3组于月经第3天口服来曲唑 20 mg。阴道超声检测卵泡发育及子宫内膜情况,当最大卵泡直径大于或等于18 mm时肌肉注射人绒毛膜促性腺激素(HCG)10 000 IU诱发排卵,并嘱患者于HCG注射24~48 h后同房,注射HCG 48 h后经阴道超声检测卵泡是否破裂,超过96 h卵泡未破裂者诊断为LUFS。记录HCG注射日卵泡成熟时间、直径大于或等于18 mm的成熟卵泡数等指标,并观察排卵率、临床妊娠率及出现LUFS、OHSS、流产、异位妊娠、多胎妊娠等情况。测量标准:卵泡大小以两条垂直的卵泡内径表示,平均直径大于或等于18 mm认为成熟。排卵后14 d检测HCG,阳性则为生化妊娠;排卵后28~30 d行阴道B超监测,宫内见胎心搏动为临床妊娠。

表1 三组患者一般资料的比较

2 结 果
2.1一般资料情况 92例患者均完成全部治疗及检查,所有患者均无胃肠道反应、过敏反应及其他不良反应,用药前后查肝、肾功能均正常。三组患者的年龄、不孕年限、体质量指数(BMI)、卵泡刺激素(FSH)、黄体生成素(LH)、雌二醇(E2)及雄激素(T)比较差异均无统计学意义(P>0.05),具有可比性。见表1。
2.2促排卵效果比较 三组HCG注射日卵泡成熟时间、成熟卵泡个数、排卵率等比较,差异均无统计学意义(P>0.05)。组间两两比较也差异无统计学意义(P>0.05)。排卵率第2组最高、第1组最低。LUFS发生率三组间比较差异有统计学意义(P<0.05),第2组、第3组LUFS发生率均明显低于第1组(P<0.05),但第2组与第3组比较差异无统计学意义(P>0.05)。
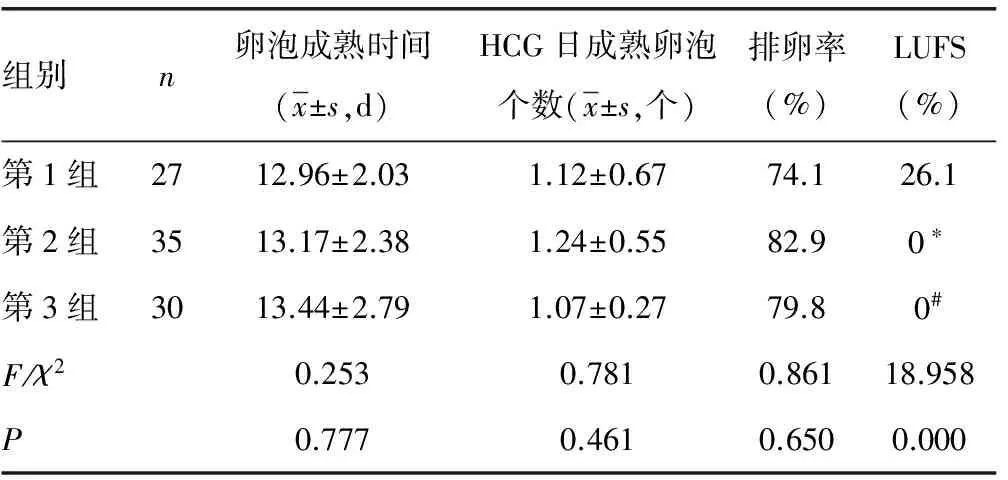
表2 三组促排卵效果比较
*:χ2=10.645,P<0.05,与第1组比较;#:χ2=4.286,P<0.05,与第1组比较
2.3妊娠情况比较 三组中仅第2组发生1例异位妊娠,各组均无妊娠早期流产、多胎妊娠及OHSS。临床妊娠率第2组最高、第1组最低,但差异均无统计学意义(P>0.05),组间两两比较也差异无统计学意义(P>0.05)。
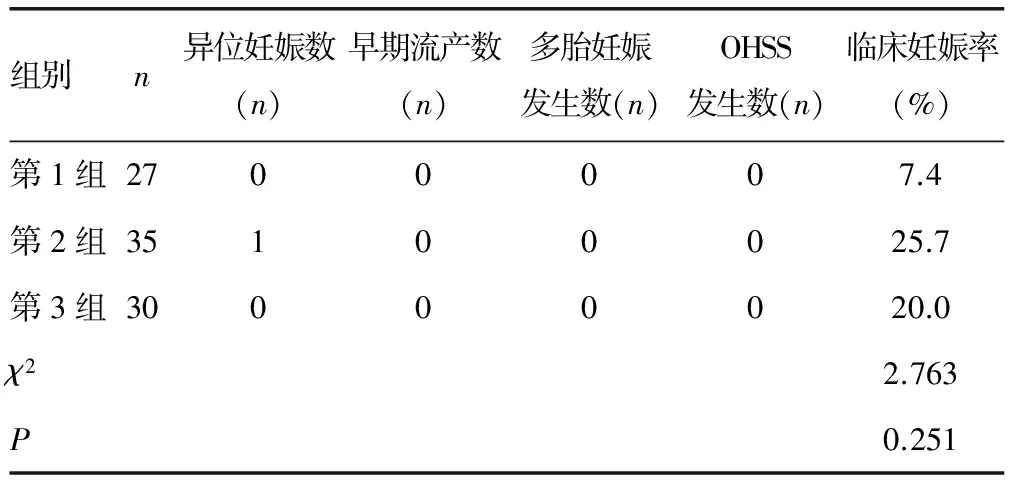
表3 三组妊娠情况比较
3 讨 论
来曲唑为人工合成的三苯三唑类衍生物,化学名1-[双(4-氰基苯基)甲基]-1,2,4-三氮唑,是第3代口服的选择性非甾体类芳香化酶抑制剂。芳香化酶是雄激素向雌激素转化过程中的限速酶,来曲唑能与内源性底物竞争芳香化酶位点,从而可以阻断95%以上的芳香化酶活性。另一方面,因为外周血雌激素水平的下降,解除了E2对下丘脑/垂体的负反馈抑制,促进内源性促性腺激素分离的增多,从而刺激卵泡的发育[5]。 来曲唑代谢快,半衰期仅45 h,一般经5个半衰期(10 d)后可被人体完全清除,这样卵泡发育后E2水平迅速恢复,抑制了FSH的大量分泌,优势卵泡的生长及小卵泡的闭锁得以正常进行,降低了多胎妊娠的风险及OHSS的发生,保证单个卵泡的生长和排卵[6]。此外,卵巢内雄激素的聚集可增加早卵泡期FSH受体的表达,而蓄积的雄激素又可刺激胰岛素样生长因子及多种内分泌、旁分泌因子的表达,共同协同促进卵泡的生长[7]。
临床中口服促排卵药物的CC因其抗雌激素作用引起人们的逐渐关注,如宫颈黏液差、子宫内膜薄、高排卵率、低妊娠率等,因而人们开始重新寻找一种可以替代CC的新药物。1999年来曲唑被首次用于不育患者的促排卵治疗,有报道指出来曲唑具有和CC相似的促排卵效果[8]。多项研究均表明不管是第1次接受促排卵治疗还是既往存在CC抵抗的患者,单独使用来曲唑的排卵率较单独使用CC的排卵率明显升高,而妊娠率、流产率等方面无明显差异[9-10]。此外,对于存在CC抵抗的宫腔内人工受精(IUI)患者及卵巢低反应患者,来曲唑也是适合的诱导排卵药物[11-12]。
来曲唑用于促排卵的最佳剂量尚不确定。目前临床上使用较多的是连续用药的方案,即从月经第3天开始,第7天止,每天使用剂量为2.5~7.5 mg。一项Meta分析结果显示,与来曲唑每天2.5 mg组比较,来曲唑每天5.0 mg组可获得更多的成熟卵泡个数,卵泡成熟所需时间较短,有利于提高妊娠率,在促排卵成熟方面比较有优势,可作为临床促排卵的推荐剂量[1],认为5.0 mg/d是较好的选择。而另一项研究的结果却表明2.5 mg/d与5.0 mg/d的临床妊娠率相似,2.5 mg/d甚至更高一些[2]。HAYA等[3]比较了CC 100 mg/d连用5 d与来曲唑7.5 mg/d连用5 d的方案,结果显示两组在子宫内膜厚度及妊娠率上无明显差异,但CC组流产率较来曲唑组高。在2005年,MITTALLY等[4]提出了来曲唑的单剂量用药方案,指出在月经第3天单次口服来曲唑20 mg与2.5 mg/d连用5 d的方案临床妊娠率相似。单次用药可使药物浓度在早卵泡期更高,且因来曲唑半衰期短,至排卵期已基本代谢完全,所以用药更安全,也更方便、简单。
本研究结果显示,三组HCG注射日卵泡成熟时间、成熟卵泡个数差异均无统计学意义(P>0.05),HCG注射日的卵泡成熟时间均接近正常周期的卵泡发育时间,成熟卵泡个数为单个卵泡生长发育成熟;三组均有较高的排卵率,5 mg/d组最高,2.5 mg/d组最低,但差异无统计学意义(P>0.05);LUFS发生率5 mg/d组及20 mg组低于2.5 mg/d组,差异有统计学意义(P<0.05)。说明3种剂量的来曲唑均能有效地促进卵泡发育成熟,且为单个卵泡的发育成熟,对卵泡的发育无不利影响,从而有利于减少多胎妊娠及OHSS发生的危险;此外,随着来曲唑总剂量的增大,LUFS的发生率降低。
本研究结果显示,三组临床妊娠率分别为7.4%、25.7%、20.0%,5 mg/d组及20 mg组妊娠率高于2.5 mg/d组,但差异无统计学意义(P>0.05);除5 mg/d组发生1例异位妊娠外,三组均未发生早期妊娠流产、多胎妊娠及OHSS。在本研究中来曲唑促排卵时其早期妊娠流产、多胎妊娠及OHSS的发生率均较低。
综上所述,来曲唑的三组方案均能有效促进卵泡发育,尤其单个卵泡的发育成熟,可减少早期妊娠流产、多胎妊娠及OHSS发生的危险;对肝、肾功能无影响,无药物不良反应。但因来曲唑药物适应症尚未用于促排卵治疗,且本研究纳入病例数较少,仅为探索性临床研究,故临床使用应慎重。
[1]陈红,涂晓贤.不同剂量来曲唑促排卵效果的系统评价[J].福建医科大学学报,2014,15(5):321-326.
[2]MITWALLY M F,BIJIAN M M,Casper R F.Pregnancy outcome after the use of an aromatase inhibitor for ovarian stimulation[J].Am J Obstet Gynecol,2005,192(2):381-386.
[3]HAYA A F,MAHA A K.A randomized trial of letrozole versus clomiphene citrate in women undergoing superovulation[J].Fertil Steril,2004,82(6):1561-1563.
[4]MITTALLY M F,CASPER R F.Single-dose administration of an aromatase inhibitor for ovarian stimulation[J].Fertil Steril,2005,83(1):229-231.
[5]LAMB H M,ADKINS J C.Letrozole:a review of its use in postmenopausal women with advanced breast cancer [J].Drugs,1998,56(6):1125-1140.
[6]CASPER R F,MITWALLY M F.Use of the aromatase inhibitor letrozole for ovulation induction in women with polyeystic ovarian syndrome[J].Clin Obstet Gynecol,2011,54(4):685-695.
[7]MAZERBOURG S,BONDY C A,ZHOU J,et al.The insulin-like growth factor system:a key determination role in the growth and selection of ovarian follicles a comparative species study[J].Reprod Domest Anim,2003,38(4):247-258.
[8]MITWALLY M F M,CASPER R F.The use of an aromatase inhibitor for induction of ovulation in patients with an inadequate response to clomiphene citrate[J].Fertil Steril,2001,75(2):305-309.
[9]MISSO M L,Wong J L,TEEDE H J,et al.Aromatase inhibitors for PCOS:a systematic review and meta-analysis[J].Hum Repord Upddate,2012,18(3):301-312.
[10]HE D,JIANG F.Meta-analysis of letrozole versus clomiphene citrate in polycystic ovary syndrome[J].Repord Biomed Online,2011,23(1):91-96.
[11]GANESH A,GOSWAMI S K,CHATTOPADHYAY R,et al.Comparison of letrozole with continuous gonadotropins and clomiphenegonadotropin combination for ovulation induction in 1387 PCOS women after clomiphene citrate failure:a randomized prospective clinical trial[J].J Assist Reprod Genet,2009,26(1):19-24.
[12]YASA C,BASTU E,DURAL O,et al.Evaluation of loe-dose letrozole addition to ovulation induction in IVF[J].Clin Exp Obset Gynecol,2013,40(1):98-100.

