联合尾状叶切除在Ⅲ型肝门胆管癌的临床疗效分析
刘中 张登勇 孙万亮 马翔 鲁正

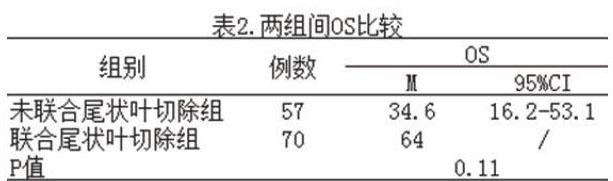
【摘要】目的:评价联合尾状叶切除在手术治疗Ⅲ型肝门部胆管癌的作用与对生存的影响。方法:回顾性分析2002年1月至2017年6月蚌医一附院肝胆外科进行手术治疗的Ⅲ型肝门胆管癌患者。患者分为联合尾状叶切除组及未联合尾状叶切除组。结果:共127例患者纳入研究,其中,57例未行联合尾状叶切除(44.9%),70例联合尾状叶切除(55.1%)。联合尾状叶切除组术前中位胆红素水平明显高于对照组(P=0.017),联合尾状叶切除组患者中位总生存期(OS)显著高于对照组(64.0 vs 34.6个月),两组有显著性差异(P=0.010)。多因素分析显示,淋巴结转移阳性(P=0.025)和出现临床症状(P<0.001)为影响中位OS的危险因素。结论:联合尾状叶切除术可使Ⅲ型肝门部胆管癌中位0S的明显提高,其他影响中位OS的因素还包括淋巴结转移阳性和出现临床症状。
【关键词】肝门胆管癌;尾状叶切除;疗效
肝门胆管癌指发生于肝总管至左、右肝管及其汇合部的胆道恶性肿瘤,根治性手术治疗是肝门胆管癌获得长期生存的唯一机会,为获得更高的R0切除率,扩大肝切除己被广泛接受手术方式。近年来许多研究表明了扩大肝切除术包括联合尾状叶切除在Ⅲ型、Ⅳ型肝门胆管癌患者的可行性,并取得了良好的长期效果[1][2]。然而,很少有关于联合尾状叶切除的具体作用的报告。因此,本研究的主要目的是评价Ⅲ型肝门胆管癌同时联合尾状叶切除的作用与对生存的影响。
1 资料与方法
1.1 一般资料
回顾性分析2002年至2017年我院行扩大肝切除的Ⅲ型肝门胆管癌患者127例,其中男77例,女50例,中位年龄62(41-79)岁,IIIA型94例,IIIB型33例。24例患者无明显临床症状,103例患者出现腹痛、黄疽、纳差、发热、体重减轻等临床症状。合并胆管结石13例,慢性乙肝5例,肝硬化4例,术前常规行三维CT,对于残肝体积小于20%的患者,行门静脉栓塞术(PVE)促进残肝生长。当患者总血清胆红素水平大于3.Omg/dl时,行术前胆道引流(PBD),以缓解残肝侧胆道梗阻。
1.2 手术适应症
肝门部胆管癌的可切除性标准如下:
(1)无腹膜或肝转移;
(2)未大面积侵犯对侧门静脉分支或门静脉主干;
(3)未侵犯肝主动脉或对侧肝动脉分支;
(4)无对侧肝叶萎缩;
(5)无肝门外淋巴结受累;
1.3 手术方法
取右上腹反“L”形切口进腹,探查有无腹腔及远处淋巴结转移。骨骼化清扫肝十二指肠韧带,切除远端胆总管,肝脏切除范围是半肝或以上或联合尾状叶切除。
1.4 术后疗效及随访
收集并记录两组患者术后并发症如切口感染、肝功能不全的发生情况,随访包括常规体格检查和放射和实验室检查。随访是通过病人入院或电话联系获得的,随访截止到2017年6月20日。
1.5 统计学分析
采用SPSS 22.0软件包进行统计学分析。计量资料在表中用中位数及具体范围表示,组间比较采用t检验,计数资料用例数(n)表示,组间率(%)比较采用χ2检验,组间分析采用秩和检验。用Log-rank检验进行组间生存率比较,对于在与影响OS的单因素分析中P<0.05的变量将被纳入Cox回归多因素分析的模型中,P<0.05为差异有统计学意义。
2 结果
2.1 术前情况对比
两组患者间的性别、年龄、术前有无临床症状、CA 19-9和CEA水平均无统计学差异(P值均>0.05),联合尾状叶切除组患者术前中位胆红素水平明显高于对照组(P<0.05)。其中,两组行PBD的患者比例基本一致(59.6%vs60.0%)。虽然PVE在联合尾状叶切除组中所占的比例(14.3%)是未联合尾状叶切除组(7.0%)的两倍,但两组差异无统计学意义(P=0.193)。仅有不到五分之一的患者(18.9%)偶然发现肿瘤,没有任何症状,见表1。
2.2 术后情况对比
尽管未联合尾状叶切除患者的阳性切缘率(15.8%)是联合尾状叶切除组(8.6%)的两倍,但此差异无显著性(P=0.210)。術后两组淋巴结转移(P=0.65)、肿瘤复发率(P=0.569)、发病率(P=0.301)及术后90天或住院期间死亡率(P=0.443)差异均无统计学意义。
2.3 影响总生存期(OS)的预后因素
中位随访时间为24.7个月(范围:9.1-148.2个月)。两组中位随访期比较无明显差异(P=0.346)。本研究发现联合尾状叶切除组患者OS明显延长,两组中位OS(64.0个月VS 34.6个月)相比存在明显差异(P=0.011),见表2。
2.4 单因素分析
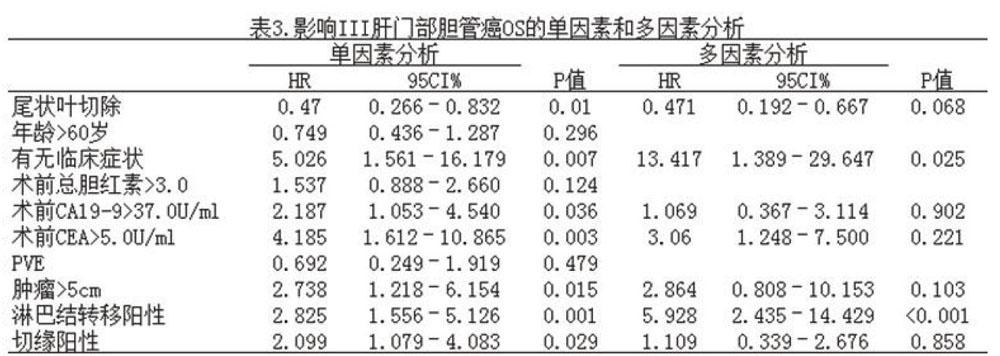
对表1中影响OS的因素进行单因素分析,以P<0.05为检验标准,筛选出与OS相关的因素:联合尾状叶切除(P=0.010),术前有临床症状的患者(P=0.010),术前CA 19-9(P=0.036),术前CEA(P=0.003),肿瘤大小(P=0.015),淋巴结转移阳性(P=0.001),切缘阳性(P=0.029)。余下的因素P均>0.05,无统计学意义。
2.5 多因素分析
将单因素分析中筛选的因素纳入多因素分析中,结果显示术前有临床症状的患者(P=0.025)和淋巴结转移阳性(P<0.001)是影响OS的危险因素,联合尾状叶切除是影响OS的积极因素(P=0.068),见表3。
3 讨论
肝门部胆管癌因靠近肝门有浸润胆道分支的倾向,特别是Ⅲ型和Ⅳ型肝门胆管癌,尾状叶胆管肿瘤侵犯是相当常见的[3]。有文献报道的肝门部胆管癌侵犯尾状叶胆管的发生率为31~98%[4]。在Sakamoto等人[5]的研究中发现肝门胆管癌粘膜下浸润的模式与肿瘤的类型密切相关,粘膜下浸润通常小于10mm,因此Sakamoto等人建议切缘距肿瘤必须大于5mm,以确保令人满意的长期结果。以前,有文献报道可以仅局部切除胆管而不切除肝脏,这与当时认为肝切除与增加术后发病率和死亡率有关,随着围手术期护理的改善和肝胆外科手术技术的进步,尤其是对于Ⅲ型和Ⅳ型肝门胆管癌,局部胆管切除逐渐不能被接受。随着联合尾状叶切除术的概念被名古屋的nimura等人[3]逐渐推广,肝门部胆管癌手术切除的方式也逐渐发展。
關于肝门部胆管癌的临床表现和肿瘤复发模式我们己经积累了大量的知识和经验,研究表明影响生存率和复发的最重要因素之一是切缘阴性网。肝门胆管癌肿瘤位置常位于肝门深处,周围紧靠肝门部血管及尾状叶,根治性手术难度极大,为了获得胆管切缘阴性,扩大肝切除己被逐渐接受为标准治疗方案[7]。在Ⅳ型肝门部胆管癌中,由于左右胆管同时受肿瘤侵犯,扩大肝切除加尾状叶切除是必要的。但在Ⅲ型癌中,联合尾状叶切除术的作用仍然存在争议。
1986年,Mizumoto等人[8]强调未切除尾状叶可能会增加肝门部胆管癌术后复发的风险。Gazzaniaga等人[9]的尸检研究证实了这一假设。结果显示5例患者中有1例存在尾状叶肿瘤复发。在我们的研究中,发现联合尾状叶切除患者的OS明显长于未联合尾状叶患者(64.0 vs 34.6个月)。Nimura等人研究表示肝门胆管癌联合尾状叶的3年和5年生存率分别为55.1%和40.5%,其中45例患者中有44例经镜下证明累及尾状叶胆管[3]。香港大学的Liu等人[10]经过多因素分析认为采用肝切除伴尾状叶切除作为肝门部胆管癌的手术方式可显著地提高了患者的总生存期。
许多研究己经确定了根治性切除术后肝门部胆管癌与OS相关的影响因素,包括切缘状态、淋巴结转移、肿瘤大小、组织学分化、肿瘤分期和尾状叶。本研究发现,通过多因素分析,出现临床症状和淋巴结转移阳性是降低患者预后的主要因素,同时,联合尾状叶切除可显著提高中位OS。
综上所述,联合尾状叶切除术可使Ⅲ型肝门部胆管癌中位OS的明显提高,是一种合理的手术方式。本研究中其他影响中位OS的因素还包括淋巴结转移阳性和出现临床症状。
(通讯作者:鲁正)
参考文献
[1]鲁正,王冬冬.Bismuth-COrletteⅢ、Ⅳ型肝门部胆管癌的手术治疗方式[J].中华外科杂志,2016,54(07):488-491.
[2]王冬冬,孙万亮,鲁正等.Ⅲ Ⅳ型肝门胆管癌扩大肝切除临床疗效分析[J].中国肿瘤临床,2016,43(06):250-254.
[3]Nimura Y,Hayakawa N,Kamiya I,et al.Hepatic segmentectomywith caudate lobe resectionfor bile duct carcinoma of thehepatic hilus[J].World Journal ofSurgery,1990,14(04):535-543.
[4]Sugiura Y,Nakamura S,Iida S,etal.Extensive resection of thebile ducts combined with liverresection for cancer of themain hepatic duct junction:acooperative study of the KeioBile Duct Cancer Study Group[J].Surgery,1994,115(04):445-451.
[5]Sakamoto E,Nimura Y,Hayakawa N,et al.The pattern of infiltrationat the proximal border ofhilar bile duct carcinoma:a histologic analysis of 62resected cases.[J].Annals ofSurgery,1998,227(03):405-411.
[6]I to F,Agni R,Rettammel RJ,et al.Resection of hilarcholangiocarcinoma:concomitantliver resection decreases hepaticrecurrence[J].Annals of Surgery,2008,248(02):273-279.
[7]Paik K Y,Choi D W,Chung IC,et al.Improved survivalfollowing right trisect ionectomywith caudate lobectomywithout operative mortality:surgical treatment for hilarcholangiocarcinoma.[J].Journalof Gastrointestinal Surgery,2008,12(07):1268-1274.
[8]Mizumoto R,Kawarada Y,SuzukiH.Surgical treatment of hilarcarcinoma of the bile duct.[J].Surgery Gynecology&Obstetrics;,1986,162(02):153-158.
[9]Gazzaniga G M,Filauro M.[Primaryneoplasms of the hepatic hilum:palliative resections][J].MinervaChirurgica,1989,44(1-2):147-149.
[10]Liu CL,Fan ST,Lo CM,et al.Improved operative and survivaloutcomes of surgical treatmentfor hilar cholangiocarcinoma[J].British Journal of Surgery,2005,93(12):1488-1494.

