快步走改善阿尔茨海默病患者睡眠障碍的疗效观察
母海艳,吕继辉,郝智慧,李文杰,李沫
(北京老年医院精神心理二科,北京 100095)
阿尔茨海默病(Alzheimer’s disease,AD)是以进行性智能衰退为特征的一种神经系统变性疾病,因其高发病率、高致残率越来越受到人们的关注。AD患者睡眠障碍十分常见,针对AD患者各种类型睡眠障碍的研究表明,65.7%的人至少有一种睡眠障碍,48.5%的人患有失眠[1]。 睡眠障碍不仅会加重认知功能损害,也是AD患者重要的非认知功能症状之一[2]。应用镇静催眠类药物存在诸多弊端,而近年来一些非药物治疗措施逐渐引起人们的重视。部分研究者将运动干预方式用于AD患者,取得了重要研究成果。有研究表明,步行是与降低AD发生风险关联性最强的活动之一[3]。我们之前的研究亦发现快歩行走可改善AD患者认知功能和精神行为异常[4],本研究采用双盲随机对照设计,评估快步走对AD伴随失眠患者的治疗疗效,希望能对临床医师及伴有睡眠障碍的AD患者提供有价值的理论参考。
1 对象与方法
1.1 研究对象
入选2015年12月至2016年12月期间北京老年医院精神心理二科伴有睡眠障碍的住院AD患者72例,年龄65~80岁。按随机数字表法分为对照组(常规治疗)和运动组(常规治疗+快步走),每组患者各36例。纳入标准:(1)符合美国国立神经疾病、语言交流障碍和卒中研究所-阿尔茨海默病及相关疾病学会阿尔茨海默病诊断标准[5];(2)有能力独自或在护理员的帮助下完成研究任务;(3)睡眠障碍采用匹兹堡睡眠质量指数量表(Pittsburgh sleep quality index, PSQI)诊断,总分≥7分作为睡眠障碍的标准。排除标准:(1)血管性痴呆、路易体痴呆、额颞叶痴呆、帕金森病痴呆及中枢神经系统其他疾患所致痴呆(如脑肿瘤、多发性硬化、脑炎、癫痫、脑积水等);代谢及营养缺乏所致痴呆(如甲状腺功能异常、持续性低血糖、维生素B12缺乏、叶酸缺乏等);酗酒、药物滥用及其他已知可导致痴呆的疾病。(2)过去3个月内有急性感染、外伤、心肌梗死等急症;严重躯体疾病不能耐受或配合研究;视力、听力严重受损;严重语言障碍不能配合研究。(3)患有可导致睡眠障碍的其他疾病如夜尿症、尿失禁、胃食管反流病、抑郁症、慢性疼痛性疾病如关节炎、既往酗酒抽烟、滥用药物、严重的感觉缺失、哮喘、慢性阻塞性肺疾病等。本研究经伦理委员会批准(批准文号北京老年医院2018-001),并获得患者或家属知情同意。
1.2 方法
1.2.1 干预方法 所有患者均使用常规的助眠药物。主要治疗药物包括佐匹克隆片7.5~15.0 mg,每晚1次;马来酸米达唑仑片7.5~15.0 mg,每晚1次;艾司唑仑片1~2 mg,每晚1次;既往使用上述药物者继续使用,原则上不继续添加镇静催眠类药物。运动组于上述治疗基础上在病房花园的健步走圈道快走,圈道长约400 m,患者运动前先进行10 min热身运动,之后在8 min内走完1圈,每日运动时间≥1 h,根据老人具体情况分2~3次进行,≥20 min/次,自愿结伴,2~4人为1组,累计每周≥3次且运动时间≥200 min,连续进行12周。由工娱治疗师记录每位患者每次具体的运动时间,保证每位患者完成每周的运动计划。
1.2.2 评定量表及方法 采用PSQI评定睡眠障碍水平。PSQI主要由主观睡眠质量、入睡时间、睡眠时间、睡眠效率、睡眠障碍、睡眠药物(异戊巴比妥钠)应用及日间功能7个条目组成,每个条目按0~3 计分,累计各评分,即PSQI总分,得分越高,表明睡眠质量越差。总分≥7分为睡眠障碍,5~6分为睡眠障碍的临界状态[6]。该量表通过对患者或照料者的询问做出评分,操作简便,依从性大大提高,是目前国内外评价睡眠障碍常用的衡量指标。以PSQI减分率评定疗效,减分率≥75%为显著进步,≥50%为有效,≥25%为进步,<25%为无效。总有效率为显著进步、有效及进步之和。减分率=(治疗前分值-治疗后分值)/治疗前分值×100%。
1.3 统计学处理
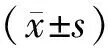
2 结 果
2.1 基线资料比较
两组患者性别、年龄、病程及其他基线资料比较,差异均无统计学意义(P>0.05;表1),具有可比性。
2.2 两组患者临床效果比较
两组治疗前PSQI总分及7个因子评分比较,差异均无统计学意义(P>0.05);运动组治疗后睡眠质量、入睡时间、睡眠时间、睡眠效率、睡眠障碍、日间功能障碍得分及PQSI总分较治疗前均有所降低,差异有统计学意义(P<0.05);对照组治疗前后7个因子评分变化不大,差异无统计学意义(P>0.05),但PQSI总分较治疗前下降,差异有统计学意义(P<0.05);治疗后运动组与对照组比较,睡眠质量、入睡时间、睡眠时间、睡眠效率、睡眠障碍、日间功能障碍评分及PQSI总分均显著降低,差异有统计学意义(P<0.05;表2)。
2.3 疗效评价
运动组显著进步0例,有效5例,进步15例,无效16例, 总有效率为55.6%(20/36); 对照组显著进步0例,有效0例,进步7例,无效29例,总有效率为19.4%(7/36),两组总有效率比较,差异有统计学意义(P<0.05)。
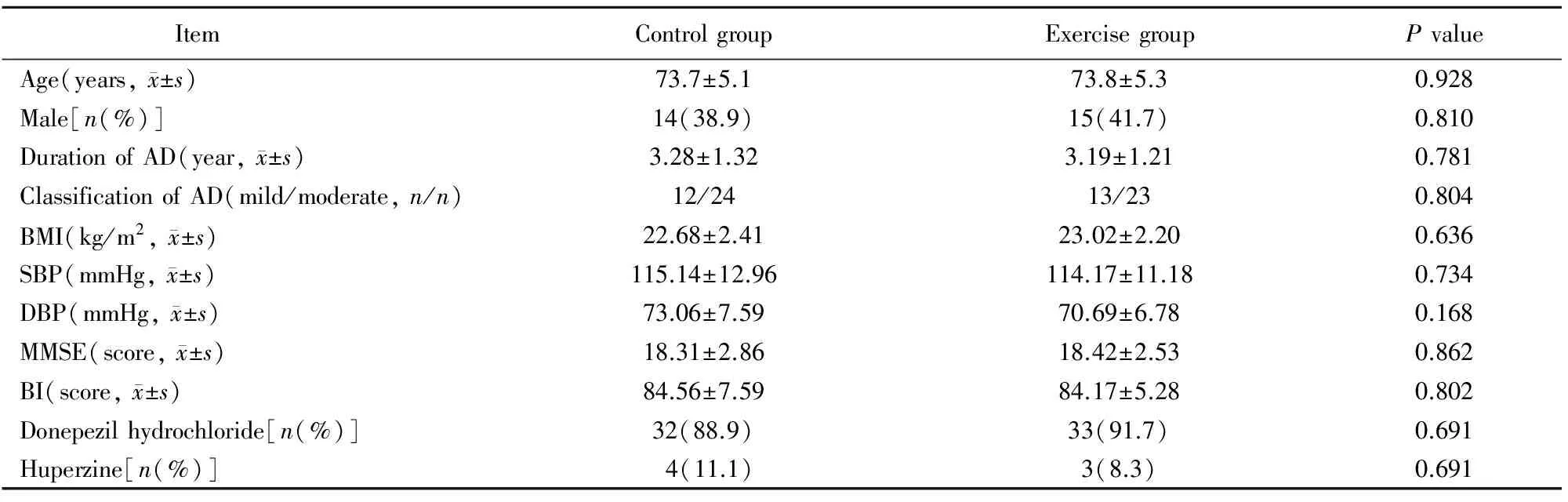
表1 两组患者基线资料比较
AD: Alzheimer’s disease; BMI: body mass index; SBP: systolic blood pressure; DBP: diastolic blood pressure; MMSE: mini-mental state examination; BI: Barthel index. 1 mmHg=0.133 kPa
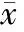
表2 两组患者治疗前后临床效果比较
PSQI: Pittsburgh sleep quality index. Compared with before treatment,*P<0.05; compared with control group,#P<0.05
3 讨 论
AD患者发生睡眠障碍较常见,如长期得不到解除或缓解,一方面将导致机体各方面功能下降,慢性疾病增加或加重,严重影响生活质量;另一方面将加重其认知障碍,使之出现精神症状,给家庭、社会带来沉重的负担。

本研究采用双盲随机对照研究观察快步走对AD伴随睡眠障碍患者的治疗效果。因观察的病例数有限,为了能评估快步走干预方式对患者睡眠障碍的治疗效果,我们在研究中尽量避免药物治疗方式对患者睡眠障碍的影响,整个干预中尽量不调整睡眠药物。经过16周的干预后,运动组睡眠质量、入睡时间、睡眠时间、睡眠效率、睡眠障碍、日间功能障碍得分及PSQI总分较治疗前均明显下降,且与对照组比较,上述指标也显著降低(P<0.05),表明快步走可以从多个纬度改善AD患者的睡眠障碍。另一方面,通过PSQI减分率可以看出,运动组的减分更明显,总有效率亦明显高于对照组,进一步表明,AD患者睡眠障碍的改善是快步走干预方式的结果。
大量研究已证实充足的体力活动对老年人的大脑功能有着积极的影响,然而,关于痴呆老年人进行体力活动的强度、频率、时间和类型等研究目前还缺乏明确统一的结论。快步行走干预方法简单、易行,是一种比较适合老年人的运动方式,因此,本研究通过对伴有睡眠障碍AD患者进行16周快步走的干预,我们观察到快步走可全面改善该类患者的睡眠障碍,具有临床推广价值。
本研究不足之处在于,患者例数有限,研究的时间较短,尚需在以后的研究和临床实践中进一步验证及讨论。
[1] Guamieri B, Adorni F, Musicco M,etal. Prevalence of sleep disturbances in mild cognitive impairment and dementia disorders: a multicenter Italian clinical cross-sectional study on 431 patients[J]. Dement Geriatr Cogn Disord, 2012, 33(1): 50-58. DOI: 10.1159/000335363.
[2] 安翠霞, 许顺江, 宋美, 等. 轻度认知功能损害患者睡眠质量分析[J]. 中华精神科杂志, 2012, 45(5): 295-298. DOI: 10.3760/cma.j.issn.1006-7884.2012.05.012.
An CX, Xu SJ, Song M,etal. Sleep problems in the aged with mild cognitive impairment[J]. Chin J Psychiatry, 2012, 45(5): 295-298. DOI: 10.3760/cma.j.issn.1006-7884.2012.05.012.
[3] Scarmeas N, Levy G, Tang MX,etal. Influence of leisure activity on the incidence of Alzheimer’s disease[J]. Neurology, 2001, 57(12): 2236-2242.
[4] 母海艳, 吕继辉, 郝智慧, 等. 有氧运动对轻中度阿尔茨海默病患者生活能力、认知功能和精神症状的影响[J]. 中华老年多器官疾病杂志, 2016, 15(6): 451-454. DOI: 10.11915/j.issn.1671-5403.2016.06.0106.
Mu HY, Lyu JH, Hao ZH,etal. Effect of aerobic exercise on abilities in daily life,cognitive function and psychological symp-toms in patients with mild to moderate Alzheimer’s disease[J]. Chin J Mult Organ Dis Elderly, 2016, 15(6): 451-454. DOI: 10.11915/j.issn.1671-5403.2016.06.0106.
[5] McKhann GM, Knopman DS, Chertkow H,etal. The diagnosis of dementia due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease[J]. Alzheimers Dement, 2011, 7(3): 263-269. DOI: 10.1016/j.jalz.2011.03.005.
[6] 刘贤臣, 唐茂芹, 胡蕾, 等. 匹兹堡睡眠质量指数的信度和效度研究[J]. 中华精神科杂志, 1996, 29(2): 103-107. DOI: 10.1007/BF02951625.
Liu XC, Tang MQ, Hu L,etal. Pittsburgh sleep quality index to study the reliability and validity[J]. Chin J Psychiatry, 1996, 29(2): 103-107. DOI: 10.1007/BF02951625.
[7] Cole CS, Richards KC. Sleep and cognition in people with Alzheimer’s disease[J]. Issues Ment Health Nurs, 2005, 26(7): 687-698. DOI: 10.1080/01612840591008258.
[8] Cipriani G, Lucetti C, Danti S,etal. Sleep disturbances and dementia[J]. Psychogeriatrics, 2015, 15(1): 65-74. DOI: 10.1111/psyg.12069.
[9] Garuffi M, Costa JL, Hernández SS,etal. Effects of resistance training on the performance of activities of daily living in patients with Alzheimer’s disease[J]. Geriatr Gerontol Int, 2013, 13(2): 322-328. DOI: 10.1111/j.1447-0594.2012.00899x.
[10] Erickson KI, Voss MW, Prakash RS,etal. Exercise training increases size of hippocampus and improve memory[J]. Proc Natl Acad Sci USA, 2011, 108(7): 3017-3022. DOI: 10.1073/pnas.1015950108.
[11] McCurry SM, Pike KC, Vitiello MV,etal. Increasing walking and bright exposure to improve sleep in community-dwelling persons with Alzheimer’s disease: results of a randomized, controlled trial[J]. J Am Geriatr Soc, 2011, 59(8): 1393-1402. DOI: 10.1111/j.1532-5415.2011.03519.x.

