基于t分布函数的玉米群体三维模型构建方法
温维亮,赵春江,郭新宇,王勇健,杜建军,于泽涛
基于分布函数的玉米群体三维模型构建方法
温维亮1,2,3,4,赵春江1,2,3,4※,郭新宇1,2,3,王勇健1,2,3,杜建军1,2,3,于泽涛1,2,3
(1. 北京农业信息技术研究中心,北京 100097; 2. 国家农业信息化工程技术研究中心,北京 100097;3. 数字植物北京市重点实验室,北京 100097; 4. 北京工业大学计算机学院,北京 100124)
为利用少量实测数据快速构建能够反映因品种、环境条件、栽培管理措施等因素产生形态结构差异的玉米群体三维模型,提出基于分布函数的玉米群体三维模型构建方法。通过实测数据构建主要株型参数的分布函数,在其约束下生成群体内各植株主要株型参数,通过构造株型参数相似性度量函数调用玉米器官三维模板资源库中的器官几何模板,结合人工交互或图像提取的各植株生长位置与植株方位平面角2组群体结构信息生成玉米群体几何模型。利用三维数字化仪获取的玉米群体田间原位三维数字化数据所构建玉米群体计算得到的LAI与该方法构建玉米群体计算得到的LAI进行对比验证,结果表明:该方法所生成玉米群体叶面积指数与原位三维数字化数据所构建玉米群体计算得到的LAI相比,误差在±2%以内,可以满足面向可视化计算的玉米结构功能分析研究需求。方法可为玉米株型优化设计、耐密性鉴定、品种适应性评价等虚拟试验研究提供技术手段。
作物;模型;玉米;群体;分布;三维建模;可视化计算
0 引 言
作物群体是履行光合作用和物质生产职能的组织体系,其形态结构对光截获能力、冠层光合效率以及作物产量均具有重要影响,作物群体形态特征一直是人类认识、分析和评价作物的最基本方式。因此,运用农业信息技术快速、准确地构建作物群体的形态结构具有重要的现实意义。
然而,作物群体形态结构复杂,空间分布规律性差、各器官表面结构变异性强,群体间存在大量器官的遮挡、交叉与相互作用,其形态结构不是简单单株复制的物理过程。传统农业对于作物群体形态结构的研究以经验型人工测量试验或利用光谱及图像反演测量作物群体结构统计指标为主[1-2],其难以从三维空间精确刻画作物群体因品种和栽培管理措施所产生的形态差异。因此,研究者提出利用信息技术研究作物群体形态结构的方法[3],即植物结构功能模型研究[4-5]。目前利用三维数字化技术研究作物群体形态结构的方法主要包括:1)田间原位三维数字化方法[6-9]。利用机械式、电磁式或主动拍照式三维数字化仪,通过田间实际采集作物形态骨架结构三维坐标数据,结合网格生成方法1:1地重建作物群体田间三维模型,这种方法重建作物群体精度高,但劳动强度大、效率低,且受田间环境限制。2)田间原位三维扫描法[10-13]。利用三维扫描仪,获取作物田间原位的三维点云信息,实现作物群体的特征提取[14-15]和三维重建,这种方法数据获取效率高,但由于作物群体间交叉、遮挡严重,数据存在较多丢失,目前现有方法多难以处理作物群体三维点云数据,其只能处理结构简单、群体内植株数量少的作物群体,同时对田间环境有着更高的要求,如气流、光照等。3)基于图像结合统计分析的方法[16-23]。利用图像提取作物群体的主要形态特征参数,并结合对作物群体的统计模型先验知识,构建丰富的作物群体几何模型,这种方法不是对作物群体1:1的三维重建,所构建的群体几何模型在一定程度上可以反映群体特征,具有三维模型构建效率高、适于开展进一步虚拟试验的特点,但由于基于图像的群体特征提取方法要求高,难以提取结构复杂作物群体结构信息。4)基于模型参数或交互设计的方法[24-26]。通过作物群体结构参数模型或利用交互设计的方法生成作物群体中各植株、各器官的形态结构参数,实现作物群体的三维数字化,这种方法效率高、适用于开展虚拟试验,但所构建作物群体三维模型相对机械、真实感不强、难以反映作物群体的形态结构特征。
针对作物群体三维数字化研究中存在的效率低、真实感差、所构建作物群体难以反映因品种、环境条件和栽培管理措施等因素产生的形态差异问题,本文以玉米为例,利用统计分析方法,结合玉米三维模板资源库[27],构建能够反映玉米群体特征的三维模型,为开展进一步玉米株型优化、耐密性鉴定等虚拟试验奠定基础[28-30]。
1 玉米株型参数统计模型构建
玉米群体的三维形态结构为自然界发生规律,可以说玉米群体内各植株的株型参数分布服从正态分布[31]。但由于玉米群体内各植株的形态数据获取工作量大,通过大量采集群体内植株的样本数据来构建各株型参数的正态分布密度函数可行性较低。在样本数量较小的条件下,采用分布来描述玉米群体内各株型参数的概率密度分布函数,并在其约束下生成新的玉米群体几何模型。
在实际工作中,正态分布的总体方差往往是未知的,常用样本方差作为总体方差的估计值。设总体随机变量(,2),1,2,, x为取自该总体的个随机样本,当2未知时,以样本方差2替代,则

是自由度为1的分布,记为(−1)。(−1)的概率密度函数为

其中( · )为伽玛函数

当抽样数目增大时,(−1)的方差越来越接近1,同时(−1)分布的形状也越来越接近标准正态分布。理论上,当→∞时,(−1)与标准正态分布完全一致。一般认为≥30就说(−1)与标准正态分布非常接近。
由于玉米株型参数样本数据的获取工作量大,且不同品种、不同栽培管理措施、不同生育时期的玉米植株形态差异较大,由于利用三维数字化仪获取植株三维数字化数据效率较低,人工测量各植株叶片着生高度、叶长、叶倾角和方位角工作量大,样本植株的数据采集往往少于30个,采用正态分布难以描述各株型参数统计特征,分布是与样本数量相关的统计量,更适合描述样本数量较少时的统计特征,故采用分布对各株型参数进行估计分布并生成各株型参数值。
通过人工或表型参数测量方法[32]得到的玉米株型参数作为样本,构建95%置信区间内的概率密度分布函数,在其约束下随机生成对应株型参数,可在一定程度上反映当前玉米品种在当前环境和栽培管理措施下的株型特征。
以株高为例,通过若干植株的株高样本构建株高的概率密度分布函数,并根据该分布函数生成新玉米群体内各植株的株高随机数。
设样本群体包含个植株,各植株株高分别记为X(=1,2,∙∙∙,),样本均值为
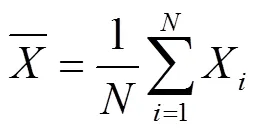
样本方差为
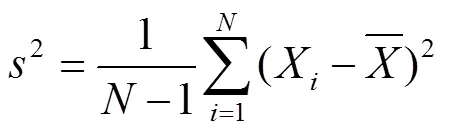
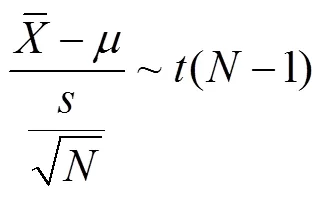

以2015年于北京市农林科学院播种的京科968品种,密度为60 000株/hm2的吐丝期玉米群体(氮260 kg/hm2,磷90 kg/ hm2,钾90 kg/hm2,采用滴灌保证水份充足,于11:00前获取数据)为例,获取了3行×3株的株高数据,分别为2 531.3、2 614.3、2 461.4、2 646.7、2 823.6、2 607.8、2 715.8、2 442.0、2 680.0 mm。利用上述方法,求得样本均值为2 613.7 mm,样本标准差为122.2 mm,总体均值的置信区间为(2 519.7,2 707.6),总体均值的概率密度分布函数如图1a所示。
在株高总体均值的概率密度分布函数的约束下,生成株高均值随机数,作为预构建群体中各植株的株高。例如,预构建4行×8株,共32株的玉米群体,生成的随机株高如图1b所示。
对京科968和先玉335两个品种(密度60 000 株/hm2,氮260 kg/hm2,磷90 kg/ hm2,钾90 kg/hm2,滴灌保证水分充足)的吐丝期玉米群体为目标群体的株高概率密度分布函数进行对比。从所获取的数据集中筛选高质量植株数据,京科968群体包含12株样本数据,先玉335群体包含7株样本数据(与前文9株获取地点方式相同)。应用上述基于分布函数的参数生成方法构建了2个群体的株高分布模型。株高分布模型中(如图1c),先玉335玉米群体株高均值为2 738.11 mm,明显高于京科968的均值2 613.66 mm,但京科968的标准差大于先玉335,故京科968玉米群体内各植株的株高差异更大。说明了利用上述方法生成玉米群体可以反映出不同玉米品种群体间的形态差异。
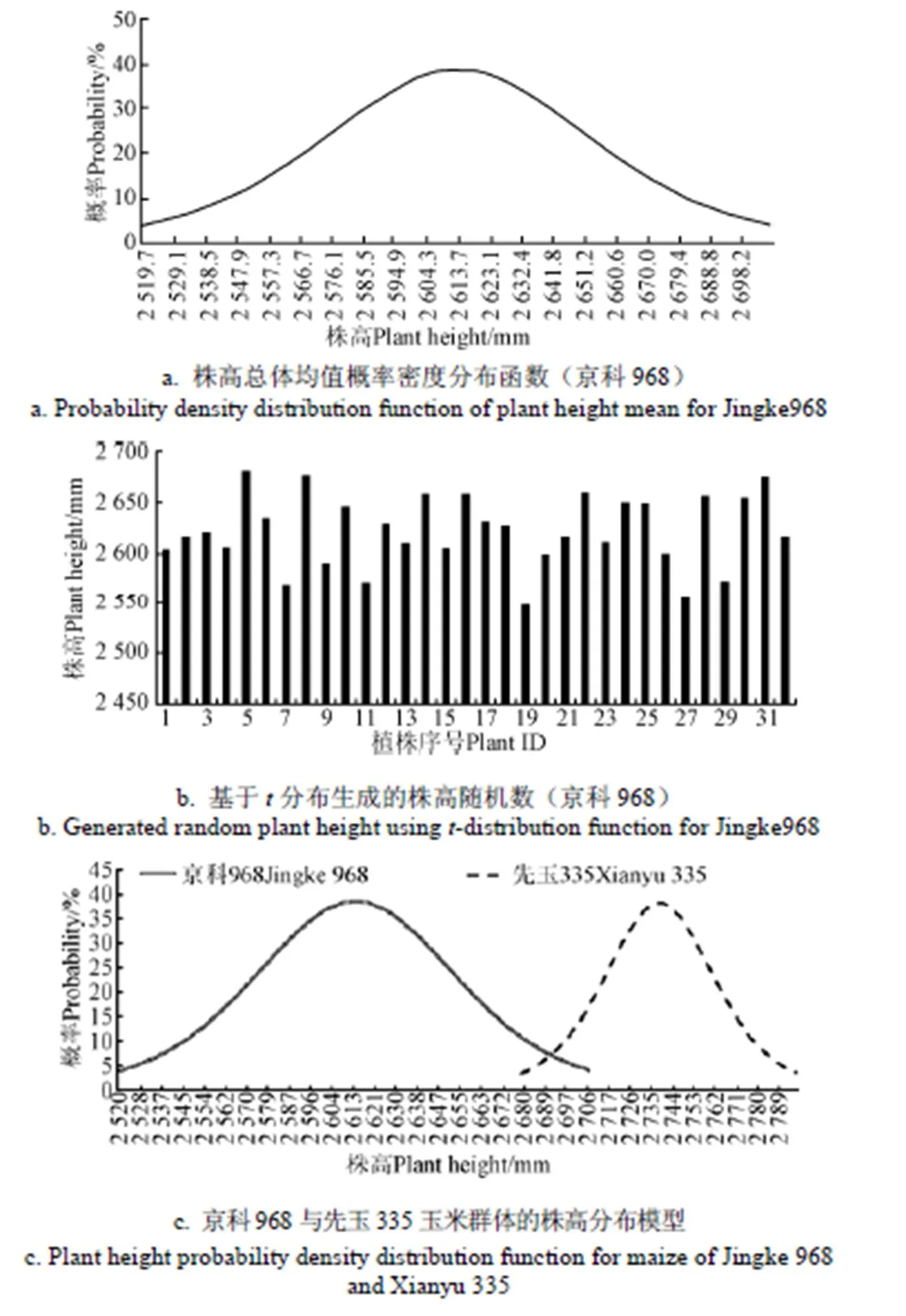
图1 利用玉米株高样本构造t分布并生成新的株高随机数
2 玉米植株株型参数生成
利用上述基于分布的参数生成方法,通过样本参数构建各玉米植株的株型参数概率密度分布函数,可生成各株型参数的随机数,从而进一步实现玉米群体模型的生成。由于各节单位的株型参数随节的不同规律不同,故将株型参数分为植株尺度和节单位尺度2类,节单位尺度参数在株型参数确定后进一步生成。
在玉米群体结构解析研究中,只关注对群体结构影响较大的株型参数,植株尺度株型参数包括各植株株高、叶片总数和首叶叶序(下部叶中最小的叶形相对完整叶片的序号);节单位尺度株型参数包括各叶片着生高度、叶长、叶宽、叶倾角和方位角。
2.1 植株尺度参数生成
植株尺度参数包括株高和叶片总数,此外,由于玉米不同时期下部叶会衰老至萎蔫死亡,这些叶片不在玉米群体几何模型构建的范围内,故引入首叶叶序参数来描述植株首个形态较为完整的叶片序号。
由于叶片总数及首叶叶序这2个参数均为整数,首先将样本参数调整为浮点数来构建概率密度分布函数,并生成叶片总数和首叶叶序的随机数,所生成随机数也为浮点数,最后采用四舍五入的取整形式得到各植株的叶片总数和首叶叶序,图2a为利用上文9株京科968玉米的叶片总数和首叶叶序作为样本构建概率密度分布函数,生成的32株叶片总数和首叶叶序株型参数。
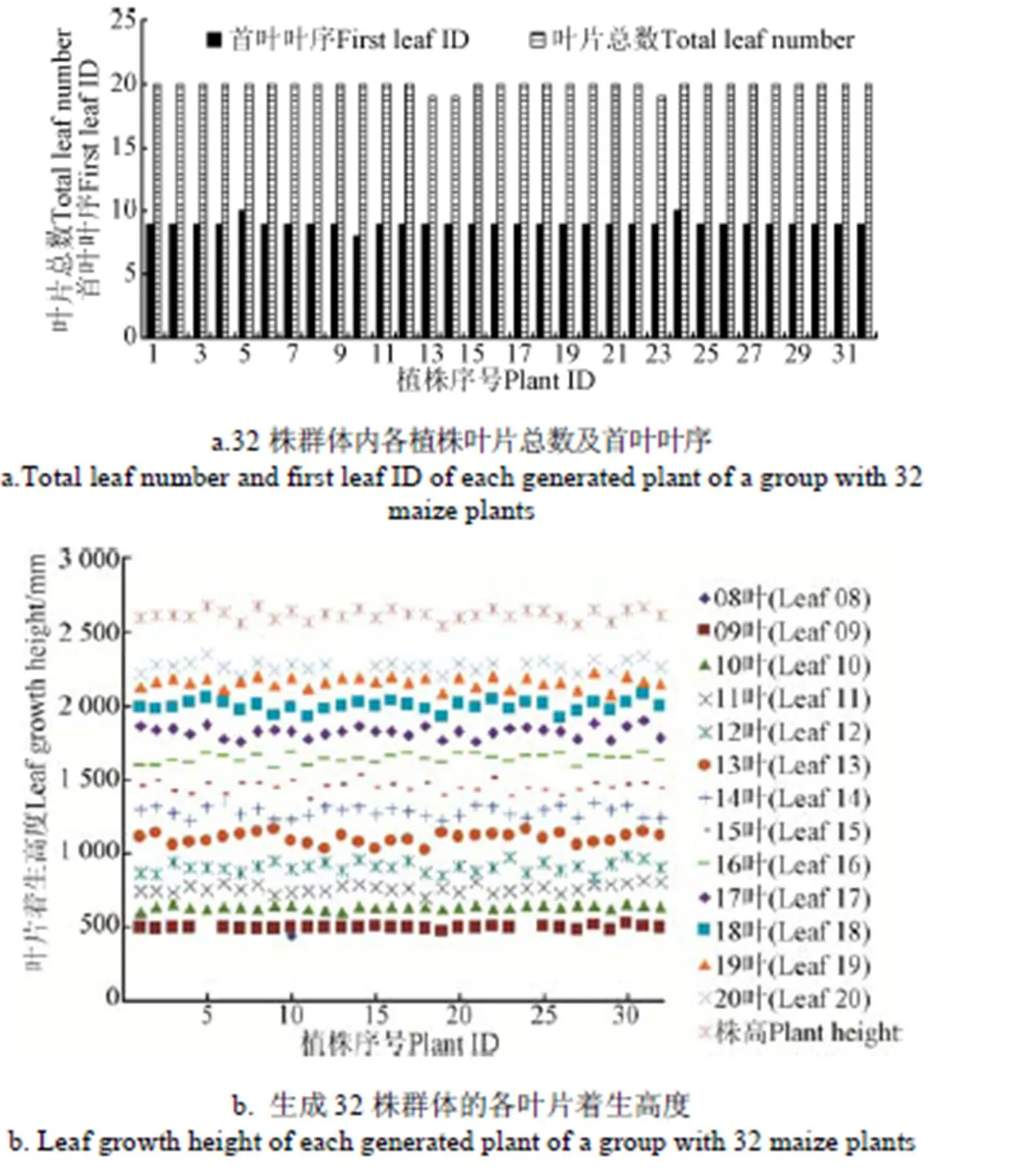
注:08~20叶着生高度依次增大。
2.2 节单位尺度参数生成
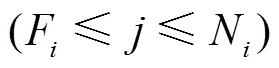
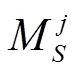
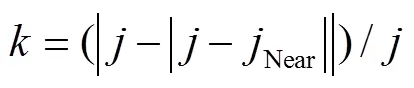
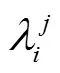
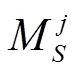
2.3 叶片方位角参数生成
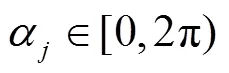
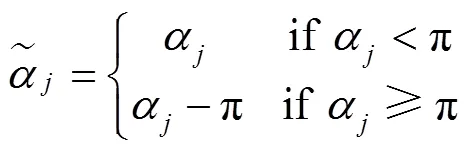

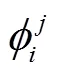
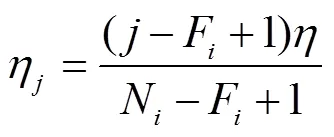
式中j为当前叶序,为增强系数初值,根据目标群体中上部叶方位角偏离规律取值,一般。当上述公式中时,令,以保证中下部叶片方位角不被增强。
3 玉米群体三维模型构建
3.1 单株模型构建
通过实测若干样本植株株型参数数据,并利用上述分布玉米株型分布方法生成预构建群体三维模型各植株的植株尺度和节单位尺度参数后,利用这些参数构建预生成群体内的各植株几何模型。针对玉米虚拟试验对玉米群体几何模型需求,植株模型主要包括叶鞘和叶片。
在玉米生长三维空间中,定义平面为地面、轴正方向为茎秆生长方向,基于株型参数的植株生成各植株各节单位的叶鞘与叶片几何模型。叶鞘与叶片模型主要根据生成的器官尺度株型参数,于玉米器官三维模板资源库[27]中,通过定义的相似性度量函数查找与各叶片相似性最大的器官模板,此处采用利用FastScan结合tx4发射器的三维数字化系统,沿叶脉方向以每排5个点的方式,获取叶鞘和叶片特征点的三维数据点集,根据点集中各点间的位置关系连接网格,建立叶鞘与叶片几何模板(如图4)。确定模板后按叶宽比例(生成的当前叶位叶宽与选定的叶片模板叶宽的比例)对模板在叶宽方向进行等比例缩放,并使缩放变换后的网格模型作为当前叶位的叶片几何模型。所定义相似性度量函数为
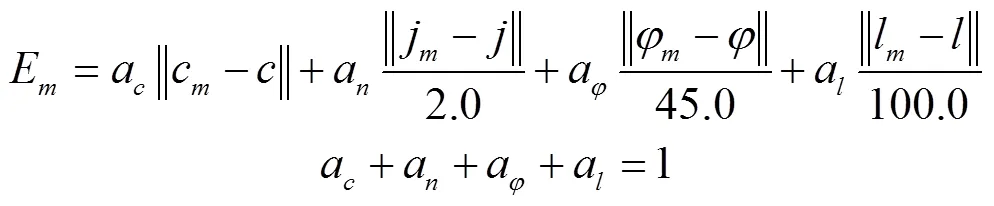
式中c为品种名,j为叶序,为叶倾角,l为叶长,cm、jm、和lm分别为第m个节单位模板对应的品种名、叶序、叶倾角和叶长,ac、an、和al分别为对应参数的系数。在玉米器官三维模板资源库中选取能够使得Em最小的节单位作为当前节单位的模板。其中,如果待选叶片品种c与资源库中第m个节单位品种cm相同,则,否则;叶序、叶倾角和叶长项中的分母常数项取值为根据大量几何模板调用匹配结果校准确定,可通过调整各常数项或系数a调节各参数在度量评价中的重要性。本文各系数取值为ac=an== al=0.25,待资源库中的基于三维数字化仪生成的节单位几何模板更为丰富后,可利用主成分分析法进一步确定各系数的最佳取值。
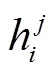
为评估上述方法的可行性,通过获取植株原位株型参数数据,并获取对应品种节单位模板添加到玉米器官三维模板资源库,通过模板调用构建玉米植株三维模型。图5给出了分别利用新疆奇台、宁夏银川和吉林公主岭3个生态点测量的先玉335吐丝期株型数据构建的玉米植株三维模型可视化效果。各植株均按照株高进行了3D视图缩放,其中利用新疆奇台、宁夏银川、吉林公主岭数据生成植株株高分别为379.9 cm(图5a)、312.3 cm(图5b)和299.1 cm(图5c)。由于所构造玉米植株及群体几何模型主要用于开展基于可视化计算的虚拟试验,因此植株几何模型中未包含面元数量较多且对计算结果影响较小的雄穗和雌穗几何模型。

图5 利用先玉335在3个生态点测量数据生成的植株
3.2 群体模型生成
上述方法生成的各单株几何模型,植株生长点都位于原点,且植株方位平面角都为0。利用这些植株构建玉米群体几何模型需要2种群体参数,即各植株的生长位置和各植株在群体中的植株方位平面。可采用用户交互参数或基于图像提取2种方法得到上述参数。
3.2.1 基于用户交互的玉米群体生成
根据用户于田间实测的群体参数,生成玉米群体内各植株生长位置和各植株的植株方位平面角。群体参数主要包括宽行距、窄行距(如果是等行距则设置宽行距=窄行距)、株距、各植株方位平面,利用株行距参数计算得到各植株在平面上的生长坐标点p,分别将已生成的各植株几何模型首先按轴旋转该植株对应的植株方位平面角,然后平移至该植株所对应的植株生长点p处,即生成了目标群体的三维模型。
3.2.2 基于图像提取的玉米群体生成
随着农业物联网技术的发展,一些大田的配套信息化设施已非常完善,这些设施中包含了大量安装在田间的图像获取装置,但这些装置目前多用于安防和作物长势监测。本文利用这些田间图像获取装置[34],通过从图像中提取群体内各植株茎和各叶尖点的像素坐标,结合图像分辨率标记参数,实现玉米群体中各植株生长位置和叶片方位角结构参数的自动获取,以反映田间玉米因群体竞争的实际生长状态。由于玉米群体在拔节期间,其生长位置和植株方位平面均已确定,且此时植株间相互独立,采用俯视图像获取玉米群体生长数据并采用图像解析的方法提取目标群体内各植株的生长位置与各植株叶片的方位角,进一步利用植株方位平面计算方法计算各植株的方位平面,用于指导玉米群体的模型构建。由于玉米拔节期上部正在生长的3个叶片的方位角处于解旋状态,其叶方位角由于动态生长仍在连续变化,故不参与玉米植株方位平面的计算。通过计算图像中提取到的叶片投影长度并设置阈值(所有投影叶长均值的1/3),剔除处于解旋过程的叶片,筛选得到参与植株方位平面角计算的叶片。图6为基于图像提取的玉米群体内各植株的生长位置与植株方位平面示意图,图6b中点表示提取的植株生长位置坐标,线表示各植株方位平面朝向。

图6 基于图像提取的玉米群体内各植株的生长位置与植株方位平面示意图
4 试验与结果分析
4.1 试验设计
为说明本方法可以反映玉米群体的农学特征,选取了不同生态点、不同品种和密度的玉米群体作为数据元,进而以可视化的角度说明方法的有效性。为说明上述方法所构建玉米群体几何模型的有效性,于2017年7月在新疆奇台县玉米高产试验田获取先玉335不同密度下的玉米群体3D数字化数据,每个群体为3行×3株共9株,密度分别为10.5×104、13.5×104和16.5×104株/hm2,小区种植方法为宽窄行种植,光热资源丰富、全生育期通过水肥一体化灌溉保证水肥充足,宽窄行距分别为70和40 cm,并采用AccuPAR冠层分析仪,通过同时测量冠层顶部和冠层底部的光合有效辐射获取玉米群体的叶面积指数(LAI),每个小区平行于行向于宽行和窄行分别测量3次,并取6次测量的平均值作为各群体的LAI。采用FastScan结合tx4发射器的三维数字化系统获取玉米三维数字化数据,其精度为0.76 mm,利用该数据构建各群体的三维模型。通过计算各玉米群体三维模型中所有叶片面积的总和除以小区内所有植株占的土地面积(各植株占土地面积利用密度计算),得到各小区的真实LAI。此外,为了说明方法所构建玉米群体可以反映玉米群体的农学特征,于吉林公主岭市试验田获取了4株先玉335吐丝期玉米植株形态数据(行距为60 cm,株距为22.222 cm,密度为7.5×104株/hm2)。
4.2 结果分析
利用上述玉米群体三维模型构建方法,可快速生成玉米群体三维模型。图7a为利用2017年于新疆奇台县获取的9株先玉335吐丝期玉米植株形态数据作为样本数据,构建的4行×6株,共24株的玉米群体,株距为13.468 cm,密度为13.5×104株/hm2。图7b为利用2017年于吉林公主岭市获取的4株先玉335吐丝期玉米植株形态数据作为样本,构建3行×6株,共18株的玉米群体。在配置为E5-2603v3的双CPU、16GB内存的工作站上,备选节单位模板为300组的情况下,生成上述2组群体三维模型均可在3 s内完成。对比图7的2组玉米群体三维模型可知,方法所构造的玉米群体几何模型具有明显的形态差异。
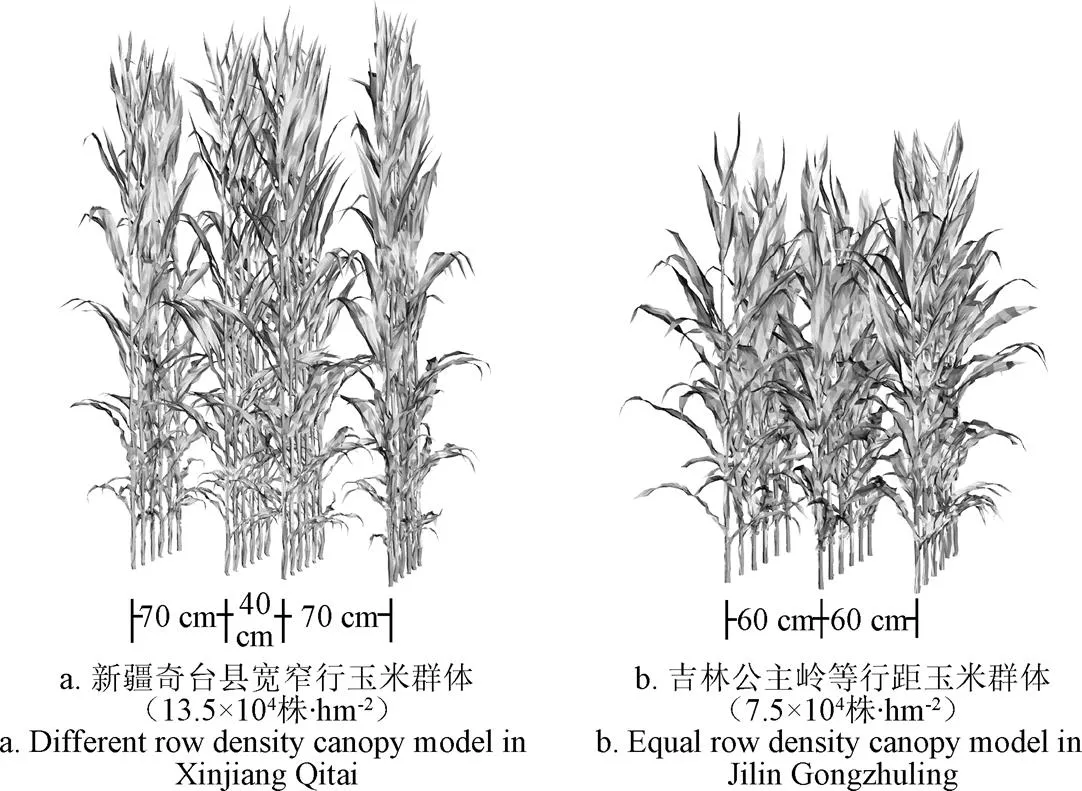
图7 生成的不同密度玉米群体三维模型可视化
4.3 模型验证
采用计算玉米群体LAI的方式对玉米群体建模方法进行验证。利用上述玉米群体生成方法和所获取的试验数据,生成3行×3株先玉335各密度的玉米群体,所构建群体可视化效果如图8所示。

图8 不同密度先玉335玉米群体三维模型
利用AccuPAR实测的LAI、基于群体3D数字化数据计算的LAI以及利用生成群体计算的LAI结果见表1。由于AccuPAR是用于测量作物冠层光合有效辐射分布和LAI等冠层指标的仪器设备,其测量LAI是利用冠层内光的透过率反演;利用3D数字化仪获取的玉米群体原位3D数字化数据是对玉米群体三维结构的真实还原,故认为基于群体原位3D数字化数据计算得到的LAI是真值。利用3D数字化数据计算基于分布方法生成群体LAI的误差,3组群体的误差均在±2%以内。由于本方法是统计意义上的3D建模,不是1:1的三维重建,误差达到10%以内即认为方法可以反映不同栽培密度下的玉米群体形态结构差异,可以满足农学形态结构分析的需要。
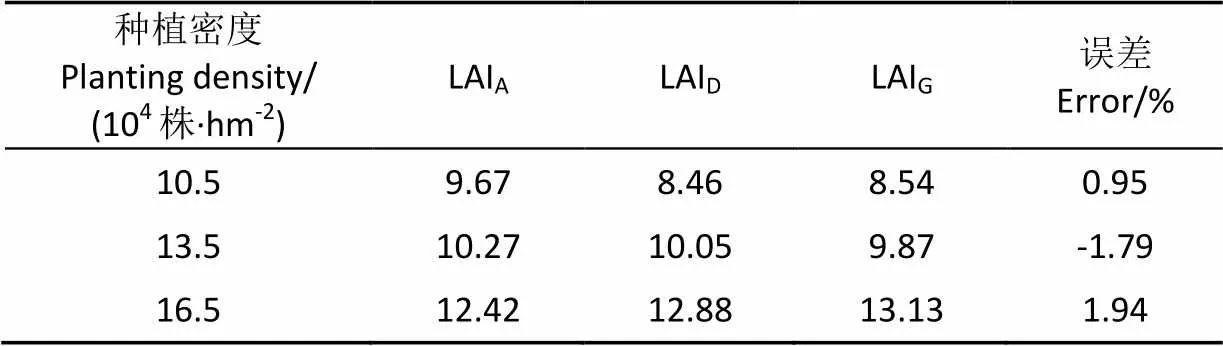
表1 利用玉米群体三维模型计算LAI验证
注: LAIA表示利用AccuPAR测量的LAI;LAID表示利用三维数字化仪测量数据重建的玉米群体计算得到的LAI;LAIG表示利用本方法生成玉米群体计算得到的LAI;误差为(LAIG-LAID)/ LAID×100%。
Note: LAIAdenotes the LAI measured using AccuPAR; LAIDdenotes the LAI of 3D canopy model reconstructed using the 3D digitized data; LAIGdenotes the LAI of 3D canopy generated by this method; The error is calculated as (LAIG-LAID)/ LAID×100%.
采用LAI计算的思想,对玉米群体进行分层,每20 cm一层,计算各层以上的广义LAI,即当计算高度为对应的广义LAI时,通过计算群体中所有高度大于的叶面积总和除以当前群体占用的单位土地面积。利用在新疆奇台县获取的先玉335吐丝期13.5×104株/hm2密度的玉米群体数据,通过调整随机数种子(用其控制每次生成的随机数是不同的)和公式(11)中的增强系数初值,生成10组玉米群体三维模型,分别计算各高度的广义LAI,并与基于表1中对应的利用群体原位3D数字化数据所构建的玉米群体三维模型计算的对应广义LAI进行对比。计算各组数据的均方根误差RMSE(root mean square error)和归一化均方根NRMSE(normalized root mean square error)
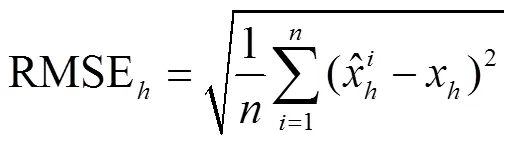
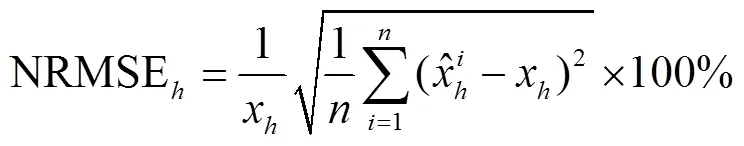
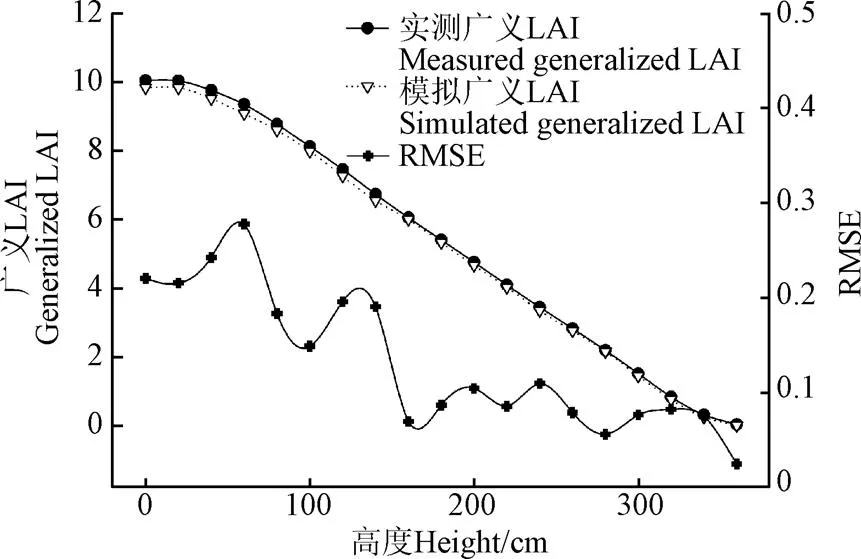
图9 生成和实测先玉335玉米群体各高度的广义LAI对比及RMSE(13.5×104株∙hm-2)
5 讨 论
玉米群体形态结构的复杂性使得玉米群体三维模型构建中存在着诸多问题,本文从统计角度构建了可用于开展虚拟试验的玉米群体三维模型,仍有很多后续工作需要开展:
1)目前基于分布的玉米群体三维模型构建中,所生成的株型参数是相互独立的,尚未建立相邻器官间的约束关系,如各植株的相邻节单位的叶片着生高度差会出现过大或过小等问题,需在今后通过大量获取田间实测数据建立品种分辨率的玉米株型参数约束关系,使利用分布生成的株型参数具有更好的自调节特性,提高所构建玉米群体三维模型的精度。
2)玉米群体中存在这大量器官交叉和碰撞的现象,种植密度越高碰撞越多,主要发生在穗位叶,本文所生成的玉米群体为利用分布约束随机生成株型参数得到,仍存在大量的器官碰撞检测和碰撞响应问题,须在今后的工作中加以解决。
3)所生成玉米群体几何模型在网格质量和数量方面有待提升,需结合玉米器官网格简化与优化方法[35],生成适用于可视化计算的玉米群体网格模型,并开展进一步基于冠层光分布计算的虚拟试验。
6 结 论
本文针对作物结构功能计算分析对群体三维模型的需求,提出基于分布函数的玉米群体几何模型构建方法。方法以少量实测株型样本参数为输入,结合玉米器官三维模板资源库,可快速生成玉米群体三维模型。通过与田间实测群体计算得到的LAI对比,利用本方法生成群体LAI误差在±2%以内,不同高度玉米群体广义LAI与实测值具有较好的一致性,可以满足玉米群体结构分析的需求。与已有基于田间三维数字化、田间原位三维扫描等方法相比,本方法具有效率高的特点;与基于模型参数或交互设计的方法相比,本方法所构建玉米群体三维模型真实感较高,同时更能够反映群体的农学特征。基于分布的玉米群体三维模型构建方法对于从三维尺度进行玉米株型优化、玉米耐密性鉴定、玉米品种适应性评价、玉米栽培策略决策等研究与应用具有重要作用。
[1] Cescatti A. Indirect estimates of canopy gap fraction based on the linear conversion of hemispherical photographs: Methodology and comparison with standard thresholding techniques[J]. Agricultural and Forest Meteorology, 2007, 143(1): 1-12.
[2] Potgieter A B, George-Jaeggli B, Chapman S C, et al. Multi-spectral imaging from an unmanned aerial vehicle enables the assessment of seasonal leaf area dynamics of sorghum breeding lines[J]. Frontiers in Plant Science, 2017(8): 1532.
[3] Gibbs J A, Pound M, French A P, et al. Approaches to three-dimensional reconstruction of plant shoot topology and geometry[J]. Functional Plant Biology, 2016, 44(1): 62-75.
[4] Henke M, Kurth W, Buck-Sorlin G. FSPM-P: Towards a general functional-structural plant model for robust and comprehensive model development[J]. Frontiers of Computer Science, 2016, 10(6): 1103-1117.
[5] Vos J, Evers J B, Buck-Sorlin G H, et al. Functional- structural plant modelling: A new versatile tool in crop science[J]. Journal of Experimental Botany, 2010, 61(8): 2101-2115.
[6] Xiao B, Wen W, Guo X. Digital plant calony modeling based on 3D digitization[J]. ICIC Express Letters.an International Journal of Research & Surveys. Part B Applications, 2011, 2(6): 1363-1367.
[7] Zheng B, Shi L, Ma Y, et al. Comparison of architecture among different cultivars of hybrid rice using a spatial light model based on 3-D digitising[J]. Functional Plant Biology, 2008, 35(10): 900-910.
[8] Wang X, Guo Y, Wang X, et al. Estimating photosynthetically active radiation distribution in maize canopies by a three-dimensional incident radiation model[J]. Functional Plant Biology, 2008, 35(10): 867-875.
[9] Frasson R P D M, Krajewski W F. Three-dimensional digital model of a maize plant[J]. Agricultural and Forest Meteorology, 2010, 150(3): 478-488.
[10] Paulus S, Schumann H, Kuhlmann H, et al. High-precision laser scanning system for capturing 3D plant architecture and analysing growth of cereal plants[J]. Biosystems Engineering, 2014, 121(18): 1-11.
[11] Yin K, Huang H, Gong M, et al. Full 3D plant reconstruction via intrusive acquisition[J]. Computer Graphics Forum, 2016, 35(1): 272-284.
[12] Haemmerle M, Hoefle B. Effects of reduced terrestrial LiDAR point density on high-resolution grain crop surface models in precision agriculture[J]. Sensors, 2014, 14(12): 24212-24230.
[13] Fumiki H, Kazushige N, Kenji O. 3-D modeling of tomato canopies using a high-resolution portable scanning Lidar for extracting structural information[J]. Sensors, 2011, 11(2): 2166-2174.
[14] 苏伟,郭皓,赵冬玲,等. 基于地基激光雷达的玉米真实叶面积提取方法研究[J]. 农业机械学报,2016,47(7):345-353. Su Wei, Guo Hao, Zhao Dongling, et al. Estimation of actual leaf area of maize based on terrestrial laser scanning[J]. Transactions of the Chinese Society for Agricultural Machinery, 2016, 47(7): 345-353. (in Chinese with English abstract)
[15] Danson F M, Hetherington D, Morsdorf F, et al. Forest canopy gap fraction from terrestrial laser scanning[J]. IEEE Geoscience & Remote Sensing Letters, 2007, 4(1): 157-160.
[16] Louarn G, Lecoeur J, Lebon E. A three-dimensional statistical reconstruction model of grapevine () simulating canopy structure variability within and between cultivar/training system pairs[J]. Annals of Botany, 2008, 101(8): 1167-1184.
[17] 宗泽,张雪,郭彩玲,等. 基于骨架提取算法的作物表型参数提取方法[J]. 农业工程学报,2015,31(增刊2):180-185. Zong Ze, Zhang Xue, Guo Cailing, et al. Crop phenotypic parameters extraction method based on skeleton extraction algorithm[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(Supp.2): 180-185. (in Chinese with English abstract)
[18] Bradley D, Nowrouzezahrai D, Beardsley P. Image-based reconstruction and synthesis of dense foliage[J]. ACM Transactions on Graphics, 2013, 32(4): 74.
[19] Burgess A J, Retkute R, Pound M P, et al. Image-based 3D canopy reconstruction to determine potential productivity in complex multi-species crop systems[J]. Annals of Botany, 2017, 119(4): 517-532.
[20] Lati R N, Manevich A, Filin S. Three-dimensional image-based modelling of linear features for plant biomass estimation[J]. International Journal of Remote Sensing, 2013, 34(17): 6135-6151.
[21] Guo W, Zheng B, Duan T, et al. EasyPCC: Benchmark datasets and tools for high-throughput measurement of the plant canopy coverage ratio under field conditions[J]. Sensors, 2017, 17(4): 798.
[22] España M L, Baret F, Aries F, et al. Modeling maize canopy 3D architecture: Application to reflectance simulation[J]. Ecological Modelling, 1999, 122(1): 25-43.
[23] Scharr H, Briese C, Embgenbroich P, et al. Fast high resolution volume carving for 3D plant shoot reconstruction[J]. Frontiers in Plant Science, 2017, 8: 1680.
[24] Birch C J, Andrieu B, Fournier C, et al. Modelling kinetics of plant canopy architecture-concepts and applications[J]. European Journal of Agronomy, 2003, 19(4): 519-533.
[25] Ma Y, Wen M, Guo Y, et al. Parameter optimization and field validation of the functional-structural model GREENLAB for maize at different population densities[J]. Annals of Botany, 2008, 101(8): 1185-1194.
[26] Guo Y, Ma Y, Zhan Z, et al. Parameter optimization and field validation of the functional–structural model Greenlab for maize[J]. Annals of Botany, 2006, 97(2): 217-230.
[27] 温维亮,郭新宇,卢宪菊,等. 玉米器官三维模板资源库构建[J]. 农业机械学报,2016,47(8):266-272. Wen Weiliang, Guo Xinyu, Lu Xianju, et al. Three-dimensional template resource library construction of maize organs[J]. Transactions of the Chinese Society for Agricultural Machinery, 2016, 47(8): 266-272. (in Chinese with English abstract)
[28] Song Q F, Zhang G L, Zhu X G. Optimal crop canopy architecture to maximise canopy photosynthetic CO2uptake under elevated CO2: A theoretical study using a mechanistic model of canopy photosynthesis[J]. Functional Plant Biology, 2013, 40(2): 109-124.
[29] Wang Y, Song Q, Jaiswal D, et al. Development of a three-dimensional ray-tracing model of sugarcane canopy photosynthesis and its application in assessing impacts of varied row spacing[J]. Bioenergy Research, 2017, 10(3): 626-634.
[30] Mao L, Zhang L, Evers J B, et al. Identification of plant configurations maximizing radiation capture in relay strip cotton using a functional-structural plant model[J]. Field Crops Research, 2016, 187: 1-11.
[31] Schlueter J A, Dixon P, Granger C, et al. Mining EST databases to resolve evolutionary events in major crop species.[J]. Genome, 2004, 47(5): 868-876.
[32] Tardieu F, Cabrera-Bosquet L, Pridmore T, et al. Plant phenomics, from sensors to knowledge[J]. Current Biology, 2017, 27(15): 770-783.
[33] 马韫韬,郭焱,李保国. 应用三维数字化仪对玉米植株叶片方位分布的研究[J]. 作物学报,2006,32(6):791-798. Ma Yuntao, Guo Yan, Li Baoguo. Azimuthal distribution of maize plant leaves determined by 3D digitizer[J]. Acta Agronomica Sinica, 2006, 32(6): 791-798. (in Chinese with English abstract).
[34] 杜建军,袁杰,王传宇,等. 基于玉米冠层原位监测的全生育期叶色建模及其应用[J]. 农业工程学报,2017,16(33):188-195. Du Jianjun, Yuan Jie, Wang Chuanyu, et al. Modeling of maize canopy color in whole growth period based on in-situ monitoring system and its application[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 16(33): 188-195. (in Chinese with English abstract)
[35] Wen W, Li B, Guo X, et al. Simplified model of plant organ for visual computation[J]. Journal of Information & Computational Science, 2015, 12(6): 2213-2220.
Construction method of three-dimensional model of maize colony based on-distribution function
Wen Weiliang1,2,3,4, Zhao Chunjiang1,2,3,4※, Guo Xinyu1,2,3, Wang Yongjian1,2,3, Du Jianjun1,2,3, Yu Zetao1,2,3
(1.100097,; 2.100097; 3.100097,; 4100124,)
Crop colony is the organization system which performs photosynthesis and dry matter production function. Its morphological structure has important influence on light interception ability, canopy photosynthetic efficiency and crop yield. The morphological characteristics of crop colony have always been the most basic way for people to recognize, analyze and evaluate crops. Therefore, it is of great practical significance to rapidly and accurately model and analyze the morphology of crop colony in a digital and visual way. Morphological data acquisition of maize colony is labor-intensive and time-consuming, and thus a-distribution based three-dimensional (3D) maize colony modeling method was proposed using a few measured data. The method constructs-distribution function of primary plant morphological parameters using measured data and generates random plant morphological parameters under the constraint. The main plant morphological parameters include plant and phytomer scale. Here plant scale parameters include plant height, total leaf number, and first leaf index, and phytomer scale parameters include leaf growth height, leaf insertion angle, leaf length, leaf width, and leaf azimuthal angle. Particularly, leaf azimuthal angles are generated using the deviations between the plant azimuthal plane and leaf azimuths. High quality geometric models in 3D template resource database of maize organs are selected by constructing a similarity assess function of plant morphological parameters. Leaf length, leaf insertion angle, leaf index, and plant cultivar are the control parameters in the function. Then geometric models of individual plants in target colony are generated. Interactive design or field image extraction method is used to allocate the growth positions and plant azimuthal planes of each plant in the colony. Maize colony is generated by moving and rotating operations of each plant according to the designed or extracted growth positions and plant azimuthal planes. Leaf area index (LAI) is used to validate the generated maize colony model. Three in-situ field measurement experiments in Qitai County of Xinjiang using 3D digitizer were carried out to reconstruct geometric models of maize colony, and the cultivar was Xianyu 335 and the planting densities were 105, 135, and 165 thousand plants/hm2, as true values for LAI calculating. Corresponding plant morphological parameters of the corresponding colonies were measured. The maize colony modeling method based on-distribution function was used to construct 3D models and LAI was also calculated for the colonies. Results show that the LAI errors are less than ±2%. In addition, generalized LAI of different heights of plant colony is proposed to provide more detailed verification in different height levels. The averaged RMSE (root mean square error) of Xianyu 335 with the density of 135 thousand plants/hm2is 0.023, and the averaged NRMSE (normalized root mean square error) is 0.425, which demonstrate that it has a good consistency of spatial leaf distribution between the in-situ measured field colony and reconstructed colony using-distribution. These results show that the proposed maize colony modeling method could meet the needs of plant functional-structural analysis. Compared with the existing methods, the proposed method is more effective and highly realistic, and the constructed maize colonies are capable of reflecting the agronomic characteristics of the target colony, such as the differences caused by intrinsic cultivar, environment, planting, or management factors. Maize colony model could be rapidly generated by simple modification of morphological input parameters. Combined with the light distribution simulating algorithm, a large number of maize colony models will be designed for virtual experiments. It has great importance for the research and application of maize plant morphology optimization, estimation of planting density, adaptability evaluation of different cultivars, and cultivation strategy decision. Due to the complexity of maize colony structure morphology, there are still many subsequent colony modeling issues that will be addressed in future research, such as adjacent phytomer parameters constraint model construction, plant collision detection and collision response, and colony mesh simplification and optimization for visual computing.
crops; models; maize; colony;-distribution function; three-dimensional modeling; visual computing
2017-10-23
2018-01-31
863计划(2013AA102404-02);国家自然科学基金资助项目(31601215);北京市农林科学院青年科研基金(QNJJ201625);北京市农林科学院数字植物科技创新团队(JNKYT201604)资助
温维亮,辽宁本溪人,助理研究员,博士,主要从事数字植物应用研究。Email:wenwl@nercita.org.cn
赵春江,河北保定人,博士,研究方向为农业信息技术与智能装备。Email:zhaocj@nercita.org.cn
10.11975/j.issn.1002-6819.2018.04.023
S11+4;S126
A
1002-6819(2018)-04-0192-09
温维亮,赵春江,郭新宇,王勇健,杜建军,于泽涛. 基于分布函数的玉米群体三维模型构建方法[J]. 农业工程学报,2018,34(4):192-200.doi:10.11975/j.issn.1002-6819.2018.04.023 http://www.tcsae.org
Wen Weiliang, Zhao Chunjiang, Guo Xinyu, Wang Yongjian, Du Jianjun, Yu Zetao. Construction method of three-dimensional model of maize colony based ondistribution function[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(4): 192-200. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2018.04.023 http://www.tcsae.org

