信号肽对溶血素在大肠杆菌中跨膜转运的影响
齐安生,张秀娟,宫枫举,张兴进,马 喆,潘子豪,孙学强,
(1. 黑龙江省动物卫生监督所,黑龙江哈尔滨 150069;2. 中国动物卫生与流行病学中心,山东青岛 266032;3. 青岛立见诊断技术发展中心,山东青岛 266114;4. 南京农业大学,江苏南京 210095)
1971年洛克菲勒大学细胞生物学教授Blobel提出了“信号假说”(Signal hypothesis),用以解释生理状态下细胞内蛋白质合成后的去向问题。随后该假说得到了证实并具有普遍意义,他因此获得了1999年诺贝尔生理学医学奖。“信号假说”认为蛋白质的合成在核糖体上进行。信号肽(Signal peptide)是蛋白质的一个片段,能够引导核糖体并定位于内质网上,并将不断合成的肽链穿过通道,随后信号肽被切割下来,完整的蛋白被释放进内质网腔后被转运到胞外[1]。研究发现,一般情况下,新生蛋白通常在位于其N端信号肽的指引下到达细胞特定区域,并由其介导完成跨膜转运[2]。
猪链球菌属于链球菌属,现在公认的血清型有33个, 其 中2型(Streptococcus suis type 2,SS2)最为常见,也最重要[3]。大多数SS2分离株都能产生溶血素并分泌至细胞外。猪链球菌溶血素(Suilysin,SLY)属巯基活化的溶细胞素家族(TACY)溶血素[4],为单链多肽,N端70个残基(1/8的分子量)可以被除去而不影响其溶红细胞活性。通过对其基因序列的分析发现5´端约81 bp编码的27个氨基酸残基为信号肽序列。该序列与SLY结构蛋白的跨膜转运有关。
本试验以溶血素基因为主要研究对象,探索了信号肽对溶血素在大肠杆菌中跨膜转运的影响。
1 材料和方法
1.1 菌株、抗体、酶等
猪链球菌2型HA9801株、pET28a(+)质粒、大肠杆菌DH5α和Rosetta株:由本实验室保存;猪链球菌2型溶血素单克隆抗体:由华中农业大学金梅林教授馈赠;Taq酶、限制酶:购自宝生物(大连)工程有限公司;引物:由南京金斯瑞生物科技有限公司合成;硝酸纤维素膜及电泳试剂等:Sigma公司产品;核酸胶回收试剂盒、质粒小量提取试剂盒、HRP-SPA、增强型HRP-DAB底物显色试剂盒:购自天根生化科技(北京)有限公司。
1.2 基因克隆、合成及表达载体的构建
根据GenBank公布序列DQ443530和生物信息学分析设计合成3条引物:
S1-F:GGAGCCATGGGAAAAAGTTCGCACTTGATT;
S2-F:GCTGCCATGGATTCCAAACAAGATATTAATCAGTA;
S-R:CGCAGGATCCTTACTCTATCACCTCATCCGCATAC
以猪链球菌2型HA9801株基因组为模板,分别以S1-F和S-R、 S2-F和S-R为引物对,经53 ℃退火、72 ℃延伸2 min,30个循环,扩增得到带有信号肽的溶血素基因sly1和扩增不带有信号肽的溶血素基因sly2;将sly1和sly2双酶切后分别定向克隆至原核表达载体pET28a(+),构建原核表达载体pET28a/sly1和pET28a/sly2(图1)。
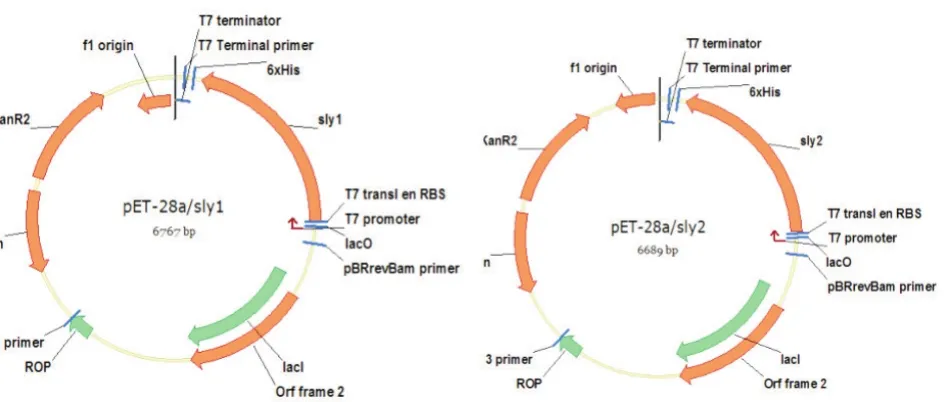
图1 pET28a/sly1和pET28a/sly2质粒图谱
pET28a/sly1和pET28a/sly2转化DH5α感受态细胞并在含有卡那霉素的LB琼脂平板进行筛选。经PCR、酶切和测序分析鉴定正确后,分别选1株阳性克隆转化Rosetta表达宿主菌,并在卡那氯霉素双抗性平板进行筛选。
1.3 溶血素的诱导表达
重组表达载体pET28a/sly1和pET28a/sly2转化Rosetta后,各挑选1株,分别命名为Rsly1和Rsly2,接种含有卡那氯霉素的LB液体培养基,振荡过夜后,按照2%体积接种50 mL含有卡那氯霉素双抗性LB液体培养基,振荡培养4 h后,加入IPTG诱导3 h,然后12 000 r/min 4 ℃离心5 min,分别收集上清和菌体。设立未加IPTG进行诱导的对照,并同步同方法处理。
对Rsly1和Rsly2的诱导培养物离心上清,用0.22 μm的微孔滤膜过滤后,取3 mL加入终浓度为10%的三氯醋酸(TCA)冰浴30 min,然后10 000 g 4 ℃离心15 min,弃上清,加入500 μL冷丙酮洗涤,10 000 g 4 ℃离心15 min,去掉上清,风干5 min,然后加入32 μL 1×PBS充分溶解,沉淀后分别命名为rSLY1´和rSLY2´。将Rsly1和Rsly2的诱导培养菌体用1×PBS洗涤2次,最后用20 mL充分悬浮,取样后超声波破碎,12 000 g 4 ℃离心20 min,取上清用0.22 μm的微孔滤膜过滤,分别命名为rSLY1和rSLY2。未进行诱导的Rsly1和Rsly2对照同步同方法处理。
1.4 天然野生型SLY的提取
参照陈国强[5]等方法,将过夜培养的猪链球菌2型HA9801株种子液,按照2%体积接种5L THB液体培养基,37 ℃静置培养约12 h后,离心收集上清,加入硫酸铵至终浓度达到50%饱和度,离心收集沉淀,用40 mL 20 mmol/L的Tris-HCl重悬沉淀,经过透析脱盐后,超滤浓缩为8 mL,分装−20 ℃冻存,命名为SLY。
1.5 重组溶血素的溶血活性试验
将rSLY1和rSLY2用Thermo NanoDrop 2000测定总蛋白含量。参照Gottschalk等方法[12],各取0.5 mL加入2.5 mol/L的二硫代苏糖醇(DTT)至终浓度为5 mmol/L,室温孵育30 min后,分别用0.5 mL PBS进行倍比稀释;加入0.5 mL 2%(V/V)的兔血红细胞,同时设0.5 mL超纯水阳性对照和PBS阴性对照;颠倒混匀后,37 ℃静置孵育1 h,然后6 000 g 离心5 min;分别取各样本200 μL上清,用分光光度计测定A540。在PBS阴性对照不溶血,即A540约为0的条件下,以吸光值达到超纯水阳性对照的50%为1个溶血活性单位,计算各样本的溶血活性单位。
1.6 固体培养的信号肽功能试验
将Rsly1和Rsly2移植至含有IPTG的卡那霉素氯霉素的8%绵羊血的琼脂平板,37 ℃培养24 h后观察溶血结果。
1.7 液体培养的信号肽功能试验
按照常规方法制备5%的浓缩胶和12%分离胶;将样本 SLY、rSLY1´、rSLY2´、rSLY1、rSLY2,分别按比例加入5×SDS-PAGE载样缓冲液后煮沸6 min,10 000 r/min 4 ℃离心5 min,然后取各上样10 μL进行电泳。
采用半干法转印至NC膜后,用5%的脱脂奶封闭过夜;将转印膜在含20 μL SLY单抗的20 mL TBST中,37 ℃孵育1 h;然后用TBST洗涤2次,每次10 min;20 mL TBST+20 HRP-SPA 37 ℃作用1 h后,用TBST洗涤2次;用DAB显色约30 s后终止反应,晾干观察。
2 结果
2.1 基因克隆及表达载体的构建
以猪链球菌2型HA9801株基因组为模板,扩增获得带有信号肽序列的sly1(长度约为1 500 bp)和不带有信号肽序列的sly2(长度约为1 400 bp)的猪链球菌2型溶血素基因。构建的pET28a/sly1和pET28a/sly2,经PCR和双酶切鉴定均正确。

图2 Rsly1和Rsly2固体培养溶血活性
2.2 重组溶血素的溶血活性试验
用Thermo NanoDrop 2000测定制备的rSLY1和rSLY2的总蛋白含量分别为6.2和7.1 mg/mL。参照Gottschalk等方法,测定提取的HA9801天然野生型SLY溶血活性单位含量为212,rSLY1为212,rSLY2 为 214。
2.3 固体培养的信号肽功能试验
在含有IPTG的卡那霉素氯霉素的8%绵羊血的琼脂平板37 ℃培养24 h后,发现Rsly1菌落周围出现2~4 mm溶血环,Rsly2菌落周围未见溶血环,证明重组溶血素在大肠杆菌中表达时,信号肽能够将其转运至细胞外并发生溶血现象。
2.4 液体培养的信号肽功能试验
分别对Rsly1和Rsly2的诱导和同步未诱导培养物的上清和菌体处理后,进行SDS-PAGE和免疫印迹试验,发现所有未诱导的上清和菌体中均没有与SLY单抗杂交的条带出现(图3-A和图3-B的1、5、3、7泳道);Rsly1和Rsly2诱导后的菌体样本均出现以56 kD为主的现梯形条带(图3-B的4、8泳道);Rsly1诱导培养物上清(图3-B的2泳道)与野生型SLY(图3-B的9泳道)的分子量一致,出现约56 kD的杂交条带;而Rsly2诱导培养物上清(图3-B的6泳道)未出现任何杂交条带。试验证明了在液体培养中,信号肽能够引导表达的重组溶血素蛋白跨膜转运到细胞外,而且Rsly1诱导培养物上清上清中的重组溶血素分子量与HA9801溶血素分子量一致,说明重组蛋白转运到细胞外后其N端的信号肽已被剪切掉;同时不带有信号肽的重组蛋白不能完成跨膜转运。
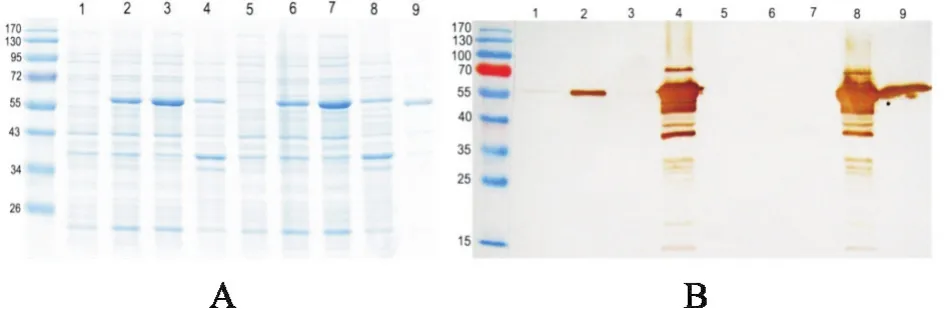
图3 Rsly1和Rsly2诱导菌体和上清中重组溶血素SDS-PAGE和Western-Blot
3 讨论
SS2已经成为危害养猪生产及人类健康的重要人兽共患病病原[6]。其耐药性日益增强,因而免疫预防依然是防制猪链球菌病的重要措施。SS2毒力基因以及保护性抗原的研究报道日渐增多,荚膜多糖(CPS)、溶血素、MRP和EF等是其重要毒力因子已经得到共识。
溶血素作为SS2分泌到细胞外的一种重要的外毒素,具有良好的免疫原性,相对与其他毒力因子属于分泌型,因此也成为构建弱毒株研究的主要缺失靶标。倪艳秀[7]、王雅等[8]、吴炜等[9]分别报道了SS2溶血素缺失株的构建,认为其可引起毒力下降和对不同动物致病性的下降;在诸多有关SS2溶血素的缺失株构建和基因表达等研究报道中,有关其信号肽的报道较少,大多数研究以其结构基因及功能为主。本试验构建了信号肽缺失的溶血素表达载体,证实了缺失信号肽的重组溶血素不能在大肠杆菌细胞中跨膜转运,从而为构建SS2溶血素缺失弱毒株提供一种新的基因缺失设计思路。
信号肽在引导外源蛋白分泌过程中具有重要作用,而且没有严格专一性,因而可利用信号序列分泌外源蛋白。目前研究采用的信号肽可分为自身信号肽和外源信号肽,常用的有大肠杆菌的外膜蛋白,如外膜蛋白OmpA 、OmpF、λ噬菌体受体LamB、热稳定肠毒素STⅡ等。研究表明,多种外源基因连接上信号肽后,在原核表达系统,如大肠杆菌、L型细菌、芽孢杆菌和乳酸杆菌中等,都得到了分泌表达[10]。外源蛋白在宿主菌如大肠杆菌中的表达形式多为细胞内包涵体不溶性表达,少数为细胞外分泌表达。利用信号肽来引导外源蛋白定位分泌到细胞特定区间,可提高可溶性,避免因包涵体复性带来的困难。在菌株、培养和发酵等逐渐成熟的条件下,构建高效的表达载体以提高外源蛋白质的表达量是降低工业化生产成本的关键。随着研究的深入,发现信号肽对蛋白质的定位有着非常重要的作用,使得信号肽的研究不仅具有重要的理论意义,而且也具有潜在的应用价值[11]。基于信号肽的功能对重组抗体分泌同样具有重要作用,通过添加一段合适的信号肽序列来引导重组抗体的分泌,不仅可以提高分泌效率和简化下游的纯化过程,而且对抗体的稳定性和活性都有积极作用,当然信号肽序列的选择和优化要根据不同的蛋白质及表达系统来进行[12]。
在本试验中,以溶血素为研究对象,所构建的重组表达载体能够在大肠杆菌中进行可溶性表达,重组蛋白非包涵体形式,溶血素信号肽能够介导跨膜转运,但是跨膜转运至大肠杆菌细胞外重组蛋白少于细胞内积累的重组蛋白,转运效率相对不高。从Western-Blot图谱上,绝大多数的重组蛋白在宿主细胞内积累,但是根据诱导后的菌体处理方法可见并未形成包涵体,因此可进一步优化表达条件,如调节IPTG的浓度、诱导温度、延长诱导时间等,在降低表达效率同时提高重组蛋白的跨膜转运。当然溶血素信号肽的N端多肽结构域、疏水活性以及信号肽转运后的剪切机制还有待于进一步的分析和研究;溶血素信号肽能否提高包涵体形式表达的外源蛋白可溶性、能否引导包涵体形式的外源蛋白进行跨膜转运、能否引导外源蛋白在真核宿主细胞内实现跨膜转运,也有待于进一步研究。
4 结论
本试验以溶血素基因为主要研究对象,通过基因克隆构建了带有和不带有信号肽序列的重组溶血素表达载体,将筛选的大肠杆菌阳性克隆,在固体和液体培养基中进行培养,以固体培养溶血现象的发生以及液体培养物的Western-Blot,证明缺失了信号肽的重组溶血素不能被跨膜转运至细胞外;同时带有溶血素信号肽的重组溶血素能够跨膜转运大肠杆菌细胞外。本试验为猪链球菌2型基因缺失弱毒疫苗的研究、细菌信号肽以及基因工程重组蛋白的可溶性表达进行了有益探索。
[1] 叶方寅. 信号肽假说的提出及证实——1999年诺贝尔生理学医学奖获得者Günter Blobel简介[J]. 国外医学(分子生物学分册),1999(6):377-379.
[2] 彭佳师,龚继明. 信号肽与蛋白质的分选转运[J]. 植物生理学报,2011(1):9-17.
[3] 陆承平. 兽医微生物学[M]. 5版. 北京:中国农业出版社,2013:555.
[4] JACOBS A A,LOEFFEN P L,VAN DEN BERG A J,et al. Identification,purification,and characterization of a thiol-activated hemolysin(suilysin)of Streptococcus suis [J]. Infection and immunity,1994,62(5):1742-1748.
[5] 陈国强. 猪链球菌2型江苏分离株溶血素的产生条件、提纯和特性分析[D]. 南京:南京农业大学,2000.
[6] SEGURA M. Streptococcus suis:an emerging human threat[J]. The journal of infectious diseases,2009,199(1):4-6.
[7] 倪艳秀. 猪链球菌2型江苏分离株溶血素基因缺失株的构建及特性分析[D]. 南京:南京农业大学,2012.
[8] 王雅,张安定,李冉,等. 猪链球菌2型溶血素基因缺失菌株的构建及生物学特性的研究[J]. 畜牧兽医学报,2010(7):854-858.
[9] 吴炜,张晓燕,唐宇龙,等. 猪链球菌2型溶血素基因缺失株构建及其生物学特性分析[J]. 动物医学进展,2012(5):22-26.
[10] 韦雪芳,王冬梅,刘思,等. 信号肽及其在蛋白质表达中的应用[J]. 生物技术通报,2006(6):38-42.
[11] 赵慧,郑文岭,马文丽. 信号肽对外源蛋白分泌效率的影响[J]. 生命的化学,2003(3):177-179.
[12] 陈龙冠,覃锦红,黄云娜,等. 信号肽优化对重组抗体分泌表达的影响及研究进展[J]. 中国生物工程杂志,2016(3):77-81.

