TBX1基因可能通过调控Tgfb2基因的表达参与心脏发育及先天性心脏病的发生
程菲, 姜红堃
先天性心脏病是最常见的出生缺陷,为婴幼儿非感染性死亡的首要原因,占主要先天发育畸形的1/3[1]。心脏的形成过程十分复杂,由遗传和环境因素共同作用引起,遗传率达55%~65%。胚胎心脏发育过程中的任何紊乱均可导致先天性心脏病的发生。人类TBX1基因定位于22q11.21,为染色体22q11.2微缺失中关键基因[2-3],参与心脏、耳、甲状腺,尤其是肺动脉干基部心肌的发育[2,4]。该基因主要表达于第二心区,且以剂量依赖效应的方式调节心脏流出道的发育,单倍剂量不足是引起22q11.2微缺失综合征患者心脏发育缺陷的重要原因[3]。转化生长因子β2基因(transforming growth factor beta 2,Tgfb2)是高度保守的TGFp超家族成员之一,具多种生物学作用。RXRA基因敲除小鼠中Tgfb2基因表达升高,心肌细胞凋亡增加,从而导致胚胎心脏流出道发育异常,推测Tgfb2基因可能是圆锥动脉干畸形的致病易感基因[5]。课题组前期研究发现,大鼠胚胎心肌细胞系TBX1基因干扰后,差异表达芯片预测结果提示Tgfb2基因表达增高。为进一步明确二者之间的关系,本研究拟将TBX1-siRNA转染至大鼠胚胎心肌细胞系H9C2中,检测干扰后Tgfb2基因mRNA的表达水平,以期探讨二者之间的关系及在心脏发育及先天性心脏病发病中的作用。
1 材料及方法
1.1 主要试剂及材料 大鼠胚胎心肌细胞H9C2购自中国科学院细胞库;胎牛血清和DMEM购自Gibco;Trizol试剂购自美国Invitrogen公司;反转录试剂盒购自大连保生物有限责任公司;SYBR Green PCR Master mix购自美国Applied Biosystems公司。
1.2 细胞培养与分组 大鼠胚胎心肌细胞系H9C2常规在DMEM高糖培养基(10%胎牛血清,100 U/mL青霉素,100 mg/L链霉素)中,37 ℃、5% CO2及饱和湿度的条件下培养。0.25%的胰酶(磷酸盐缓冲液配制)消化传代。根据处理因素不同,将细胞分为NC-siRNA组和TBX1-siRNA组。siRNA的设计与合成Negative Control、TBX1-siRNA由上海艾博思生物技术公司设计与合成。NC-siRNA:上游引物5′-UUC UCC GAA CGU GUC ACG UTT-3′,下游引物5′-ACG UGA CAC GUU CGG AGA ATT-3′;TBX1-siRNA:上游引物5′-CCG ACU AUA UGC UGC UCA UTT-3′,下游引物5′-AUG AGC AGC AUA UAG UCG GTT-3′。
1.3 转染细胞 常规培养的H9C2细胞,转染前一天调整细胞浓度为5×104个/mL,以每孔2 mL接种于6孔板中培养24 h,加入转染混合液前,用磷酸盐缓冲液清洗。采用Invitrogen公司的Lipofectamine 2000进行转染。首先在两个无菌Eppendorf管中,加入250 μL无抗生素、无血清RPMI 1640培养基,然后分别加入5 μL转染剂和5 μL siRNA,混匀,室温放置5 min,再将两管内容物混合,室温放置20 min。将混合物加至接种细胞的孔中,均匀分散。每孔加入1 500 μL无抗生素DMEM高糖培养基,混合均匀,继续培养6~8 h后,磷酸盐缓冲液清洗,换含血清、无抗生素的DMEM高糖培养基。转染24 h后换正常DMEM高糖培养基继续培养。转染48 h后检测干扰效率。
1.4 细胞总RNA提取 将细胞用磷酸盐缓冲液清洗2次,加入TRIzol试剂1 mL;室温静置5 min,用加样器吹打,收集在1.5 mL Eppendorf管内;加氯仿0.2 mL,涡旋振荡15 s,室温放置2~3 min;4 ℃、12 000 r/min离心15 min,将无色上清移入另一新管;加入异丙醇0.5 mL混匀,室温放置10 min,使RNA沉淀;4 ℃、12 000 r/min离心10 min弃上清;加75%乙醇(焦碳酸二乙酯水配制)1 mL,涡旋漂洗1次;4 ℃、7 500 r/min离心5 min,弃上清;空气干燥15 min,沉淀溶于0.01%焦碳酸二乙酯水,取少量用于浓度及纯度测定,其余分装后置-70 ℃保存;测定RNA浓度。
1.5 cDNA合成 用反转录试剂盒将总RNA反转录成cDNA第1链,反应总体积为20 μL,反应条件为:42 ℃ 60 min,99 ℃ 5 min,4 ℃ 5 min。cDNA置于-20 ℃冰箱保存备用。
1.6 实时定量PCR法(qRT-PCR)检测心肌组织TBX1及Tgfb2的mRNA表达
1.6.1 引物设计与合成 应用Primer 5.0软件设计引物,所用引物序列见表1。

表1 引物序列
引物均由上海生工生物工程公司合成。
1.6.2 qRT-PCR SYBR Green PCR Master mix(美国Applied Biosystems公司)染料法行TBX1基因及Tgfb2基因qRT-PCR扩增。反应体系如下:cDNA 0.5 μL;2×SYBR Green PCR Master mix 12.5 μL;引物(上下游引物的终浓度各为900 nmol/L) 1.0 μL;ddH2O 11.0 μL。反应条件:50 ℃ 2 min→95 ℃ 10 min→(92 ℃ 15 s→56.5 ℃ 1 min)×40个循环。以GAPDH为内参,校正每个样本的Ct,采用thermal cycler软件包计算△Ct值,以2-△△Ct计算基因表达。实时荧光定量PCR仪(7500型)由美国Applied Biosystems公司提供。
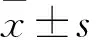
2 结果
2.1 qRT-PCR检测心肌细胞TBX1 mRNA的表达 H9C2细胞转染TBX1-siRNA 48 h后为(0.22±0.02),与NC-siRNA(0.99±0.02)比较,TBX1 mRNA表达显著下调,差异有统计学意义(t=46.000,P<0.05)。
2.2 qRT-PCR检测心肌细胞Tgfb2 mRNA的表达 H9C2细胞转染TBX1-siRNA 48 h后为(2.19±0.01),与NC-siRNA(1.00±0.01)比较,Tgfb2 mRNA表达明显上调,差异有统计学意义(t=-145.745,P<0.05)。
3 讨论
心脏是胚胎发育过程中最早形成的器官,其发育涉及多个基因的先后表达及细胞的分化、迁移、转化、增殖等过程。基因的精确调控是心脏正常形成的保障,其间的遗传或环境因素引起的任何紊乱均可导致先天性心脏病的发生。先天性心脏病可因心脏结构及血流动力学异常而导致身体运动耐力下降、脑发育延迟、肺动脉高压、心脏扩大、心功能衰竭、艾森曼格综合征、血栓栓塞、亚急性细菌性心内膜炎、心律失常,甚至死亡[2-4]。
TBX1基因是Tbox转录因子家族成员,前期研究发现TBX1基因主要表达在内胚层的咽弓组织,调控心脏神经嵴细胞的正常迁移,促进第二生心区细胞的增殖,对主、肺动脉隔发育有调节作用[6],这表明在心脏流出道发生过程中TBX1基因起到了关键作用。TBX1基因功能出现异常、表达过高、表达过低均可导致心脏圆锥动脉干畸形。已在先天性心脏病患儿有研究显示TBX1基因核苷酸发生变异、基因单拷贝出现重复、缺失都可引起心脏圆锥动脉干畸形[7-8]。目前人们对TBX1基因的研究限于TBX1基因编码区的核苷酸变异[9]或基因缺失、重复等方面[10],对TBX1基因表达调控异常的研究则很少。为进一步寻找TBX1基因的下游基因,课题组前期研究将TBX1-siRNA转染至大鼠胚胎心肌细胞系H9C2中,采用SurePrint G3 Rat GE 8*60KMicroarray检测分析技术筛选出表达上调基因755个,表达下调基因240个。根据分析结果,结合心脏发育相关基因文献,选取表达变化明显的Tgfb2基因,对其进行深入研究。设计此基因的引物,收集转染TBX1 siRNA后48 h的H9C2细胞系,进行RNA提取,qRT-PCR检测干扰后观察此基因的表达水平。本研究拟通过检测TBX1基因干扰后Tgfb2基因表达变化探讨TBX1基因参与心脏发育及先天性心脏病发生的可能途径。
Tgfb2主要表达在心脏的心内膜垫组织,可促进房室管和流出道的内皮细胞转化成心内膜垫细胞,抗Tgfb2抗体可以有效地抑制内皮细胞的转化[11]。有趣的是Tgfb2表达在整个胚胎心脏发育过程中均可检测到,而在成人心脏中几乎检测不到[12]。目前也有研究认为Tgfb2不仅参与心脏内皮间充质的转化,也是诱导神经嵴细胞由心脏流出道迁移的趋化因子[13-14]。该基因敲除小鼠可出现右室双流出道、房室管畸形等多种圆锥动脉干畸形[5]。研究表明,异位RA信号抑制Tgfb2信号通路在心肌早期表达,这是建立正常心室大动脉连接的关键形态之一[15]。
心脏从开始发育到最终成熟、成熟后的功能维护,是一个整体、动态、极其复杂且精细的调控过程。多种转录因子参与其关键过程,但具体机制如上游调控信号通路及下游靶基因则知之甚少。本研究采用实时定量PCR法检测TBX1干扰效率后Tgfb2基因mRNA的表达水平,结果发现Tgfb2基因表达增高,与差异表达芯片预测结果相符。推测TBX1基因可能通过调控Tgfb2基因的表达参与心脏发育及先天性心脏病发生。对TBX1基因及Tgfb2基因的深入研究有望为产前诊断及遗传干预提供理论依据及潜在的治疗靶标。下一步课题组将深入探讨TBX1基因调控Tgfb2基因表达的分子生物学途径。
[1] van der Linde D, Konings EE, Slager MA,et al.Birth prevalence of congenital heart disease worldwide: a systematic review and meta-analysis[J].J Am Coll Cardiol,2011,58(21):2241-2247.
[2] Sedghi M, Nouri N, Abdali H,et al.A case report of 22q11 deletion syndrome confirmed by array-CGH method[J].J Res Med Sci,2012,17(3):310-312.
[3] Maynard TM, Gopalakrishna D, Meechan DW,et al.22q11 Gene dosage establishes an adaptive range for sonic hedgehog and retinoic acid signaling during early development[J]. Hum Mol Genet,2013,22(2):300-312.
[4] Nevis K, Obregon P, Walsh C,et al.Tbx1 is required for second heart field proliferation in zebrafish[J].Dev Dyn,2013,242(5):550-559.
[5] Wang L, Li X, Huang W,et al.TGFβ signaling regulates the choice between pluripotent and neural fates during reprogramming of human urine derived cells[J].Sci Rep,2016,6:22484.
[6] Xu H, Morishima M, Wylie JN,et al. Tbx1 has a dual role in the morphogenesis of the cardiac outflow tract[J]. Development,2004,131(13):3217-3227.
[7] Xu YJ, Chen S, Zhang J,et al. Novel TBX1 loss-of-function mutation causes isolated conotruncal heart defects in Chinese patients without 22q11.2 deletion[J]. BMC Med Genet,2014,15:78.
[8] Xu YJ, Wang J, Xu R,et al. Detecting 22q11.2 deletion in Chinese children with conotruncal heart defects and single nucleotide polymorphisms in the haploid TBX1 locus[J]. BMC Med Genet,2011,12:169.
[9] Pane LS, Zhang Z, Ferrentino R,et al. Tbx1 is a negative modulator of Mef2c[J]. Hum Mol Genet,2012,21(11):2485-2496.
[10]Chen L, Fulcoli FG, Ferrentino R,et al. Transcriptional control in cardiac progenitors: Tbx1 interacts with the BAF chromatin remodeling complex and regulates Wnt5a[J]. PLoS Genet,2012,8(3):e1002571.
[11]Camenisch TD, Molin DG, Person A,et al.Temporal and distinct TGFbeta ligand requirements during mouse and avian endocardial cushion morphogenesis[J].Dev Biol,2002,248(1):170-181.
[12]Dickson MC, Slager HG, Duffie E,et al.RNA and protein localisations of TGF beta 2 in the early mouse embryo suggest an involvement in cardiac development[J].Development,1993,117(2):625-639.
[13]Sommer L.TGF beta signaling in neural crest cells in development and diseases[J].Toxicol Lett,2006,164(Suppl):S51.
[14]Chai Y, Ito Y, Han J.TGF-beta signaling and its functional significance in regulating the fate of cranial neural crest cells[J].Crit Rev Oral Biol Med,2003,14(2):78-88.
[15]Eldridge S, Nalesso G, Ismail H,et al.Agrin mediates chondrocyte homeostasis and requires both LRP4 and α-dystroglycan to enhance cartilage formation in vitro and in vivo[J]. Ann Rheum Dis,2016,75(6):1228-1235.

