芦苇克隆整合对石油污染湿地土壤微生物群落结构和生物量的影响
袁庆叶,安 菁,高俊琴,韩广轩,于飞海,*
1 北京林业大学自然保护区学院,北京 100083 2 中国科学院烟台海岸带研究所中国科学院海岸带环境过程与生态修复重点实验室,烟台 264003
滨海湿地处于海洋和陆地的交错地带,是重要的湿地类型,也是环境条件变化最剧烈、最易受到破坏的高脆弱生态系统[1-2]。近些年来由于大规模的海上和沿海石油开采活动,在石油的生产、加工和运输过程中泄漏问题频发,滨海湿地不断遭受石油污染的严重影响[3-4]。石油对植物生长具有毒害作用[5-6],同时也会对土壤微生物活动造成影响[4]。例如,石油污染能够抑制土壤中部分微生物的生长[7],但也会增加土壤中石油降解菌的丰富度[8]。同时,石油降解菌,包括细菌、真菌等多种类群,在自身代谢过程中能够利用土壤中的一系列电子受体将石油烃等污染物氧化降解[9],从而缓解石油对植物生长的毒害作用。
植物的生长状况可以对土壤微生物群落结构和生物量产生十分显著的影响[10-11]。植物生长可以影响其凋落物的产生和分解、根系的周转以及根系分泌物的产生等活动[12-13]。这些活动一方面可以为土壤微生物生长提供所必需的有机物[14],另一方面能够影响土壤碳和氮含量,而土壤碳和氮为微生物生长和繁殖提供所必需的碳源和能量,是影响微生物群落结构和生物量的重要因素[14-15]。植物凋落物的质量不同对土壤微生物的群落结构产生的影响也不相同[16]。一般来讲,归还到土壤中的凋落物质量高,则土壤中的细菌与真菌之比也相对较高[16-18]。同时,植物也能通过调节土壤条件和微气候等对微生物活动产生间接影响[19]。因此,植物生长也可能通过影响凋落物的质量以及改变植物对土壤条件和微气候的调节能力来影响土壤微生物群落的结构和生物量。
克隆植物在自然界广泛存在[20-21],是许多生态系统如草地、冻原和湿地的优势物种[19,22],并深刻地影响其结构和功能[22-23]。克隆植物的最显著特征之一在于,通过匍匐茎、根状茎或水平根等横生结构相连的无性繁殖个体(分株)之间可以进行水分、养分和光合产物等的传递,即通过克隆整合实现克隆内的资源共享[24-25]。国内外大量的研究表明,克隆整合可以显著提高分株对各种环境胁迫的耐受能力[25-28],从而可以极大地提高受胁迫分株甚至整个克隆的生长[25,29]。因此,克隆整合对受胁迫分株生长的促进作用将可能进一步影响分株周围土壤微生物群落的组成和生物量。然而,到目前为止,国内外有关克隆整合对土壤微生物影响的研究却十分缺乏[30]。对于遭受石油污染的、优势种为克隆植物的滨海湿地,由于克隆植物能够通过克隆整合将光合产物、水分或养分等传输给遭受石油污染胁迫的分株,并促进其生长[31],因此我们提出假说:克隆整合可以进一步影响遭受石油污染分株周围的土壤微生物的结构和生物量。
为检验这一假说,本研究在以根状茎型克隆植物——芦苇(Phragmitesaustralis(Cav.) Trin. ex Steudel)占绝对优势的黄河三角洲滨海湿地开展了一个为期两年的野外实验。芦苇对石油污染具有较强的耐受性[32],且芦苇能够影响土壤中石油类物质的向下迁移和降解转化[33],提高石油降解微生物的活性[34]。此外,芦苇相连分株之间存在非常强的克隆整合,这种克隆整合可以帮助芦苇从低盐度(海拔高)地区向高盐度(低海拔)地区扩展[35]。因此,芦苇湿地是检验本假说的一个非常合适的生态系统。
在黄河三角洲芦苇湿地设置样方,并在样方中每年添加0、5、10 mm的原油,用于模拟不同程度的石油污染;同时,通过切断芦苇的地下根状茎连接来阻断克隆整合,并以保持根状茎连接作为对照。通过这个实验,我们拟回答以下两个科学问题:(1)石油污染对芦苇湿地土壤微生物群落结构和生物量具有怎样的影响?(2)石油污染条件下芦苇的克隆整合是否对土壤微生物群落结构和生物量产生影响?
1 材料与方法
1.1 研究区概况
研究区位于山东省东营市黄河三角洲的中国科学院烟台海岸带研究所滨海湿地生态试验站(37°45′36.62″—37°46′15.56″N,118°58′38.74″—118°58′58.77″E),黄河三角洲国家级自然保护区大汶流管理站西侧。研究区海拔为0—4 m,距离黄河入海口的距离约为16 km。
研究地属于季节性湿地,优势物种为芦苇,同时伴生有少量的盐地碱蓬(Suaedasalsa(L.) Pall.)和鹅绒藤(CynanchumchinenseR. Br.)等。在7月中旬至8月中旬降雨量较大时会出现积水现象,积水深度通常小于5 cm[2]。该地区属于暖温带半湿润大陆季风气候,雨热同期[36]。年平均日照时数为2590—2830 h;年平均气温为11.7—12.8℃,历史最高温度41.9℃,历史最低温度-23.3℃。年平均降水量为551.6 mm,其中70%的降水量集中在5月到9月,降水量的季节和年际变化较大。年蒸发量为1962 mm,干旱指数达3.56。全年平均风速为2.98 m/s,无霜期长达206 d,≥10 ℃的积温约为4300℃[37]。
1.2 实验设计
在研究地选取6个芦苇生长相对均匀的小区作为区组。每个区组内随机布设6个直径为60 cm的圆形样方,每两个样方之间的距离至少为2 m以减少不同处理之间的潜在影响。实验采用双因素随机区组设计,包括2个水平的根状茎处理(圆形样方边缘的芦苇根状茎被切断或不切断)和3个水平的石油处理(每年向样方内添加0、5 mm或10 mm厚的原油),共6个处理。将6个实验处理随机安排到每个区组的6个样方中,每个区组相当于一个重复。
2014年6月28日,对于根状茎切断处理,我们将直径和高均为60 cm的塑料管垂直插入到地面以下30 cm以切断样方内外芦苇根状茎。我们的预处理表明,在研究地芦苇的绝大部分根状茎分布在地表以下15—20 cm处,因此该处理能够有效地切断样方内外绝大多数的芦苇根状茎连接,从而阻止了可能存在的样方内外芦苇分株之间的克隆整合作用。对于根状茎不切断(即连接)处理,将直径60 cm、高35 cm的塑料管垂直插入到地面以下仅5 cm深,从而保证样方内外芦苇根状茎的连接,即保证了克隆整合的存在。无论切断或不切断处理,塑料管上部的30 cm均保持在地面以上,以防止暴雨可能导致的添加石油的溢出。这种通过切断根状茎阻断克隆整合作用的方法被广泛应用于野外实验研究[27,38]。实验共持续了两个生长季,其中石油(采自胜利油田)分别于2014年6月29日和2015年5月13日各添加1次。
1.3 土壤微生物测定
在植物生长和土壤微生物活动最为旺盛时期(2014年8月23日和2015年8月25日),我们采用土钻法采集0—20 cm的土样进行分析测定。用土钻(3 cm内径)在每个样方内随机钻取3个土壤样品后将其均匀混合成一个土样,去除其中掺杂的植物根系、碎石等杂质并过2 mm筛。随后,将土壤样品放入便携式冰箱并迅速转移到实验室,分别于4℃和-80℃的低温条件下进行保存。
土壤微生物碳和氮的测定采用氯仿熏蒸浸提法(fumigation extraction method)。首先将4℃下保存的鲜土样在25℃的密封条件下黑暗培养7 d,然后称取两份鲜土(每份10 g)分别放入150 mL塑料瓶中,并将其中一份土样置入内部放有100 mL去乙醇氯仿的真空干燥器内;抽真空后保持氯仿沸腾3—5 min,然后将干燥器维持真空状态在25℃的黑暗条件下熏蒸24 h,另一份土壤不做氯仿熏蒸处理。之后将熏蒸和不熏蒸的土壤分别转移到200 mL的提取瓶中,加入50 mL 0.5 mol/L的K2SO4,震荡30 min后用0.45 μm滤纸过滤取滤液。浸提液中的碳氮用Multi 3100 N/C TOC analyzer (Analytik Jena,Germany)测定。由熏蒸和未熏蒸土样浸提的有机碳/氮的差值分别除以转换系数0.38和0.45,即得土样的微生物生物量碳(SMC)和氮(SMN)[12]。
土壤微生物群落特征的测定采用磷酸脂肪酸法(phospholipid fatty acids,PLFAs)[12,30]。PLFAs的提取分离和鉴定采用气相色谱(Agilent 6850,USA)和美国MIDI公司的Sherlock脂肪酸微生物鉴定系统相结合的标准方法。单个PLFA生物标记物的含量的计算公式如下:
其中,A和M分别为单个PLFA生物标记物的特征峰值和相对分子质量,B为对照物19:0的特征峰值,W为测试样品的干重。将PLFA谱图中对提取的PLFA总量的贡献值小于1%或者仅在一个样品中提取到的PLFA从最终结果中除去[39],共得到23个常见的PLFA种类。其中14:0,i15:0,a15:0,15:0,i16:0,16:1ω7,16:1ω9,16:0,i17:0,a17:0,17:0,cy17:0,18:1ω5,18:1ω7和cy19:0用于表征土壤中的细菌;18:2ω6,9,18:1ω9用于表征土壤中的真菌;i15:0,a15:0,i16:0,i17:0,a17:0用于表征土壤中的革兰氏阳性菌;16:1ω7,16:1ω9,18:1ω7用于表征土壤中的革兰氏阴性菌[12]。
1.4 数据分析
由于取样失误,导致无石油添加条件下根状茎连接和切断处理的数据各缺失1个。采用具有重复测量的双因素方差分析(Two-way ANOVAs with repeated measures)统计石油添加(0、5、10 mm)、克隆整合(有和无)和取样时间(2014年和2015年)对土壤微生物PLFA总量、各类群微生物PLFA含量、土壤微生物碳和氮含量的影响;其中,取样时间为重复测量变量。通过直线回归,分析土壤微生物PLFA总量与土壤微生物碳和氮之间的关系。在方差分析前对所有数据进行自然对数转换以满足方差齐性和正态性,在进行线性回归前对各微生物PLFA含量取自然对数。所有数据分析均采用SPSS 22.0软件(SPSS,Inc.,Chicago,Illinois,USA)进行。
2 结果
2.1 不同处理对土壤微生物PLFA含量的影响
土壤微生物PLFA总量、细菌和革兰氏阳性菌PLFA含量在2015年均显著高于2014年(表1,图1)。石油添加在2015年显著增加了土壤微生物PLFA总量,但在2014年其效应却并不显著(O × T 效应P< 0.01,表1,图1)。然而,无论在2014年还是2015年,石油添加对土壤微生物细菌、真菌、革兰氏阴性菌和革兰氏阳性菌的PLFA含量均没有显著的效应(表1,图1)。此外,无论在2014年还是2015年,芦苇的克隆整合(根状茎切断)及其与石油添加的交互作用对土壤微生物PLFA总量及各微生物类群PLFA含量均无显著效应(表1,图1)。

表1 石油添加、根状茎切断和取样时间对土壤微生物PLFA含量的影响Table 1 Effects of oil addition, rhizome severance and sampling time on soil microbial PLFAs
*P< 0.05,**P< 0.01, ***P< 0.001
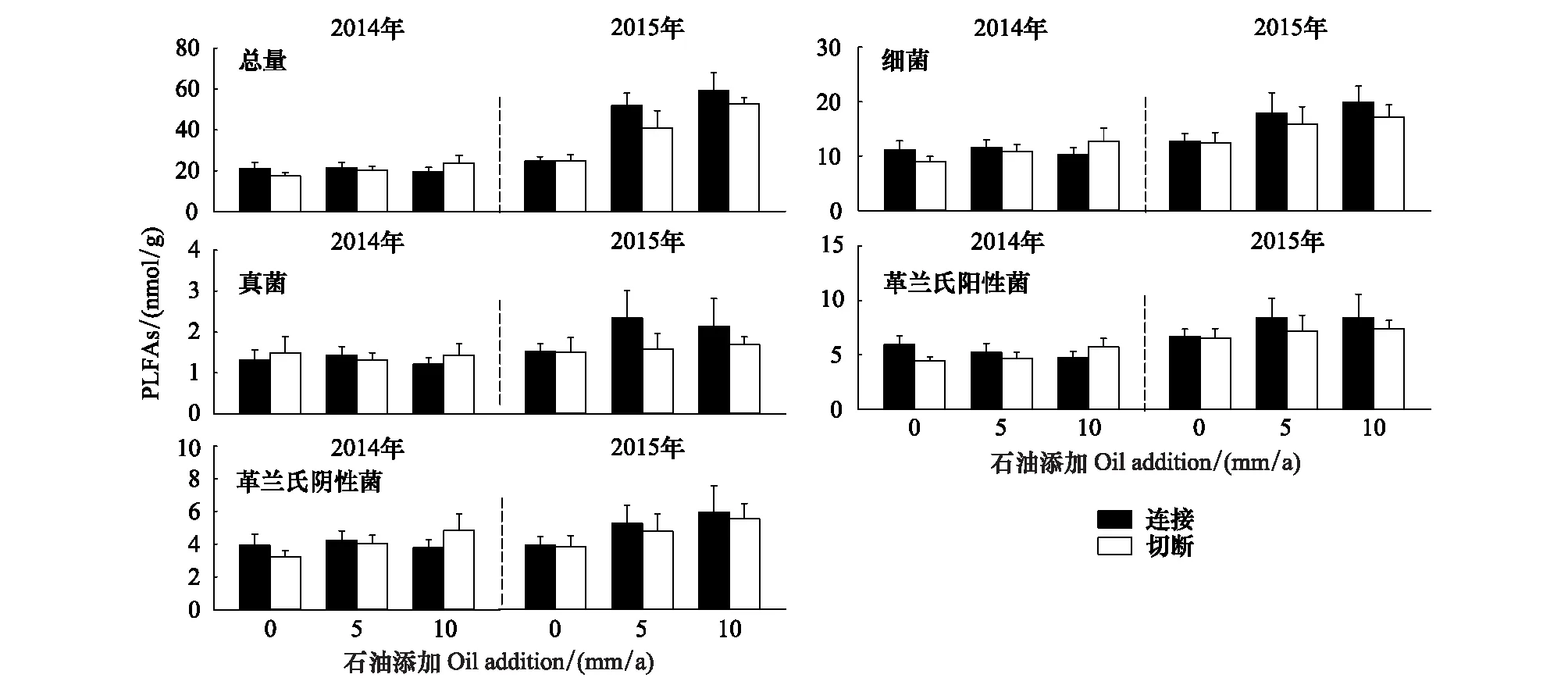
图1 石油添加、根状茎切断和取样时间对土壤PLFA总量及细菌、真菌、革兰氏阳性菌和革兰氏阴性菌PLFA含量的影响Fig.1 Effects of oil addition, rhizome severance and sampling time on total PLFAs and on PLFAs of soil bacteria, fungi, gram-positive bacteria and gram-negative bacteria柱体和竖线分别代表均值和标准误
2.2 不同处理对土壤微生物碳和氮含量的影响
石油添加对土壤微生物碳和氮含量的效应取决于取样时间(表2,O × T 效应P< 0.05):在2014年,石油添加,尤其是添加10 mm石油降低了土壤微生物碳和氮含量,而在2015年,添加5 mm和10 mm石油均显著增加了土壤微生物碳和氮含量(图2)。无论在2014年还是2015年,芦苇的克隆整合(根状茎切断)及其与石油添加的交互作用对土壤微生物碳和氮含量均无显著效应(表2,图2)。

表2 石油添加、根状茎切断和取样时间对土壤微生物碳和氮含量的影响Table 2 Effects of oil addition, rhizome severance and sampling time on soil microbial carbon (SMC) and nitrogen (SMN)
*P< 0.05,**P< 0.01及 ***P< 0.001

图2 石油添加、根状茎切断和取样时间对土壤微生物碳和氮含量的影响Fig.2 Effects of oil addition, rhizome severance and sampling time on soil microbial carbon (SMC) and nitrogen (SMNB)柱体和竖线分别代表均值和标准误
2.3 土壤微生物PLFA含量与微生物碳和氮含量的关系
无论在2014和2015年,土壤微生物PLFA总量与土壤微生物碳和氮含量之间均呈现显著的正相关关系(图3,P< 0.05)。在2014年,土壤细菌、真菌、革兰氏阳性菌和革兰氏阴性菌PLFA含量与土壤微生物碳和氮含量之间均呈现显著的正相关关系(图4),而在2015年这些关系均不显著(图5)。
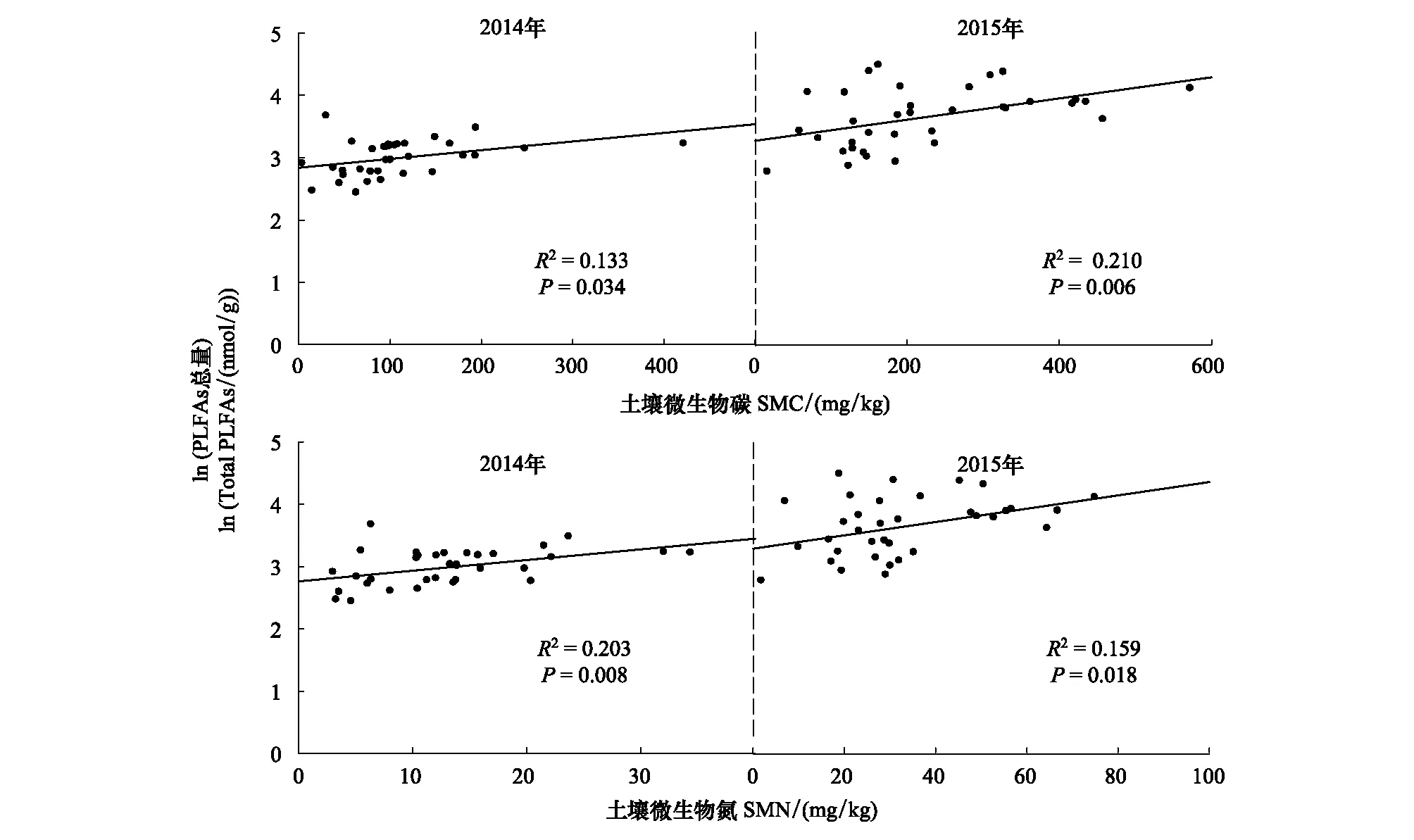
图3 在2014和2015年土壤微生物PLFAs总量与土壤微生物碳含量和氮含量之间的关系Fig.3 Relationships of total soil microbial PLFAs with soil microbial carbon (SMC) and nitrogen (SMN) in 2014 and 2015
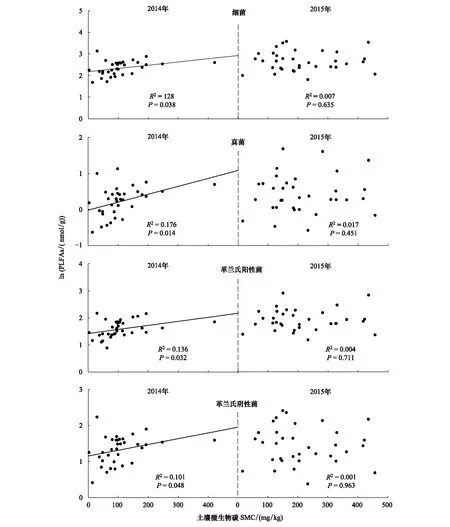
图4 在2014和2015年土壤微生物各类群PLFAs含量与土壤微生物碳含量之间的关系Fig.4 Relationships of soil microbial PLFAs of different groups with soil microbial carbon (SMC) in 2014 and 2015
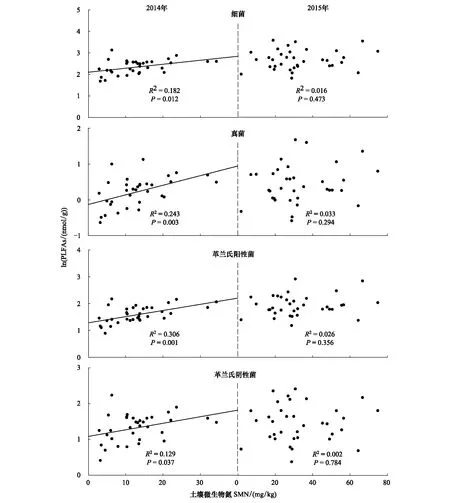
图5 在2014和2015年土壤微生物各类群PLFAs含量与土壤微生物氮含量之间的关系Fig.5 Relationships of soil microbial PLFAs of different groups with soil microbial nitrogen (SMN) in 2014 and 2015
3 讨论
许多环境因素可以影响土壤微生物群落的结构和生物量,包括土壤养分、水分、pH值、质地、温度、土地利用方式和石油污染[12,34,40]等。研究发现,石油污染可以影响芦苇湿地土壤微生物群落的生物量,并且与石油污染持续时间密切相关。首次添加石油后约两个月的时间(即2014年第一次取样),表现为石油污染抑制了群落中一部分微生物的生长和代谢,导致土壤微生物碳和氮含量的降低;而两年的石油添加(即2015年第二次取样)显著增加了土壤微生物碳和氮含量及土壤微生物PLFA总量,这与已有研究结果一致[41]。造成长期石油污染条件下土壤微生物量增加的原因可能有3个。首先,石油中的烃类物质增加了土壤碳的可利用性,为微生物的生长繁殖提供了所需的碳源。大量研究证据表明,微生物生物量受土壤有机碳含量影响较大,表现为土壤微生物生物量与土壤总碳呈正相关关系[15,42]。其次,石油的氧化过程也会导致土壤微生物尤其是石油降解菌生物量的增加[4]。最后,石油的添加增加了地面对太阳辐射的吸收从而使土壤温度升高,而土壤温度升高能够显著增强土壤微生物的生长代谢活动及生物量动态变化[43]。石油污染对湿地微生物生物量的影响对生态系统功能可能具有重要作用。例如,石油污染可能增强土壤微生物的呼吸作用,增加系统CO2气体的排放,而土壤微生物,尤其是石油降解菌的增多又会反过来加速对土壤中石油的降解[9]。
土壤微生物群落结构也受到环境因素的显著影响。一般来讲,在有机质有效性较高的土壤中,细菌占优势;反之,则真菌占优势[17,44]。研究发现,两年的石油添加显著增加了土壤中细菌的含量,但对真菌PLFA含量的影响不显著。由于石油富含有机质,两年的石油添加可能显著增加了土壤中的有机质含量,而土壤有机质的增加有利于土壤细菌的快速增长,提高其与真菌的竞争能力[18],具体表现在本实验中土壤细菌PLFA含量大约是真菌PLFA含量的9倍(图1)。此外,自然界中广泛分布着菌根真菌,其生长所需的能量来源为植物光合作用新形成的光合产物[40]。石油的毒害作用能够显著降低芦苇的光合作用速率[45],因而可能在一定程度上抑制了土壤中菌根真菌的增加。石油污染导致的土壤微生物群落细菌与真菌含量比值的变化对湿地生态系统功能也具有重要影响。石油添加限制了氧气从空气向土壤中的扩散,从而加重了土壤的厌氧条件[46],甲烷产生菌在厌氧环境中活动加强,促进土壤有机质分解产生甲烷[46-47]。因此,石油污染对土壤微生物的影响可能显著增加温室气体甲烷的排放。此外,石油污染条件下细菌含量的增长还可以增加土壤氮矿化[48]、硝化[49]以及硫还原[7]等土壤过程的速率,进而对土壤养分循环产生影响。
很多研究表明,克隆整合可以提高克隆植物对胁迫的耐受能力,提高遭受胁迫分株的生长[24,26,50],而植物的生长状况与其根际微生物群落的结构和生物量密切相关[10]。最近的研究还表明,通过克隆整合传输的水分和养分可以进一步通过水力重分配(hydraulic redistribution)被分株重新释放到其根际土壤中[51]。因此,可以推测,克隆整合对遭受胁迫分株生长的这种促进作用可能进一步影响其周围土壤微生物群落的结构和生物量。然而,我们发现,尽管克隆整合显著提高了遭受石油污染的芦苇分株的生长(未发表数据),却并不显著影响土壤微生物总量及各主要类群的含量。因此,本研究的结果并不支持之前提出的假说,表明克隆整合对分株生长的促进作用并不一定能够进一步影响土壤过程。然而,有研究发现,匍匐茎克隆植物活血丹(Glechomalongituba)相连分株之间的克隆整合显著提高了被遮阴分株根际土中的微生物各类群PLFA含量和PLFA总量、碳和氮可利用性及土壤氮矿化和硝化速率等,从而加速了土壤的养分循环[30]。此外,克隆整合通过改变土壤微生物群落结构和促进根际的氮同化过程进一步显著提高了异质性光照条件下活血丹的碳积累能力[52]。
本研究中克隆整合对土壤微生物群落结构和生物量无显著影响的可能原因有3个。第一,土壤碳和氮等养分条件为微生物生长和繁殖提供了所需的碳源和能量[12,15],但克隆整合可能没有显著改变石油污染胁迫下芦苇湿地的土壤全碳和全氮含量,因而对微生物群落结构和生物量无显著影响。第二,芦苇的根系十分庞大,在自然条件下其地下生物量可能与地上生物量大体相等[53],而石油污染对芦苇地下生物量的胁迫程度要显著低于地上部分[6]。因此,克隆整合虽然提高了遭受石油污染的芦苇地上部分的生长,但可能对其地下部分的活动和生物量并没有显著的影响,进而对其产生的可为微生物生长提供所必需有机物的根系周转产物和根系分泌物等也无显著效应。第三,本实验所取土样的绝大部分不是根际土壤(即受植物根系活动的影响,在物理、化学和生物性质上不同于原土体的那部分微域土区[54]),而是在样方内随机选取3个直径3 cm、深度0—20 cm的土柱混合而成,导致克隆整合的效应被削弱。
综上所述,石油污染可以显著影响土壤微生物群落结构和生物量,而芦苇克隆整合对土壤微生物群落的效应却并不显著。由于PLFA法对土壤微生物群落的分辨率过低,能够鉴定的PLFA种类也十分有限。例如,本实验中细菌和真菌PLFA含量之和仅占微生物PLFA总量的50%左右。因此,下一步考虑在对实验进行继续处理的基础上利用高通量测序的方法进一步完善克隆整合对石油污染条件下芦苇根际土壤微生物群落结构影响的研究,以期为滨海湿地石油污染生态系统功能的评价及土壤的生物修复技术提供科学依据。
[1] 徐东霞, 章光新. 人类活动对中国滨海湿地的影响及其保护对策. 湿地科学, 2007, 5(3): 282-288.
[2] Han G X, Yang L Q, Yu J B, Wang G M, Mao P L, Gao Y J. Environmental controls on net ecosystem CO2exchange over a reed (Phragmitesaustralis) wetland in the Yellow River Delta, China. Estuaries and Coasts, 2013, 36(2): 401-413.
[3] Lin Q X, Mendelssohn I A. Potential of restoration and phytoremediation withJuncusroemerianusfor diesel-contaminated coastal wetlands. Ecological Engineering, 2009, 35(1): 85-91.
[4] Mendelssohn I A, Anderson G L, Baltz D M, Caffey R H, Carman Ke R, Fleeger J W, Joye S B, Lin Q X, Maltby E, Overton E B, Rozas L P. Oil impacts on coastal wetlands: implications for the Mississippi River Delta ecosystem after theDeepwaterHorizonoil spill. Bioscience, 2012, 62(6): 562-574.
[5] Lin Q X, Mendelssohn I A. Impacts and recovery of theDeepwaterhorizonoil spill on vegetation structure and function of coastal salt marshes in the northern Gulf of Mexico. Environmental Science & Technology, 2012, 46(7): 3737-3743.
[6] Judy C R, Graham S A, Lin Q X, Hou A X, Mendelssohn I A. Impacts of Macondo oil fromDeepwaterHorizonspill on the growth response of the common reedPhragmitesaustralis: a mesocosm study. Marine Pollution Bulletin, 2014, 79(1-2): 69-76.
[7] Suárez-Suárez A, López-López A, Tovar-Sánchez A, Yarza P, Orfila A, Terrados J, Arnds J, Marqués S, Niemann H, Schmitt-Kopplin P, Amann R, Rosselló-Móra R. Response of sulfate-reducing bacteria to an artificial oil-spill in a coastal marine sediment. Environmental Microbiology, 2011, 13(6): 1488-1499.
[8] Abed R M M, Musat N, Musat F, Mussmann M. Structure of microbial communities and hydrocarbon-dependent sulfate reduction in the anoxic layer of a polluted microbial mat. Marine Pollution Bulletin, 2011, 62(3): 539-546.
[9] 焦海华, 崔丙健, 吴尚华, 白志辉, 黄占斌. 紫茉莉对石油污染盐碱土壤微生物群落与石油烃降解的影响. 环境科学, 2015, 36(9): 3471-3478.
[10] Dimkpa C O, Merten D, Svatoš A, Büchel G, Kothe E. Metal-induced oxidative stress impacting plant growth in contaminated soil is alleviated by microbial siderophores. Soil Biology and Biochemistry, 2009, 41(1): 154-162.
[11] Wardle D A. Controls of temporal variability of the soil microbial biomass: a global-scale synthesis. Soil Biology and Biochemistry, 1998, 30(13): 1627-1637.
[12] Zhou Y, Clark M, Su J Q, Xiao C W. Litter decomposition and soil microbial community composition in three Korean pine (Pinuskoraiensis) forests along an altitudinal gradient. Plant and Soil, 2015, 386(1-2): 171-183.
[13] Wang Q K, Wang S L. Soil organic matter under different forest types in Southern China. Geoderma. 2007, 142(3-4): 349-356.
[14] Wardle D A. A comparative assessment of factors which influence microbial biomass carbon and nitrogen levels in soil. Biological Reviews, 1992, 67(3): 321-358.
[15] Lipson D A, Schmidt S K, Monson R K. Links between microbial population dynamics and nitrogen availability in an alpine ecosystem. Ecology, 1999, 80(5): 1623-1631.
[16] Waldrop M P, Balser T C, Firestone M K. Linking microbial community composition to function in a tropical soil. Soil Biology and Biochemistry, 2000, 32(13): 1837-1846.
[17] Bray S R, Kitajima K, Mack M C. Temporal dynamics of microbial communities on decomposing leaf litter of 10 plant species in relation to decomposition rate. Soil Biology and Biochemistry, 2012, 49: 30-37.
[18] Marschner P, Umar S, Baumann K. The microbial community composition changes rapidly in the early stages of decomposition of wheat residue. Soil Biology and Biochemistry, 2011, 43(2): 445-451.
[19] Macdonald L M, Paterson E, Dawson L A, Mcdonald A J S. Short-term effects of defoliation on the soil microbial community associated with two contrastingLoliumperennecultivars. Soil Biology and Biochemistry, 2004, 36(3): 489-498.
[20] Song M H, Dong M. Clonal plants and plant species diversity in wetland ecosystems in China. Journal of Vegetation Science, 2002, 13(2): 237-244.
[21] Ye D, Hu Y K, Song M H, Pan X, Xie X F, Liu G F, Ye X H, Dong M. Clonality-climate relationships along latitudinal gradient across China: adaptation of clonality to environments. PLoS One, 2014, 9(4): e94009.
[22] Yu F H, Wang N, He W M, Dong M. Effects of clonal integration on species composition and biomass of sand dune communities. Journal of Arid Environments, 2010, 74(6): 632-637.
[23] Cornelissen J H C, Song Y B, Yu F H, Dong M. Plant traits and ecosystem effects of clonality: a new research agenda. Annals of Botany, 2014, 114(2): 369-376.
[24] He W M, Alpert P, Yu F H, Zhang L L, Dong M. Reciprocal and coincident patchiness of multiple resources differentially affect benefits of clonal integration in two perennial plants. Journal of Ecology, 2011, 99(5): 1202-1210.
[25] Song Y B, Yu F H, Keser L H, Dawson W, Fischer M, Dong M, van Kleunen M. United we stand, divided we fall: a meta-analysis of experiments on clonal integration and its relationship to invasiveness. Oecologia, 2013, 171(2): 317-327.
[26] Luo F L, Chen Y, Huang L, Wang A, Zhang M X, Yu F H. Shifting effects of physiological integration on performance of a clonal plant during submergence and de-submergence. Annals of Botany, 2014, 113(7): 1265-1274.
[27] Yu F H, Wang N, He W M, Chu Y, Dong M. Adaptation of rhizome connections in drylands: increasing tolerance of clones to wind erosion. Annals of Botany, 2008, 102(4): 571-577.
[28] Wang N,Yu F H,Li P X,He W M,Liu F H,Dong M. Clonal integration affects growth, photosynthetic efficiency and biomass allocation, but not the competitive ability, of the alien invasive Alternanthera philoxeroides. Annals of Botany,2008,101(5):671-678.
[29] 陈劲松, 刘鹏, 刘庆. 青藏高原东缘过路黄在资源交互斑块性生境中的克隆内资源共享. 生态学报, 2009, 29(7): 3532-3539.
[30] Lei N F, Li J, Ni S J, Chen J S. Effects of clonal integration on microbial community composition and processes in the rhizosphere of the stoloniferous herbGlechomalongituba(Nakai) Kuprian. PLoS One, 2014, 9(9): e108259.
[31] Ding W J, Liu J, Wu D Q, Wang Y, Chang C, Wang R Q. Salinity stress modulates habitat selection in the clonal plantAeluropussinensissubjected to crude oil deposition. The Journal of the Torrey Botanical Society, 2011, 138(3): 262-271.
[32] 于君宝, 阚兴艳, 王雪宏, 韩广轩, 管博, 谢文军, 林乾新. 黄河三角洲石油污染对湿地芦苇和碱蓬幼苗生长影响的模拟研究. 地理科学, 2012, 32(10): 1254-1261.
[33] 王蓓, 张旭, 李广贺, 钟毅. 芦苇根系对土壤中石油污染物纵向迁移转化的影响. 环境科学学报, 2007, 27(8): 1281-1287.
[34] 聂明. 芦苇及其根围微生物对石油污染响应的生态系统生态学研究[D]. 上海: 复旦大学, 2010.
[35] Amsberry L, Baker M A, Ewanchuk P J, Berness M D. Clonal integration and the expansion ofPhragmitesaustralis. Ecological Applications, 2000, 10(10): 1110-1118.
[36] Xu X G, Lin H P, Fu Z Y. Probe into the method of regional ecological risk assessment-a case study of wetland in the Yellow River Delta in China. Journal of Environmental Management, 2004, 70(3): 253-262.
[37] Xie T, Liu X H, Sun T. The effects of groundwater table and flood irrigation strategies on soil water and salt dynamics and reed water use in the Yellow River Delta, China. Ecological Modelling, 2011, 222(2): 241-252.
[38] Du J, Wang N, Alpert P, Yu M J, Yu F H, Dong M. Clonal integration increases performance of ramets of the fernDiplopterygiumglaucumin an evergreen forest in southeastern China. Flora, 2010, 205(6): 399-403.
[39] Zhong W H, Gu T, Wang W, Zhang B, Lin X G, Huang Q R, Shen W S. The effects of mineral fertilizer and organic manure on soil microbial community and diversity. Plant and Soil, 2010, 326(1-2): 511-522.
[40] Högberg M N, Högberg P, Myrold D D. Is microbial community composition in boreal forest soils determined by pH, C-to-N ratio, the trees, or all three? Oecologia, 2007, 150(4): 590-601.
[41] So C M, Young L Y. Anaerobic biodegradation of alkanes by enriched consortia under four different reducing conditions. Environmental Toxicology and Chemistry, 2001, 20(3): 473-478.
[42] Follett R F, Schimel D S. Effect of tillage practices on microbial biomass dynamics. Soil Science Society of America Journal, 1989, 53(4): 1091-1096.
[43] Schindlbacher A, Rodler A, Kuffner M, Kitzler B, Sessitsch A, Zechmeister-Boltenstern S. Experimental warming effects on the microbial community of a temperate mountain forest soil. Soil Biology and Biochemistry, 2011, 43(7): 1417-1425.
[44] Fierer N, Schimel J P, Holden P A. Variations in microbial community composition through two soil depth profiles. Soil Biology and Biochemistry, 2003, 35(1): 167-176.
[45] Dowty R A, Shaffer G P, Hester M W, Childers G W, Campo F M, Greene M C. Phytoremediation of small-scale oil spills in fresh marsh environments: a mesocosm simulation. Marine Environmental Research, 2001, 52(3): 195-211.
[46] Pezeshki S R, Hester M W, Lin Q, Nyman J A. The effects of oil spill and clean-up on dominant US Gulf coast marsh macrophytes: a review. Environmental Pollution, 2000, 108(2): 129-139.
[47] Aronson E L, Helliker B R. Methane flux in non-wetland soils in response to nitrogen addition: a meta-analysis. Ecology, 2010, 91(11): 3242-3251.
[48] Margesin R, Walder G, Schinner F. The impact of hydrocarbon remediation (diesel oil and polycyclic aromatic hydrocarbons) on enzyme activities and microbial properties of soil. Acta Biotechnologica, 2000, 20(3-4): 313-333.
[49] Deni J, Penninckx M J. Nitrification and autotrophic nitrifying bacteria in a hydrocarbon-polluted soil. Applied and Environmental Microbiology, 1999, 65(9): 4008-4013.
[50] Yu F H, Wang N, Alpert P, He W M, Dong M. Physiological integration in an introduced, invasive plant increases its spread into experimental communities and modifies their structure. American Journal of Botany, 2009, 96(11): 1983-1989.
[51] Ye X H, Zhang Y L, Liu Z L, Gao S Q, Song Y B, Liu F H, Dong M. Plant clonal integration mediates the horizontal redistribution of soil resources, benefiting neighboring plants. Frontiers in Plant Science, 2016, 7: 77.
[52] Chen J S, Li J, Zhang Y, Zong H, Lei N F. Clonal integration ameliorates the carbon accumulation capacity of a stoloniferous herb,Glechomalongituba, growing in heterogenous light conditions by facilitating nitrogen assimilation in the rhizosphere. Annals of Botany, 2015, 115(1): 127-136.
[53] Brix H, Sorrell B K, Lorenzen B. ArePhragmites-dominated wetlands a net source or net sink of greenhouse gases? Aquatic Botany, 2001, 69(2-4): 313-324.
[54] 周光益, 田大伦, 杨乐苏, 王旭, 邱治军, 刘敏. 酸雨胁迫下乡土植物根际土壤的化学行为. 林业科学, 2009, 45(11): 161-166.

