组蛋白去乙酰化酶6在口腔扁平苔藓中的表达及意义*
申 俊,刘 娟,张辉跃,杨淑娟, 杨晓虹
1.南方医科大学口腔医院·广东省口腔医院 特诊科 (广州 510280);2.南方医学大学口腔医院·广东省口腔医院 病理科 (广州 510280); 3.成都医学院 公共卫生学院(成都 610500)
口腔扁平苔藓(oral lichen planus ,OLP)是一种常见的口腔黏膜慢性炎症性疾病,其损害具有反复发作、迁延难愈的特点[1]。OLP的主要病理变化是固有层大量炎症细胞呈带状浸润及基底细胞层的液化变性,提示细胞介导的自身免疫对基底细胞的损伤。已有研究[2]认为,CD4+T淋巴细胞的异常活化是OLP的重要发病因素,CD4+T淋巴细胞可在各种抗原的刺激下,发生异常的活化增殖,向不同类型的细胞亚群分化,分泌各种细胞因子,以网络形式参与到OLP的发生发展中。而寻找在此过程中关键的调控因子一直是OLP研究领域的热点和难点。
组蛋白去乙酰化酶(histone deacetylase,HDACs)是一类与表观遗传相关的关键蛋白酶,而表观遗传在调节T细胞基因表达以及细胞分化、成熟、活化中方面起重要作用[3]。已经发现的HDACs家族共有4类,而与上述T细胞活化及分化功能密切相关的主要是以HDAC6为代表的HDACsⅡ类成员[4]。
目前,尚未见HDACs与OLP的相关报道,为了解HDACs在OLP发生发展中的可能作用,本研究拟初步检测HDAC6在OLP局部病损组织中的表达情况,并探讨其与OLP临床病理学的相关性,为后期的进一步研究提供理论依据。
1 资料与方法
1.1 临床资料
选择2015年6月至2016年10月首次就诊于南方医科大学口腔医院·广东省口腔医院特诊科,经临床及病理诊断为OLP的初诊患者。OLP的诊断标准参照第4版《口腔黏膜病学》[5]。排除标准:排除近3个月内使用过皮质类固醇、免疫抑制及抗生素者;排除局部银汞充填物及修复体者;排除全身系统性疾病患者。本研究最终纳入OLP患者24例,其中,男9例,女15例,年龄23~74岁,病程4个月至2年不等。收集同期口腔囊肿切除术、阻生齿拔除术相应的新鲜正常黏膜10 例为对照组, 其中,男4例,女6例,年龄20~65 岁。所有组织的取得均获得患者及家属同意。
1.2 方法
1.2.1 试验步骤 HDAC6鼠抗人单克隆抗体购自 Santa Cruz,免疫组织化学 SP 试剂盒和 DAB 显色剂购自北京中杉金桥生物技术有限公司。免疫组织化学染色步骤参照使用说明书进行操作。HDAC6一抗稀释浓度为 1∶50。以 PBS 代替一抗作为阴性对照。
1.2.2 结果评估判定方法 高倍显微镜(×400)下随机选取 5 个视野(每个视野观察细胞不少于 200 个),按阳性细胞所占百分比及着色深浅进行结果判定。根据切片中细胞着色深浅评分:无显色:0 分;浅黄色:1 分;棕黄色:2 分;棕褐色:3分。根据阳性细胞百分比计分:阳性细胞数≤10%为 0 分,10%~25%为1 分,26%~50%为2分,51%~100%为3 分。两类分数乘积在3分以下为阴性(-),2~3 分为弱阳性(+),4~5分为中度阳性(++),5分以上为强阳性(+++)。阳性表达率以表达弱阳性、中度阳性和强阳性的病例之和占总病例数的百分比表示。涂片由两名经验丰富的病理医师采用双盲法对染色结果进行判定。
1.3 统计学方法
采用SPSS 11.5 统计分析软件进行数据处理,定性资料采用例数(%)描述,HDAC6阳性表达的比较采用Wilcoxon-W秩和检验。检验水准α除特别说明外均设定为0.05。
2 结果
2.1 HDAC6在OLP病损区及正常口腔黏膜组织的表达
免疫组织化学结果显示,在OLP 病损组织和口腔正常黏膜组织全层均有 HDAC6的阳性表达,阳性率分别为100%(24/24)和70%(7/10)。24例OLP病损组织和10例正常黏膜组织中HDAC6 的表达比较,差异有统计学意义(P<0.05)。其中,HDAC6在OLP 组上皮层主要呈中度阳性表达,表达部位靠近基底侧,与正常组比较,差异有统计学意义(P<0.05);在 OLP 组固有层淋巴细胞浸润区呈强阳性表达,与正常组比较,差异有统计学意义(P<0.05)(表1和图1)。
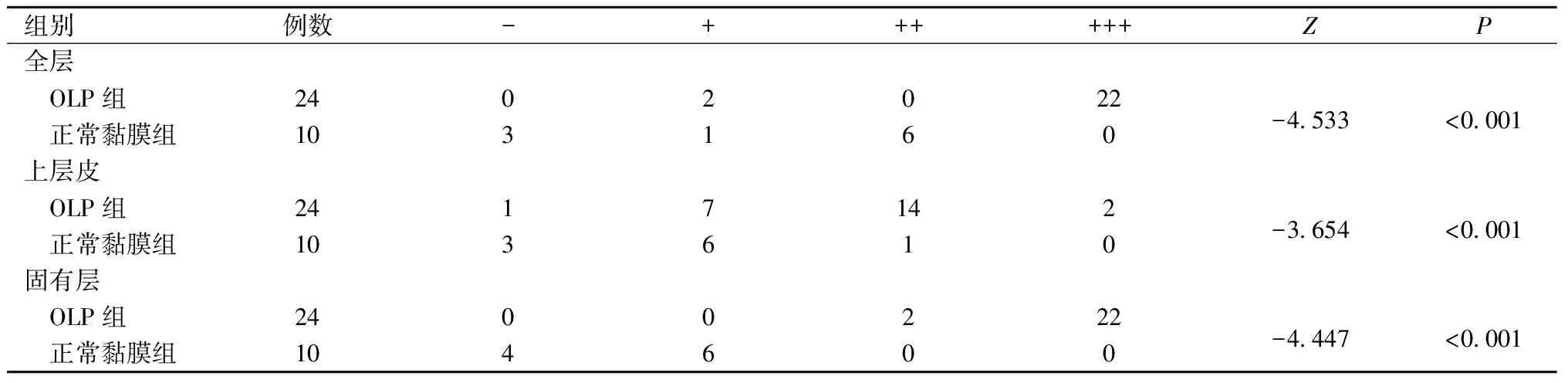
表1 HDAC6在OLP及正常口腔黏膜中的表达
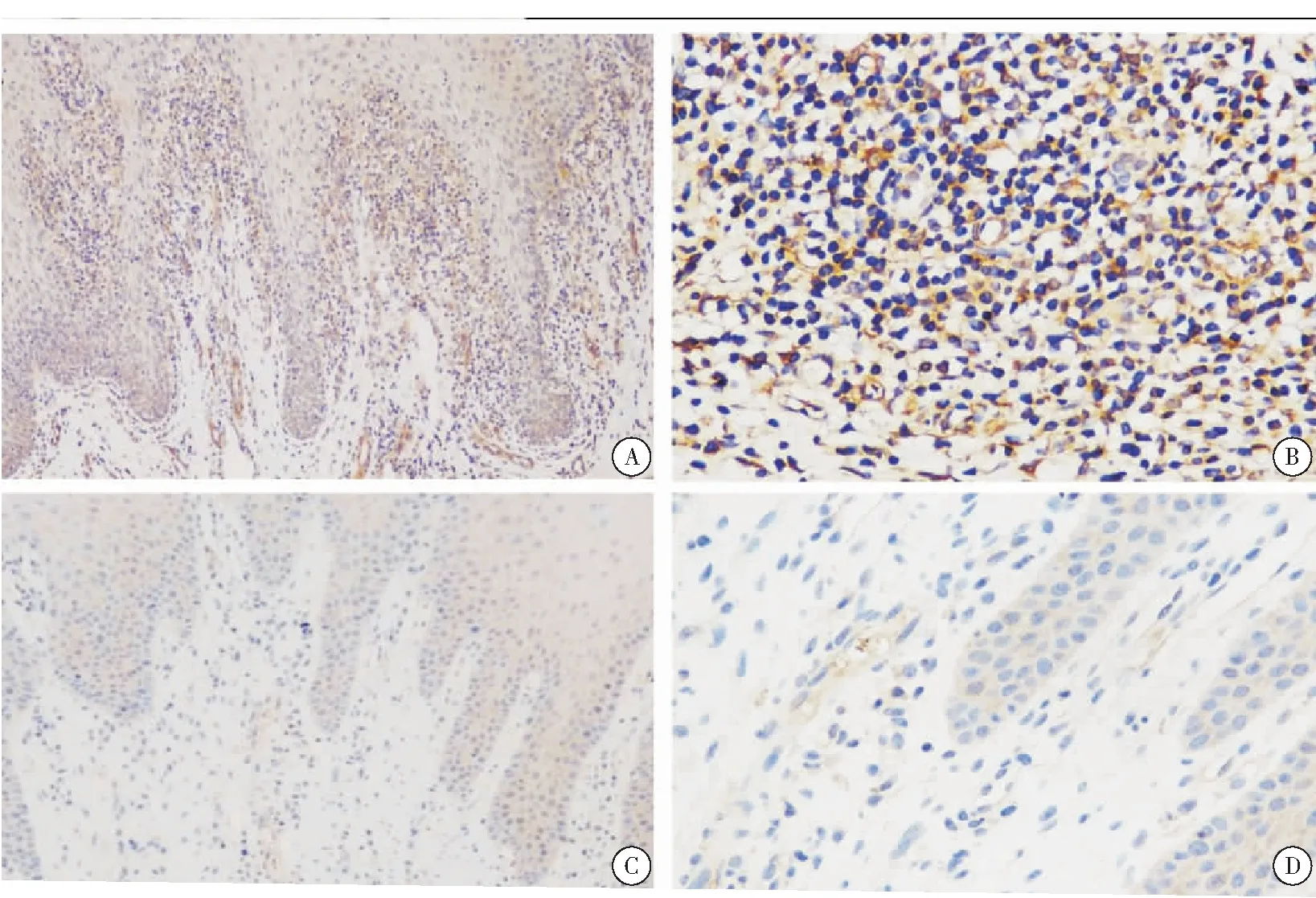
图1 HDAC6在OLP固有层淋巴细胞浸润区的阳性表达及对照
注:A:HDAC6在OLP固有层淋巴细胞浸润区的阳性表达(×100);B: HDAC6在OLP固有层淋巴细胞浸润区的阳性表达(×400); C: 对照正常口腔(×100);D: 对照正常口腔(×400)
2.2 HDAC6的表达与OLP临床病理学的相关性
将 HDAC6的表达水平和OLP患者临床资料进行相关性分析,HDAC6的表达在年龄、性别、病程及是否伴有异常增生方面差异无统计学意义(P>0.05),提示OLP的表达水平与患者的年龄、性别、病程及病损组织是否伴有异常增生均无关(表2)。
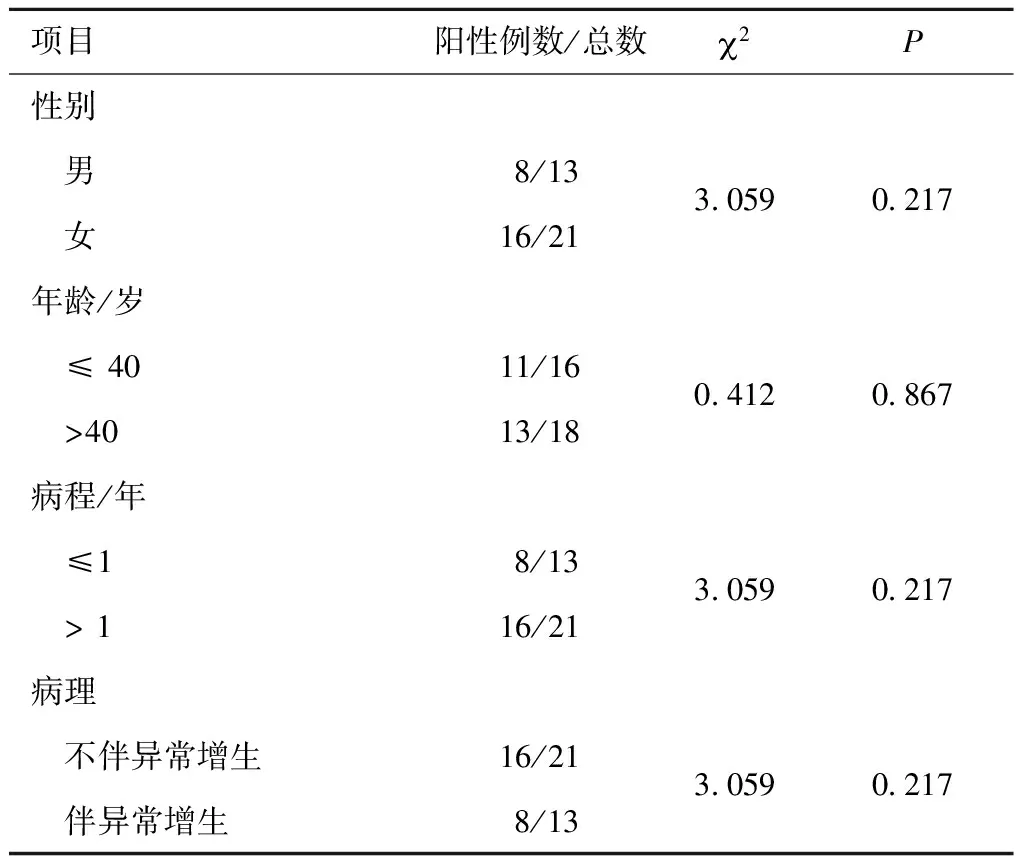
表2 HDAC6阳性表达中的OLP个体特征分布比较
3 讨论
HDACs是一类与表观遗传相关的关键蛋白酶,研究[4]发现,在染色质基因转录活跃区,其核心组蛋白的乙酰化活性增高,相反,在基因转录非活跃区,其乙酰化程度偏低,当HDACs过表达并被转录因子募集,就会导致特定基因的不正常抑制,从而与癌症、免疫相关性疾病、神经系统疾病等相关。以往对于HDACs的研究多集中在肿瘤领域,而新近研究[5-7]发现,HDACs对免疫系统中CD4+T淋巴细胞的免疫应答可能具有多环节的调控作用:1)在初始CD4+T淋巴细胞的早期活化阶段, HDACs能促进T淋巴细胞活化早期标志物的表达;2)在CD4+T淋巴细胞早期分裂阶段,HDACs能通过对细胞周期调节因子的调控来促进T淋巴细胞的分裂;3)在CD4+T淋巴细胞的分化阶段,HDACs能通过对关键转录因子乙酰化水平的调节来调控T淋巴细胞向不同亚群细胞分化的平衡。
HDAC6作为目前研究最为广泛的一类亚型, 虽尚未见其和OLP的研究报道,但已有学者[8-9]将HDAC6及抑制剂应用于移植物抗宿主疾病(graft-versus-host disease, GVHD)的研究中发现,HDAC6对GVHD动物模型中抗原呈递细胞激活供体T淋巴细胞的反应具有调控作用,HDAC6可调节CD4+T淋巴细胞分化过程中众多促炎细胞因子的释放;可调节GVHD中CD4+调节性T细胞的数量和功能;HDAC6抑制剂的使用在体外可明显降低GVHD的发生率及严重性。鉴于GVHD的口腔病损在临床及组织学上与OLP均具有相似性,上述研究进一步为本研究提出HDAC6可能调控OLP中CD4+T淋巴细胞活化的假设提供了重要的理论及试验依据。
本研究首次将HDAC6运用于OLP的相关研究中发现,HDAC6在OLP上皮层呈中度阳性表达,主要位于基底细胞层,而在OLP固有层淋巴细胞浸润区HDAC6呈强阳性表达。这提示HDAC6可能是OLP局部淋巴细胞活化分化及基底细胞液化变性的重要调控因子,其具体作用机制值得进行进一步研究。
[1]左雯鑫, 秦念红, 李晓宇, 等. 102例口腔扁平苔藓临床治疗回顾性分析[J]. 广东牙病防治, 2012, 20(7): 360-363.
[2]Bricker S L. Oral lichen planus: a review[J]. Semin Dermatol, 1994, 13(2): 87-90.
[3]Livyatan I, Meshorer E. The HDAC interaction network[J]. Mol Syst Biol, 2013, 9: 671.
[4]Falkenberg K J, Johnstone R W. Histone deacetylases and their inhibitors in cancer, neurological diseases and immune disorders[J]. Nat Rev Drug Discov, 2014, 13(9): 673-691.
[5]陈谦明. 口腔黏膜病学[M].第4版. 北京:人民卫生出版社, 2012:88.
[6]Moreira J M, Scheipers P, Sφrensen P. The histone deacetylase inhibitor Trichostatin A modulates CD4+T cell responses[J]. BMC Cancer, 2003, 3: 30.
[7]Yamaguchi T, Cubizolles F, Zhang Y,etal. Histone deacetylases 1 and 2 act in concert to promote the G1-to-S progression[J]. Genes Dev, 2010, 24(5): 455-469.
[8]Chang S, Collins P L, Aune T M. T-bet dependent removal of Sin3A-histone deacetylase complexes at the Ifng locus drives Th1 differentiation[J]. J Immunol, 2008, 181(12): 8372-8381.
[9]Reddy P. Targeting deacetylases to improve outcomes after allogeneic bone marrow transplantation[J]. Trans Am Clin Climatol Assoc, 2013, 124:152-162.

