不同剂型抗组胺药联合治疗常年性变应性鼻炎的短期疗效分析*
宋柠颖,吴 琦,刘 锋
四川大学华西医院 耳鼻咽喉头颈外科 (成都 610041)
变应性鼻炎(allergic rhinitis, AR)是体外环境变应原作用于特应性机体产生的异常免疫反应,由IgE介导的介质(主要是组胺)释放,多种细胞因子和免疫活性细胞参与其中。我国AR患病率高达11%[1],目前治疗AR的主要方法包括皮下注射免疫疗法和药物疗法。皮下注射免疫疗法即传统的经皮下注射途径向AR患者以递增剂量方式给予变应原疫苗,改善机体暴露于变应原时产生的过敏症状。但是部分患者注射变应原疫苗后会产生严重不良反应甚至死亡[2],人们开始关注更加安全的药物疗法。
AR是I型变态反应性疾病,组胺的释放与变态反应发生密切相关。因此,抗组胺药物尤其是第二代抗组胺药物,因其安全可靠、疗效确切,被广泛应用于AR的治疗中[3-4]。依巴斯汀和盐酸氮卓斯汀是第二代抗组胺药的不同剂型,依巴斯汀为口服剂,盐酸氮卓斯汀为鼻喷剂,二者均可抑制嗜碱性粒细胞和肥大细胞释放组胺,具有H1受体拮抗作用和广谱抗炎作用。目前可见依巴斯汀或盐酸氮卓斯汀鼻喷雾剂单独应用治疗AR的报道,但缺乏二者联合使用治疗AR的疗效分析。本研究通过对照试验,探讨短期联合使用依巴斯汀片和盐酸氮卓斯汀鼻喷雾剂在降低常年性AR鼻部症状评分和提高治疗有效率方面的疗效,现报道如下。
1 资料与方法
1.1 临床资料
选取2014年7月至2015年6月于四川大学华西医院就诊的130例常年性AR患者为研究对象,纳入标准:1)每年过敏性鼻炎的症状持续9个月以上,发作具有常年性,每次症状发作持续时间超过4周,每周症状发作超过4 d;2)患者以鼻痒、鼻塞、阵发性喷嚏和大量清水样涕为主诉;3)鼻内镜检查:鼻黏膜苍白、水肿,鼻腔内清涕,下鼻甲肿大;4)皮肤点刺试验至少1种变应原阳性。排除标准:1)妊娠或哺乳期妇女;2)合并鼻部肿瘤等其他鼻部疾病;3)合并心脑血管疾病、肝肾损害等慢性疾病者;4)精神障碍者。采用随机分组、双盲方法进行研究,按照随机数字表法将患者分为对照组和试验组,各65例。对照组:男35例,女30例;年龄19~50(34.28±9.44)岁;试验组:男37例,女28例;年龄17~56(37.94±8.69)岁。两组患者性别、年龄、治疗前鼻部症状评分比较,差异无统计学意义(P>0.05),具有可比性(表1)。
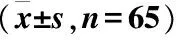
表1 对照组和试验组一般资料比较
1.2 诊疗方法
对照组口服依巴斯汀(10 mg, 每日1次)治疗;试验组口服依巴斯汀(10 mg, 每日1次)联合盐酸氮卓斯汀鼻喷雾剂治疗:右手喷左侧鼻孔,左手喷右侧鼻孔,每个鼻孔各2喷(140 g),早晚各1次,避免直接喷向鼻中隔。用药1个月后比较两组患者鼻部症状评分(total nasal symptom score, TNSS):包括鼻痒、鼻塞、打喷嚏、流清涕,每种症状得分为0~3分。两组患者在试验期间不合用其他H1受体拮抗剂、激素类药物。
1.3 疗效判定标准
根据海口《过敏性鼻炎疗效判定标准》[5]:1)根据症状进行分级:鼻痒:无鼻内发痒现象,记0分;偶有鼻内发痒现象,记1分;有可以忍受的蚁行感,记2分;无法忍受的蚁行感,记3分。鼻塞:无鼻塞,记0分;偶有鼻塞,记1分;时常有鼻塞,记2分;鼻子基本无气流通过,需要用口呼吸,记3分。喷嚏:一次连续打<3个喷嚏,记0分;一次连续打3~9个喷嚏,记1分;一次连续打10~14个喷嚏,记2分;一次连续打≥15个喷嚏,记3分。流鼻涕:每日无鼻涕,记0分;每日有少量鼻涕,记1分;每日有中等量鼻涕,记2分;每日有大量鼻涕,记3分。2)治疗前后症状和体征改善的百分率按照下列公式评定:(治疗前总分-治疗后总分)/治疗前总分×100%,≥51%为显效,50%~21%为有效,≤ 20%为无效。
1.4 统计学方法
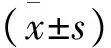
2 结果
2.1 两组患者TNSS比较
两组患者治疗结束时,AR症状均明显改善。治疗后对照组TNSS为(7.29±1.83)分,试验组TNSS为(5.81±1.79)分,两组患者TNSS与治疗前比较均下降,差异有统计学意义(P<0.05);治疗后两组TNSS比较,差异均有统计学意义(P<0.001)(表2)。
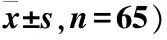
表2 两组患者治疗前后症状评分比较(分,
2.2 两组患者治疗有效率比较
用药1个月后,试验组治疗有效率为92.31%(60/65),对照组治疗有效率为60.00%(39/65),两组组间比较,差异有统计学意义(P<0.001)(表3)。
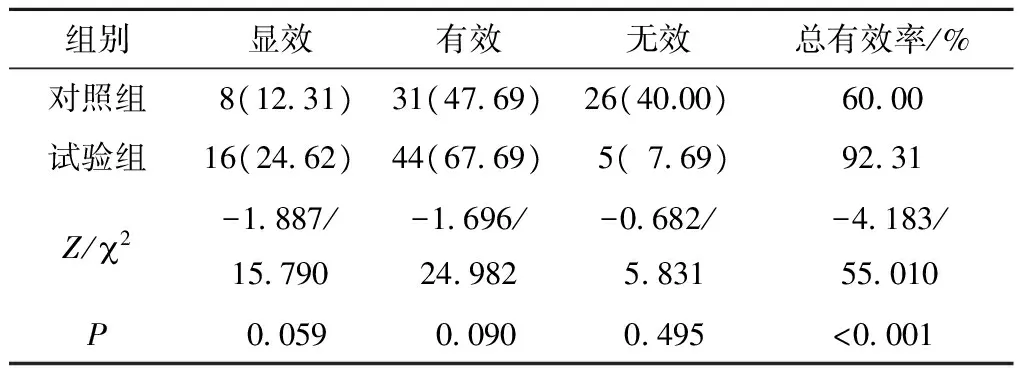
表3 两组患者治疗有效率比较[n(%),n=65]
2.3 两组患者鼻部症状评分比较
用药1个月后,对照组鼻塞评分较用药前降低,差异有统计学意义(P<0.05),其余鼻部症状评分与用药前比较,差异无统计学意义(P>0.05)(图1A);用药1个月后,试验组鼻塞、流鼻涕评分较用药前均降低,差异有统计学意义(P<0.05),其余鼻部症状评分与用药前比较,差异无统计学意义(P>0.05)(图1B)。试验组在降低AR患者流涕评分方面优于对照组。
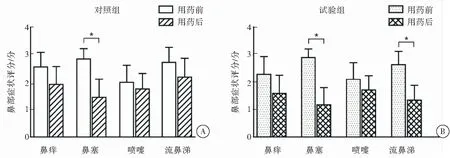
图1 两组患者鼻部症状评分比较注:*P<0.05
3 讨论
AR是由IgE介导的I型变态反应性疾病。过敏原作用于特应性机体后,刺激免疫系统产生大量IgE,诱发效应细胞脱颗粒,释放组胺、白三烯等多种介质,最终刺激鼻黏膜产生鼻炎症状[6]。AR多表现为鼻痒、鼻塞、打喷嚏和流清涕,若不及时治疗可导致中耳炎、慢性鼻窦炎等疾病,甚至影响患者的生活及生存质量[7]。因此,AR的有效治疗方式成为临床最重视的问题。
第二代抗组胺药是治疗AR的一线药物[8],其主要通过拮抗H1受体活性,抑制鼻高反应性病理过程中多种介质的释放[9]。第一代抗组胺药物与H1受体的结合是可逆的,且持续时间较短,虽然治疗变应性反应的临床效果较好,但会引起嗜睡等中枢神经系统的抑制作用,使其临床应用受限[10]。第二代抗组胺药物与第一代相比在治疗剂量下没有抑制中枢神经系统的作用,对变应性反应早期和晚期阶段的介质均可产生长久的抑制作用[10],依巴斯汀和盐酸氮卓斯汀是第二代抗组胺药的不同剂型,前者是口服剂,后者是鼻喷剂,二者均可用于治疗AR,但缺乏二者联合运用治疗AR的疗效分析。
本研究通过对照实验,发现对照组和试验组用药1个月后,TNSS均较用药前下降(P<0.05),且用药后试验组TNSS低于对照组,差异有统计学意义(P<0.05),表明试验组缓解AR患者的鼻部症状优于对照组。用药1个月后,试验组治疗有效率为92.31%,对照组治疗有效率为60.00%,两组比较,差异有统计学意义(P<0.001)。对照组鼻塞症状评分降低,而试验组鼻塞、流鼻涕症状评分降低,试验组减少AR患者流鼻涕症状的效果优于对照组。因随访时间有限,目前只收集并统计了用药1个月后的短期随访数据,待随访时间足够后,将陆续报道长期用药后试验组与对照组间的差异。
第二代抗组胺药具有抗组胺和抗炎的双重作用[11-14]:1)通过结合H1受体拮抗组胺;降低组胺引起的鼻黏膜水肿、喷嚏;抑制嗜碱粒细胞和肥大细胞释放组胺。2)通过抑制超氧化自由基生成,抑制肿瘤坏死因子、白介素等细胞因子的合成;抑制钙离子流入细胞内,降低嗜酸粒细胞趋化素水平,抑制鼻部和支气管的炎性反应。第二代抗组胺药不但能快速、安全治疗成人AR还能有效治疗儿童AR。Oliveira等[15]研究发现,使用盐酸氮卓斯汀鼻喷雾剂1周后,AR患儿打喷嚏和鼻痒症状明显改善。
综上所述,联合使用依巴斯汀和盐酸氮卓斯汀鼻喷雾剂在减轻AR鼻部症状和提高治疗有效率方面均优于对照组,能安全、快速治疗AR。
[1]Zhang L, Han D, Huang D,etal. Prevalence of self-reported allergic rhinitis in eleven major cities in china[J]. Int Arch Allergy Immunol, 2009, 149(1): 47-57.
[2]Kartal O, Gulec M, Caliskaner Z,etal. Safety of subcutaneous immunotherapy with inhalant allergen extracts: a single-center 30-year experience from Turkey[J]. Immunopharmacol Immunotoxicol, 2015, 37(3): 280-286.
[3]Berger W E, Meltzer E O. Intranasal spray medications for maintenance therapy of allergic rhinitis[J]. Am J Rhinol Allergy, 2015, 29(4): 273-282.
[4]Castillo M, Scott N W, Mustafa M Z,etal. Topical antihistamines and mast cell stabilisers for treatingseasonal and perennial allergic conjunctivitis[J]. Cochrane Database Syst Rev,2015(6):CD009566.
[5]中华医学会耳鼻咽喉学分会. 变应性鼻炎诊断标准及疗效判定标准(1997年修订, 海口)[J]. 中华耳鼻咽喉杂志, 1998, 33(3): 134-135.
[6]Ostrom N K. The history and progression of treatments for allergic rhinitis[J]. Allergy Asthma Proc, 2014, 35(Suppl 1): S3-S10.
[7]Bousquet P J, Devillier P, Tadmouri A,etal. Clinical relevance of cluster analysis in phenotyping allergic rhinitis in a real-life study[J]. Int Arch Allergy Immunol, 2015, 166(3): 231-240.
[8]Braido F, Sclifò F, Ferrando M,etal. New therapies for allergic rhinitis[J]. Curr Allergy Asthma Rep, 2014, 14(4): 422.
[9]Gawlik R, Jawor B, Rogala B,etal. Effect of intranasal azelastine on substance P release in perennial nonallergic rhinitis patients[J]. Am J Rhinol Allergy, 2013, 27(6): 514-516.
[10] Hishinuma S, Sugawara K, Uesawa Y,etal. Differential thermodynamic driving force of first-and second-generation antihistamines to determine their binding affinity for human H1 receptors[J]. Biochem Pharmacol, 2014, 91(2): 231-241.
[11] Lieberman P L, Settipane R A. Azelastine nasal spray: a review of pharmacology and clinical efficacy in allergic and nonallergic rhinitis[J]. Allergy Asthma Proc, 2003, 24(2): 95-105.
[12] Ohsawa Y, Hirasawa N. The antagonism of histamine H1 and H4 receptors ameliorates chronic allergic dermatitis via anti-pruritic and anti-inflammatory effects in NC/Nga mice[J]. Allergy, 2012, 67(8): 1014-1022.
[13] Küsters S, Schuligoi R, Hüttenbrink K B,etal. Effects of antihistamines on leukotriene and cytokine release from dispersed nasal polyp cells[J]. Arzneimittelforschung, 2002, 52(2): 97-102.
[14] Du D, Targett D, Stolberg E,etal. A clinical pharmacokinetic study comparing two azelastine hydrochloride nasal formulations in a single-dose design[J]. Eur J Drug Metab Pharmacokinet, 2014, 39(1): 69-75.
[15] Oliveira C A, Braga C R, Solé D,etal. Intranasal azelastine in the treatment of perennial allergic rhinitis in children[J]. J Pediatr (Rio J), 1996, 72(6): 394-399.

