沉默转导重排基因对抑制乳腺癌细胞增殖和迁移的影响*
崔军威,杨 满,郝 璐,程 苒,于志强,韦 伟
北京大学深圳医院(深圳 518036)
乳腺癌是一种常见的恶性肿瘤,严重威胁女性身心健康,其发病率是我国女性恶性肿瘤的首位,且还在以每年2%的速度递增[1]。随着对乳腺癌分子病理机制和生物学特性研究的深入,对于乳腺癌的治疗已从传统的手术、化疗、放疗等方式深入到分子靶向治疗。许多原癌基因突变与疾病发生、发展的密切相关。近年来,Boulay等[2]发现转导重排基因(rearranged during transfection,RET)蛋白在ER阳性的乳腺癌中过表达,并对乳腺癌的发生、发展起到重要作用。RET蛋白在乳腺癌细胞中有重要功能:雌激素导致RET蛋白的过表达,RET蛋白增强雌激素驱动的生长作用,此外,RET能够增强RET通路-雌激素受体通路之间的相互作用。磷脂酰肌醇-3-羟激酶(PI3K)/丝氨酸/苏氨酸激酶(AKT)/雷帕霉素靶蛋白(mTOR)通路中,PI3K/AKT/mTOR上游成员,如雌激素受体ERα等,在乳腺瘤生成中起重要作用,PI3K/AKT/mTOR信号转导通路与乳腺癌发生密切相关,使之成为乳腺癌新的治疗靶点和研究热点。本课题采用荧光定量方法,检测60例乳腺癌组织及癌旁组织中RET蛋白的表达,探讨其与乳腺癌关系。采用RET siRNA分别转染乳腺癌细胞MCF-7及内分泌耐药株MCF-7/Aro,检测沉默RET对细胞增殖、侵袭的影响,同时检测RET基因及PI3K/AKT/mTOR 通路等表达情况,以探讨RET基因在乳腺癌细胞中的作用机制,阐明RET在乳腺癌发生、发展中的作用,以及对 PI3K/AKT/mTOR等信号途径的作用,为研究乳腺癌治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试剂 胎牛血清、1640培养基(美国Gibco公司);Lipofectamine 2000、Trizol(美国Invitrogen公司);逆转录试剂盒、RT-PCR试剂盒(日本TAKARA公司);RET-siRNA-BC(正义链:5'-ACGUUGAUGCCACUGAAUGCC-3';反义链:5'-CAUUCAGUGGCAUCAACGUCC-3')、RET-siRNA- NC(正义链5'-ACCCGAUACUAAUGGGGU UCC-3';反义链5'-GGAACCCCATTAGTAT CGGGT-3')由广州锐博合成;Annexinv-FITC/PI凋亡试剂盒和周期检测试剂盒(南京凯基);总蛋白提取试剂盒(碧云天);一抗PI3K、 AKT1、mTOR(美国Abcam公司);一抗RAS、重组人丝裂原活化激酶(MEK)1、MEK2和RET(美国SantaCruz公司);羊抗兔IgG抗体(武汉博士德)。
1.1.2 实验细胞与组织来源 乳腺癌细胞MCF-7及内分泌耐药细胞株MCF-7/Aro由广州优迪生物科技股份有限公司提供。60例乳腺癌组织及20例癌旁组织来源于2015年6月至2016年6月在北京大学深圳医院确诊的乳腺癌女性患者,患者均为接受以手术为主的综合治疗,有完整的临床及病理资料。本研究通过本医院伦理委员会批准,所有患者均签署知情同意书。
1.1.3 主要仪器设备 实时荧光定量PCR仪、酶标仪、电泳仪、转膜仪均购自美国Bio-Rad公司,倒置荧光显微镜购自明美光电技术公司,流式细胞仪guava easycyte购自美国Millipore公司。
1.2 方法
1.2.1 RT-qPCR检测组织中RET相对表达量 60例乳腺癌组织及20例癌旁组织经研磨后,Trizol试剂盒提取总RNA,逆转录为cDNA,按照试剂盒SYBR Green法步骤进行扩增,RET引物序列:上游:5'-TGTCCCCTCTG CACTATCCTT-3',下游:5'-GGTTCAGAGCAGACTTTGGTT-3'。反应条件为:95 ℃ 30 s,95 ℃ 3 s, 60 ℃ 30 s,共扩增40个循环,每个样本设3个复孔。
1.2.2 细胞培养及转染 乳腺癌细胞MCF-7及内分泌耐药细胞株MCF-7/Aro,1640培养基常规传代培养。于转染前1 d,分别接种于6孔板中,细胞密度为3×105个/孔,转染前汇合成单层细胞,密度大约在80%。实验分为3组,阴性对照组(NC)、空白组(BC)和RET干扰片段转染组(RET-siRNA),在Lipofectamine 2000介导下分别转染,转染48 h后,荧光显微镜拍照检测转染效率,并用Western-blot和RT-PCR鉴定转染效果。
1.2.3 MTT法检测细胞增殖 取已稳定转染的MCF-7和MCF-7/Aro细胞,调整细胞密度为3×105个/mL,接种于96孔板中,100 μL/孔,分别培养0、24、48、72 h。每孔加入20 μL浓度为5 mg/mL的MTT溶液,继续培养4 h后,弃孔内培养液;每孔加入150 μL DMSO,震荡使结晶物充分溶解。在酶标仪测量各孔在490 nm处的吸光度OD值,每个样本重复3次。
1.2.4 Transwell 取已稳定转染的MCF-7和MCF-7/Aro细胞,接种于 Transwell 小室上室,密度为1×105个/孔,上室加入1 mL无血清1640培养基,下室加入1 mL含10%胎牛血清的1640培养基,置于37 ℃、5%CO2培养箱中培养24 h。吸掉培养基,PBS洗1次,4%多聚甲醛固定30 min,PBS洗3次,0.5%结晶紫染色10 min,轻轻刮掉上室内细胞,用PBS洗2次。显微镜下随机选取10个视野,观察并计数细胞个数。
1.2.5 PI3K/AKT/mTOR通路相关基因相对表达量检测 收集各组细胞,按照试剂盒说明书操作进行RNA提取和逆转录。以GADPH作为内对照,荧光定量PCR检测各组细胞mRNA水平。引物序列如下所示(表1)。

表1 Real-time PCR引物序列
1.2.6 Western-blot检测PI3K/AKT/mTOR等相关通路蛋白的表达 配置12% SDS-PAGE 分离胶,5%浓缩胶。样品1∶1与5×上样缓冲液混匀,95 ℃变性8 min上样。75 V浓缩胶,120 V分离胶,电泳2~3 h。恒流200 mA,转膜30 min。将膜置于预先配好的封闭液(5%脱脂奶粉)中,37 ℃摇床温育1 h。一抗稀释液将抗体稀释至工作浓度,37 ℃摇床温育1 h。Blot清洗液清洗3次后,稀释HRP标记的二抗至工作浓度,37 ℃摇床温育1 h。Blot清洗液清洗3次后,ECL 发光液A液和B液等体积混合后与膜上蛋白充分接触5 min后,弃残液。将膜转入暗匣中,进暗室曝光显影。用全自动凝胶成像系统进行灰度扫描并计算各组相对灰度值。
1.3 统计学方法
2 结果
2.1 乳腺癌组织及癌旁组织中RET表达情况
RT-PCR结果显示,乳腺癌组织中RET mRNA的相对表达量高于癌旁组织(2.70±1.37 vs. 1.29±0.51),差异有统计学意义(t=4.5431,P<0.05)(图1)。
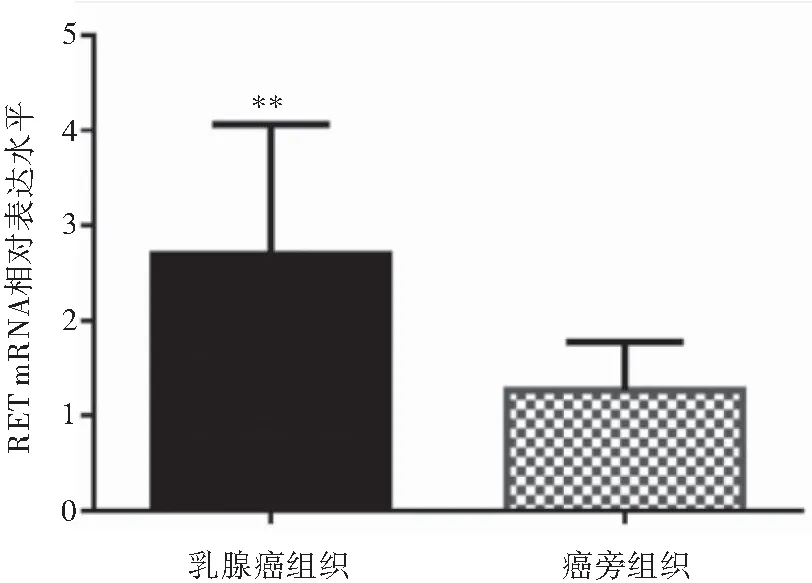
图1 乳腺癌组织及癌旁组织中RET mRNA表达情况
注:与癌旁组织比较,**P<0.05
2.2 RET表达量鉴定
RET-siRNA转染MCF-7和MCF-7/Aro细胞48 h和72 h后,分别进行RT-PCR和Western-blot检测RET表达情况,同时镜下观察转染效率。MCF-7转染效率为62%,MCF-7/Aro转染效率为65%,与BC组和NC组比较,转染RET-siRNA可明显降低RET的表达(F=13.59,P=0.003),表明RET-siRNA干扰效率高,可用于后续实验(图2)。
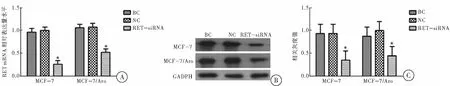
图2 RET-siRNA转染效率鉴定
注:A:转染后48 h,MCF-7及MCF-7/Aro 中RET mRNA相对表达量;B: 转染后72 h,MCF-7及MCF-7/Aro 中RET 蛋白相对表达量(Western-blot);C:转染后72 h,MCF-7及MCF-7/Aro中RET蛋白相对表达量(相关灰度值分析);与NC组和BC组比较,*P<0.05
2.3 沉默RET对MCF-7和MCF-7/Aro细胞迁移能力的抑制作用
Transwell检测沉默RET对乳腺癌细胞迁移的抑制作用结果表明,MCF-7和MCF-7/Aro细胞株经RET-siRNA作用24 h后,RET-siRNA组穿膜细胞数较BC组和NC组明显降低,差异有统计学意义(P<0.05),提示沉默RET可明显抑制MCF-7和MCF-7/Aro细胞的迁移能力(图3)
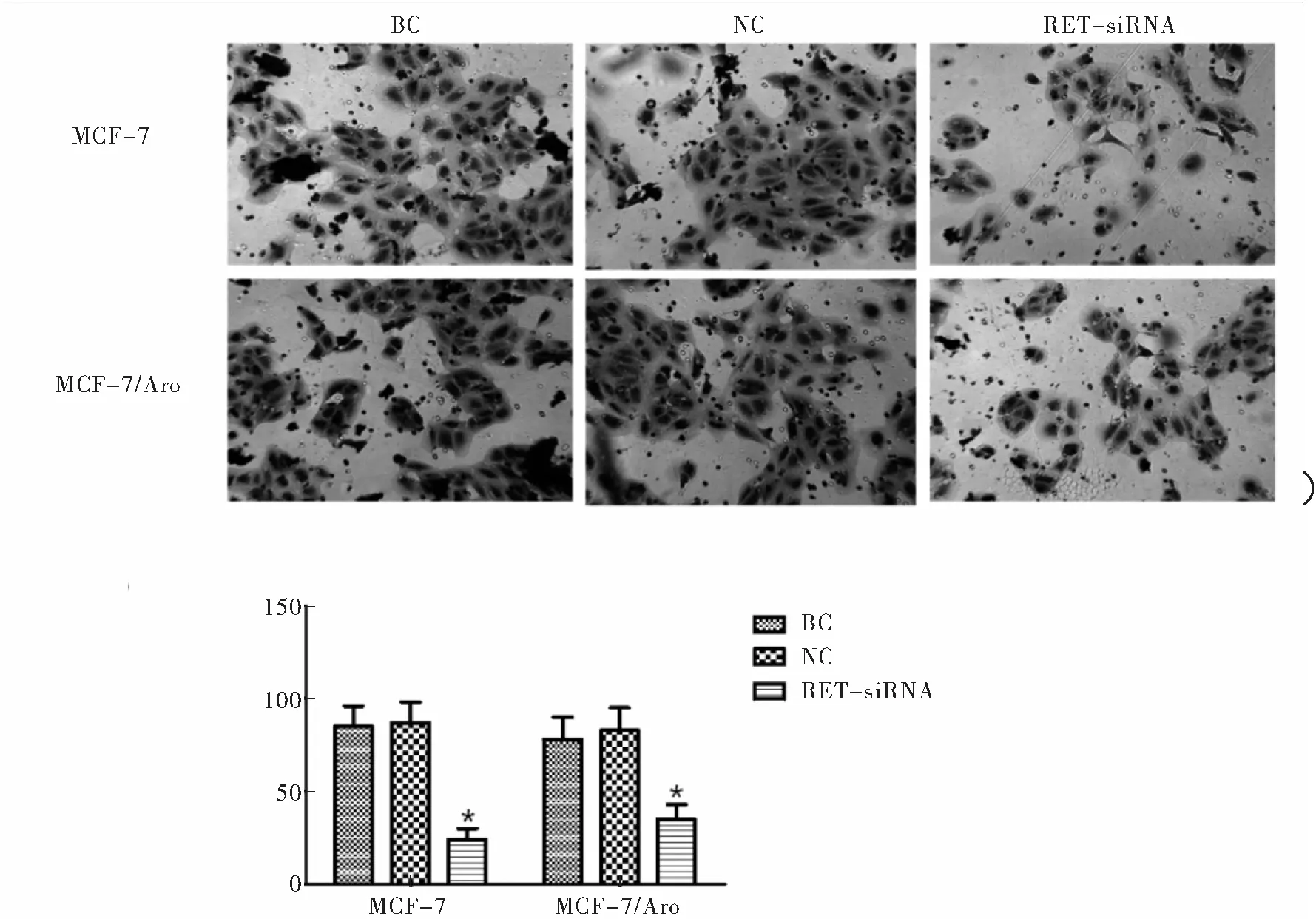
图3 Transwell检测RET-siRNA对MCF-7和MCF-7/Aro细胞迁移作用
注:A: MCF-7和MCF-7/Aro细胞株转染24 h后细胞迁移情况;B: MCF-7和MCF-7/Aro细胞株转染24 h后细胞迁移数量;与NC组和BC组比较,*P<0.05
2.4 RET-siRNA抑制乳腺癌细胞株的增殖
MTT法检测沉默RET对乳腺癌细胞增殖的抑制作用结果表明,MCF-7和MCF-7/Aro细胞株经RET-siRNA作用0、24、48、72 h后,细胞增殖均被抑制,并且随着作用时间的增加,抑制增殖作用逐渐增强(图4)。
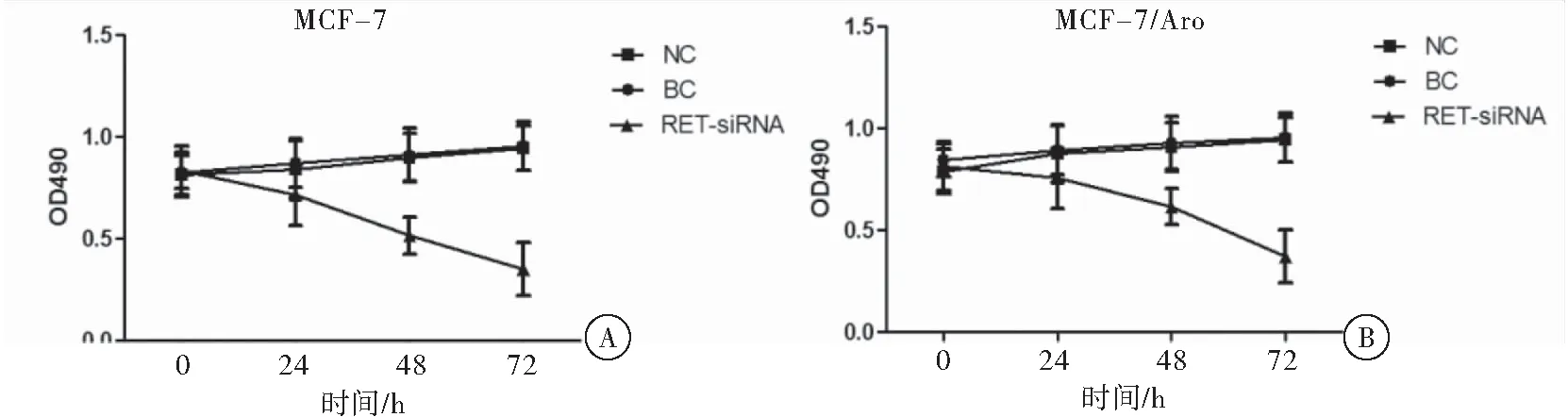
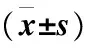
2.5 沉默RET对MCF-7和MCF-7/Aro细胞PI3K/AKT/mTOR通路抑制作用
RT-PCR和Western-blot检测沉默RET对PI3K/AKT/mTOR通路结果表明,MCF-7和MCF-7/Aro细胞株经RET-siRNA作用48 h和72 h后,RET-siRNA组P-mTOR、MEK1、MEK2、P-AKT、PI3K在基因和蛋白水平上表达较BC组和NC组明显降低,差异有统计学意义(P<0.05),提示沉默RET可明显抑制MCF-7和MCF-7/Aro细胞PI3K/AKT/mTOR通路相关蛋白表达(图5~6)。
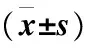
注:A: MCF-7细胞株PI3K/AKT/mTOR通路蛋白表达情况;B: MCF-7/Aro细胞株PI3K/AKT/mTOR通路蛋白表达情况;与NC组和BC组比较,*P<0.05
图6 Western-blot检测RET-siRNA对PI3K/AKT/mTOR通路相关蛋白影响
注:A: MCF-7、 MCF-7/Aro细胞株PI3K/AKT/mTOR通路蛋白表达情况;B: 图A中MCF-7 PI3K/AKT/mTOR通路蛋白相关灰度值计算;C:图A中MCF-7/Aro PI3K/AKT/mTOR通路蛋白相关灰度值计算;与NC组和BC组比较,*P<0.05
3 讨论
RET原癌基因是定位于10q11.2,编码一种跨膜的酪氨酸蛋白激酶受体,它调节细胞的正常生理功能[3],对神经内分泌系统、肾发育和调节神经细胞的增殖、分化、迁移及胃肠神经系统的发育都起着重要作用[4]。RET蛋白是一种蛋白聚合体,是细胞生长、分化及相关信号转导的细胞表面分子[5-6],其突变与多种疾病的发生密切相关,如甲状腺癌、先天性巨结肠癌等[7-8]。RET基因特异位点的点突变可以增强RET蛋白的转化能力,激发酪氨酸激酶自动磷酸化,诱导细胞增生过度以至癌变[9]。研究[10]发现,正常甲状腺细胞外源性表达RET原癌基因是诱导表达炎症基因和肿瘤基因,引发一系列炎症反应和肿瘤侵袭。研究[11]发现,ER阳性的乳腺癌患者中存在着RET高表达,RET蛋白能增强RET通路-雌激素受体通路之间的相互作用,导致乳腺癌的发生、发展。本研究结果发现,60例乳腺癌患者中存在着RET过表达,沉默RET后,MCF-7和MCF-7/Aro细胞中RET表达下降,细胞增殖和迁移能力受抑制,提示RET-siRNA能有效抑制乳腺癌细胞增殖、侵袭。
Boulay[12]等人通过MCF-7/Aro以及T47D/Aro乳腺癌细胞系为研究对象,证明PI3K/AKT/mTOR通路参与雌激素乳腺肿瘤细胞生长增殖过程。Plaza等[13]研究发现,RET通过激活其配体GDNF导致Ser118和Ser167上的ERα磷酸化,增加ERα转录活性的雌激素非依赖性激活,并且ERα阳性乳腺癌细胞系可导致ERK1/2和AKT通路的激活,沉默GDND可抑制RET下游信号通路PI3K/AKT/mTOR通路相关蛋白表达,减轻芳香酶抑制剂耐受性。
PI3K/AKT/mTOR信号转导通路作为细胞内信号传导通路之一,通过影响下游多种效应分子的活化状态,在细胞内发挥着抑制凋亡、促进增殖的关键作用。RET基因突变可导致PI3K/AKT等下游信号激活,信号转导活性增强,细胞过度增殖,形成肿瘤。本研究采用siRNA沉默RET,PI3K/AKT/mTOR通路相关蛋白在基因和蛋白水平均表现明显下调,表明RET沉默后抑制PI3K/AKT等下游信号激活。
综上所述,RET-siRNA能有效抑制RET基因的表达,抑制乳腺癌细胞增殖侵袭,其作用机制可能是通过下调PI3K/AKT/mTOR信号通路相关蛋白,进而抑制乳腺癌细胞增殖。乳腺癌与RET酪氨酸蛋白激酶受体的密切生物学关系,使RET基因成为一种新型的潜在的人类乳腺癌治疗靶标。
[1]王乐, 张玥, 石菊芳, 等. 中国女性乳腺癌疾病负担分析[J]. 中华流行病学杂志, 2016, 37(7): 970-976.
[2]Boulay A, Breuleux M, Stephan C,etal. The Ret receptor tyrosine kinase pathway functionally interacts with the ERalpha pathway in breast cancer[J]. Cancer Res, 2008, 68(10): 3743-3751.
[3]Califano D, Rizzo C, D'Alessio A,etal. Signaling through Ras is essential for ret oncogene-induced cell differentiation in PC12 cells[J]. J Biol Chem, 2000, 275(25): 19297-19305.
[4]Mai K T, Landry D C, Thomas J,etal. Ret oncogene protein expression in papillary thyroid carcinoma and related lesions[J]. Tumori, 2001, 87(3): 166-172.
[5]Takahashi M, Ritz J, Cooper G M. Activation of a novel human transforming gene, ret, by DNA rearrangement[J]. Cell, 1985, 42(2): 581-588.
[6]de Groot J W, Links T P, Plukker J T,etal. RET as a diagnostic and therapeutic target in sporadic and hereditary endocrine tumors[J]. Endocr Rev, 2006, 27(5): 535-560.
[7]Morrison P J, Atkinson A B. Genetic aspects of familial thyroid cancer[J]. Oncologist, 2009, 14(6): 571-577.
[8]Bolk S, Pelet A, Hofstra R M,etal. A human model for multigenic inheritance: phenotypic expression in Hirschsprung disease requires both the RET gene and a new 9q31 locus[J]. Proc Natl Acad Sci USA, 2000, 97(1): 268-273.
[9]de Groot J W, Links T P, Plukker J T,etal. RET as a diagnostic and therapeutic target in sporadic and hereditary endocrine tumors[J]. Endocr Rev, 2006, 27(5): 535-560.
[10] Borrello M G, Alberti L, Fischer A,etal. Induction of a proinflammatory program in normal human thyrocytes by the RET/PTC1 oncogene[J]. Proc Natl Acad Sci USA, 2005, 102(41): 14825-14830.
[11] Boulay A, Breuleux M, Stephan C,etal. The Ret receptor tyrosine kinase pathway functionally interacts with the ERalpha pathway in breast cancer[J]. Cancer Res, 2008, 68(10): 3743-3751.
[12] Boulay A, Rudloff J, Ye J,etal. Dual inhibition of mTOR and estrogen receptor signaling in vitro induces cell death in models of breast cancer[J]. Clin Cancer Res, 2005, 11(14): 5319-5328.
[13] Plaza-Menacho I, Morandi A, Robertson D,etal. Targeting the receptor tyrosine kinase RET sensitizes breast cancer cells to tamoxifen treatment and reveals a role for RET in endocrine resistance[J]. Oncogene, 2010, 29(33): 4648-4657.

