2型糖尿病合并胃肠道肿瘤术后肠内外营养支持的疗效观察*
全信保 邹佩钢 杨学军 贾映东 吴建平 刘静(遂宁市中心医院消化中心一病区, 四川 遂宁 629000)
胃肠道肿瘤术后患者的消化道重建将对食物的消化吸收产生巨大影响, 不仅可影响胃肠道相关激素的分泌, 同时也可对胰岛素的利用及代谢产生较大影响, 从而导致胃肠道肿瘤术后患者面临营养问题[1-2]。术后患者的营养途径主要有肠内营养(enteral nutrition, EN)与肠外营养(parenteral nutrition, PN)两种, EN是胃肠道肿瘤术后患者较为常用的营养支持方法, 可有效改善患者的营养状况, 同时并发症较少[3-4]。若患者同时合并糖尿病, 由于EN制剂可对糖代谢产生影响, 则需使用胰岛素对血糖进行控制, 而胰岛素控制血糖过程中, 高血糖、低血糖等风险将明显增加[5-6]。因此, 探讨该类患者术后营养支持的方法具有重要的临床意义。为了探讨EN与PN对合并2型糖尿病(type 2 diabetes mellitus, T2DM)的胃肠道肿瘤术后患者的影响, 本研究对86例该类患者进行了对比分析, 现将结果报告如下。
1 资料与方法
1.1 一般资料 选取本院2014年6月至~2015年5月收治的合并T2DM的胃肠道肿瘤患者86例, 以数字表法随机分为EN组与PN组, 每组43例。其中男性52例, 女性34例, 年龄45~67岁, 平均年龄(56.4±8.9)岁。所有患者均符合1999年WHO制定的《糖尿病的相关诊断标准》[7]。其中良性肿瘤26例, 恶性肿瘤60例;胃部肿瘤48例, 肠道肿瘤38例。所有患者均接受外科手术治疗, 且均无严重心、肝、肾功能障碍性疾病, 无脑血管疾病, 无精神疾病病史及家族史, 近期无急慢性炎症病史, 无营养障碍性疾病病史, 无出凝血功能障碍, 无糖尿病严重并发症。经本院医学伦理委员会批准, 所有患者及家属对本次研究均知情同意, 且签署知情同意书。将上述86例患者以数字表法随机分为EN组与PN组, 每组43例, 两组患者性别、年龄、肿瘤性质、肿瘤部位、手术方式(表1), 术前血糖水平(表2)、营养指标(表3)等比较差异均无统计学差异意义(P>0.05), 具有可比性。
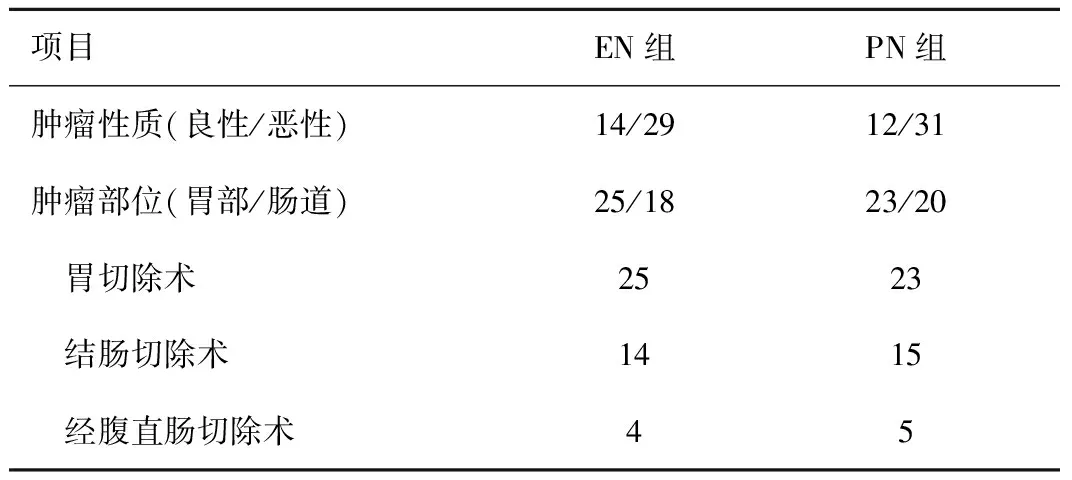
表1 两组患者肿瘤性质及手术方式比较Table 1 The comparison of general data between the two groups
1.2 方法
1.2.1 EN组 本组患者术后给予EN支持, 具体方法如下: 采用糖尿病专用EN制剂-瑞代(德国费森尤斯卡比股份有限公司, 批准文号: H20090445), 以热量为104.6 kJ/(kg·d)计算, 手术当日使用250 mL生理盐水经空肠营养管输注冲管, 术后第1日给予总量的1/3, 第2日给予总量的2/3, 第3日给予全量, 并维持至营养支持完毕, 液体量不足时, 则以常规静脉输液予以补足。EN均经空肠营养管注入, 入路选择: ①毕Ⅰ式手术患者于距离屈氏韧带30~50 cm处空肠对肠系膜缘插入空肠营养管。②毕Ⅱ式手术患者则于胃空肠吻合口远端30~50 cm处空肠系膜缘插入空肠营养管。③全胃切除患者则于食管空肠吻合口远端30~50 cm处空肠系膜缘插入空肠营养管。营养管插入位置均在40 cm以上, 并于肠壁外沿肠壁做隧道式埋入10 cm, 专用戳孔器于腹壁戳孔后将营养管引出, 并妥善固定。
1.2.2 PN组 本组患者术后给予全胃肠外营养支持, 方法如下: 以热量为104.6 kJ/(kg·d)计算, 中心静脉置管给予糖脂比例为2: 1的全合-混合营养液输注, 直至经口半流质饮食恢复方停止肠外营养支持。营养支持过程中, 输注液体量不足者, 则常规静脉输液补足。
1.2.3 血糖控制 详细了解患者T2DM病史及入院前所用降糖药物、近期血糖变化趋势, 并于术前3 天开始给予胰岛素控制血糖, 以空腹血糖(FPG)控制在5.0~7.0 mmol/L、餐后2 小时血糖(2 h PG)控制在<11.1 mmol/L为标准。术后胰岛素用量均按照4 g葡萄糖: 1单位普通胰岛素的比例添加。
1.3 观察指标
1.3.1 血糖 分别于术前、术后1周检测FPG及2 h PG(三餐餐后2 h血糖平均值)。
1.3.2 营养指标 监测术前、术后1周时患者体重(BW)、总蛋白(TP)、白蛋白(ALB)、前蛋白(PA)、转铁蛋白(TFN)以及血红蛋白(Hb)水平。
1.3.3 术后胃肠功能恢复情况 记录两组患者术后肛门排气时间及总住院时间。
1.3.4 并发症 统计两组患者术后吻合口瘘、肺部感染、深静脉导管感染、肝功能损伤、切口感染等并发症发生率。
2 结果
2.1 两组患者手术前后血糖变化 两组患者术前FBG、2hPG比较差异均无统计学意义(P>0.05), 术后1周, EN组患者FBG、2hPG与术前比较差异无统计学意义(P>0.05), 而PN组术后FBG、2 h PG则显著高于术前(P<0.05), 且术后1周EN组FBG、2 h PG均显著低于PN组(P<0.01),见表2。
2.2 两组患者手术前后营养指标变化 术前两组患者BW、ALB、PA、TFN、Hb比较差异均无统计学意义(P>0.05), 术后PN组上述指标与本组术前和EN组术后1周比较, 差异均有统计学意义(P<0.05),见表3。
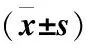
Table2Thecomparisonofbloodglucosechangesbetweenthetwogroups

组别时间FBG9(mmol/L)2hPG(mmol/L)EN组术前5 7±0 69 2±1 3(n=43)术后1周5 1±2 1②8 8±1 5②PN组术前5 8±0 79 1±1 2(n=43)术后1周7 3±2 2①11 2±1 4①
注: ①与本组术前比较, ①P<0.05;②与PN组术后1周比较, ②P<0.01
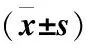
表3 两组患者手术前后营养指标变化Table 3 The comparison of nutritional indexes between the two groups
注: ①与本组术前比较, ①P<0.05;与PN组术后1周比较, ②P<0.01
2.3 术后胃肠功能恢复时间 EN组患者术后肛门排气时间显著短于PN组(P<0.01), 两组住院时间比较差异无统计学意义(P>0.05), 见表4。
2.4 术后并发症 EN组患者术后吻合口瘘1例, 肺部感染1例, 肝功能损伤1例, 并发症发生率为7.0%;PN组术后吻合口瘘2例, 肺部感染2例, 深静脉导管感染3例, 肝功能损伤3例, 切口感染4例, 并发症发生率为32.6%。EN组患者术后并发症发生率显著低于PN组(P<0.01),见表5。

Table4Thecomparisonofanalexhausttimeandhospitalizationtimebetweenthetwogroups
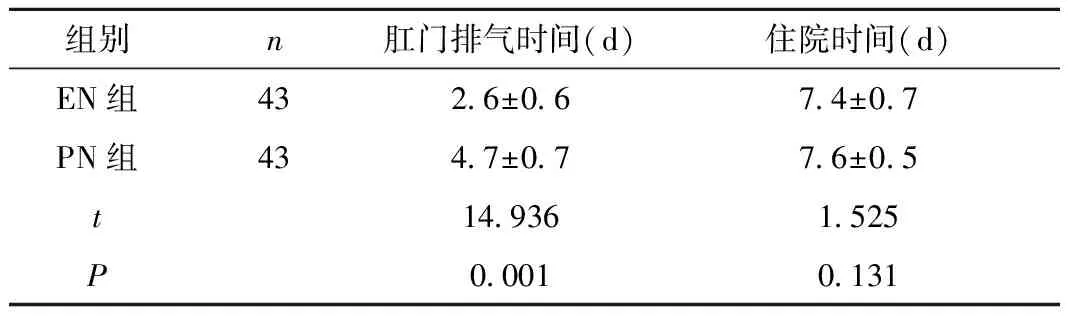
组别n肛门排气时间(d)住院时间(d)EN组432 6±0 67 4±0 7PN组434 7±0 77 6±0 5t14 9361 525P0 0010 131

表5 两组患者术后并发症发生率比较 [n(×10-2)]Table 5 The comparison of complication rate between the two groups
注: 两组术后1周并发症总发生率比较χ2=8.871,P=0.003
3 讨论
近年随着国人生活方式的改变, 导致糖尿病发病率明显增高, 且我国已成为世界上糖尿病患病人数最多的国家[8-9]。糖尿病以高血糖为临床特征, 因长时间的高血糖将导致肾脏、心脏、血管、神经等多种组织器官功能的损伤[10-11]。胃肠道肿瘤是消化道最为常见的肿瘤, 近年来我国胃肠道肿瘤发病率明显增高。胃肠道肿瘤更加多见于中老年人群, 而该人群糖尿病、心脑血管等慢性疾病发病率也明显高于其他年龄段人群, 故胃肠道肿瘤合并糖尿病患者相对较多。关于胃肠道肿瘤治疗, 外科手术切除无疑是最佳治疗方案, 但术后的营养支持则成为临床医生面临的一个重要问题[12-14]。由于患者合并糖尿病, 营养支持过程中应加强对血糖的监控。术后因患者体内肿瘤坏死因子等多种肿瘤相关细胞因子水平的变化, 可导致胰岛素抵抗程度的加重, 降低胰岛素敏感性, 进而导致血糖异常增高[15]。
术后患者消化道的重建能有效促进肠内肽类激素水平的增高, 而肽类激素能够有效影响胰岛素的分泌, 从而对血糖代谢产生间接影响[16-17]。因此, 患者术后营养支持相对于未合并糖尿病患者更值得关注。以往传统的EN制剂多采用麦芽糖、糊精等作为主要成分, 较容易导致患者血糖的增高, 故对于合并糖尿病的消化道外科手术患者, 不建议采用EN。本研究使用了专门为糖尿病患者开发的EN制剂-瑞代, 其配方中主要成分为改良淀粉、膳食纤维以及果糖等, 膳食纤维能够有效调节机体对糖的吸收, 而其中所含有的蜡质谷物以及木薯淀粉等可降低淀粉酶水解率, 其中的果糖为葡萄糖的同分异构体左旋六碳糖, 代谢过程中能够避开磷酸果糖激酶催化的糖的分解这一步骤, 从而使得葡萄糖代谢速度加快, 降低了血糖波动幅度[18]。
用EN能刺激并促进胆汁和肠道内分泌, 同时减少细菌及内毒素易位对肝的损害[19]。本研究与上述报道一致。结果显示, 采用瑞代进行EN支持能够在有效保证患者肝功能。刘红兵等[20]研究认为, EN可以维护肠黏膜屏障作用, 维持肠道免疫功能, 促进肠蠕动, 使胃肠功能及早恢复。本研究中, EN组患者的排气、住院时间均明显低于PN组, 表明采用瑞代进行EN, 不仅能够更好的改善患者营养状态, 还能够促进肠道血液循环, 促进胃肠功能的恢复, 同时, 降低患者住院时间。由于采用EN支持, 完全避免PN可能引起的深静脉导管感染, 且膳食粘稠度增加, 胃排空时间延长, 小肠粘膜对葡萄糖的吸收则可被减缓。另外可溶性膳食纤维于结肠内酵解为短链脂肪酸, 较容易被吸收, 成为不依赖胰岛素即可被利用的能量, 能够更好的满足机体对各种营养素的需求, 增强患者免疫力, 从而可降低术后并发症的发生率, 这与国内相关研究[21]结果相似。
4 结论
对合并T2DM的胃肠道肿瘤术后患者采用EN支持能够在保证有效改善营养指标的基础上降低对血糖波动的影响, 促进胃肠功能恢复, 降低术后并发症发生率, 值得推广。
[1]王群, 曹伟, 赵怡, 等.强化血糖控制与糖尿病患者胃肠肿瘤手术并发症的关系[J].实用癌症杂志, 2010, 25(4): 381-383.
[2]Elshaer M, Gravante G, White J,etal.Routes of early enteral nutrition following oesophagectomy[J].Ann R Coll Surg Engl, 2016, 98(7): 1-7.
[3]杨靓靓, 卞晓洁, 葛卫红, 等.不同血糖调控方式用于腹部中等以上手术术后行肠外营养支持的糖尿病患者的临床效果比较[J].临床合理用药杂志, 2016, 9(5): 7-8, 10.
[4]Shoar S, Naderan M, Mahmoodzadeh H,etal.Early Oral Feeding After Surgery for Upper Gastrointestinal Malignancies: A Prospective Cohort Study[J].Oman Medical Journal, 2016, 31(3): 182-187.
[5]魏起友, 赵德惠, 李文渊, 等.围术期肠内与肠外营养支持用于食管癌合并糖尿病患者的临床比较[J].中国医药导报, 2015, 12(10): 71-74.
[6]Yan X, Zhou FX, Lan T,etal.Optimal postoperative nutrition support for patients with gastrointestinal malignancy: A systematic review and meta-analysis[J].Clin Nutr, 2017, 36(3): 710-721.
[7]World Health Organization.Definition, diagnosis and classifications of diabetes mellitus and its complications.Report of a WHO consultation, Part1: Diagnosis and classification of diabetes mellitus[R].Geneva: WHO, 1999: 3-9.
[8]吕家爱, 陶建秀, 朱晓云, 等.上海市金山区35岁以上居民糖调节受损和糖尿病流行现状[J].现代预防医学, 2016, 43(3): 460-463, 502.
[9]Nomura E, Lee SW, Kawai M,etal.Comparison between early enteral feeding with a transnasal tube and parenteral nutrition after total gastrectomy for gastric cancer[J].Hepato gastroenterology, 2015, 62(138): 536-539.
[10] 毕艳.中国糖尿病慢性并发症的流行病学研究现况[J].中华糖尿病杂志, 2015, 7(8): 467-469.
[11] Zhao G, Cao S, Zhang K,etal.Effect of early enteral nutrition on immune response and clinical outcomes after esophageal cancer surgery[J].Zhonghua Wei Chang Wai Ke Za Zhi, 2014, 17(4): 356-360.
[12] 贺祥昆, 陆春雷, 徐健, 等.不同消化道重建手术方式对胃癌合并2型糖尿病患者血糖及胃肠激素的影响[J].中国肿瘤外科杂志, 2015, 7(6): 360-363.
[13] Kobayashi K, Yu K, Kosugi S,etal. Is early enteral nutrition better for postoperative course in esophageal cancer patients [J].Nutrients, 2013, 5(9): 3461.
[14] Orrevall Y, Tishelman C, Permert J,etal.A national observational study of the prevalence and use of enteral tube feeding, parenteral nutrition and intravenous glucose in cancer patients enrolled in specialized palliative care[J].Nutrients, 2013, 5(1): 267-282.
[15] 李芳, 郑颖颖, 邵翠萍, 等.细胞因子信号抑制因子rs4969170 A/G基因多态性在慢性丙型肝炎合并胰岛素抵抗中的作用及其机制[J].中华肝脏病杂志, 2015, 23(3): 171-174.
[16] 潘锋锷, 林集荣, 杨逸峰, 等.早期肠内营养与全肠外营养对胃癌合并糖尿病患者术后恢复情况的影响对比[J].国际医药卫生导报, 2014, 20(11): 1558-1561.
[17] Kim HU, Chung JB, Kim CB.The comparison between early enteral nutrition and total parenteral nutrition after total gastrectomy in patients with gastric cancer: the randomized prospective study[J]. Korean J Gastroenterol, 2012, 59(6): 407-413.
[18] 潘锋锷.胃癌合并糖尿病患者术后早期肠内营养与全肠外营养对术后恢复的影响比较[J].中国实用医药, 2016, 11(11): 103-105.
[19] Qin HL, Su ZD, Hu LG,etal.Effect of early intrajejunal nutrition on pancreatic pathological features and gut barrier function in dogs with acute pancreatitis[J].Clin Nutr, 2002, 21(6): 469-473.
[20] 刘红兵, 王爱坤.胃癌术后肠内、肠外营养支持对比研究[J].南通大学学报: 医学版, 2013, 33(6): 554-555.
[21] 许现芬, 叶航.早期肠内营养对胃癌根治术后患者机体恢复及免疫功能的影响[J].中国实用医药, 2011, 7(8): 26-27.

