不同剂量辐射对NOD/SCID小鼠肠损伤的影响
杜 彬,原 杰,任召祺,安 媛,江 峰,李 军,杨 超
1火箭军总医院输血科,北京 100088 2北京市红十字血液中心,北京 100088
放射性肠损伤主要见于核事故及战争中的核爆炸,也是临床腹部肿瘤放疗引起的重要并发症之一[1]。体内代谢活跃的肠道组织对电离辐射十分敏感,在辐射过程中,位于小肠隐窝的干细胞和肠绒毛结构会遭到一定程度的破坏,导致肠黏膜结构破坏、肠上皮屏障功能受损、肠道细菌发生易位,严重威胁到患者的生命和生存质量[2- 3]。放射性肠损伤的发病机制主要认为是血管性损伤、肠上皮屏障的破坏和内源性损伤导致的细胞凋亡,其主要病理改变为隐窝结构的破坏,绒毛脱落、黏膜萎缩,肠管发生黏连,甚至形成肠瘘,肠黏膜结构屏障受到破坏,发生细菌易位,导致细菌与内毒素入血,产生菌血症、败血症和多器官功能衰竭等并发症,严重危及患者的生命[4- 6]。虽然研究人员对放射性肠损伤的防治已进行了广泛的研究,但目前对于放射性肠损伤尚无有效的治疗措施[7- 8]。因此,建立适合临床研究的放射性肠损伤动物模型具有重要的意义。本研究根据临床放射性肠损伤的发病率、死亡率及病理组织学特征,综合文献对放射性肠损伤模型应达到的要求,比较了3种不同剂量辐射对NOD/SCID小鼠肠损伤的影响,以期寻找适合建立NOD/SCID小鼠放射性肠损伤模型的辐射剂量,为放射性肠损伤的防治研究提供帮助。
材料和方法
实验动物及分组雄性健康SPF级NOD/SCID(非肥胖糖尿病/重症联合免疫缺陷)小鼠 40只,6~8周龄,体质量18.0~24.0 g,购自北京维通利华公司[合格证号为SCXK(京)2012- 0001]。实验前3 d饲养于实验室以适应环境,温度控制在20~22℃,并实行12 h光照和12 h黑暗交替。将小鼠随机分为空白对照组、4 Gy照射组、5 Gy照射组、6 Gy照射组4组,每组10只。照射组小鼠用戊巴比妥钠(50 mg/kg)腹腔注射麻醉后,仰卧固定于特制的盒子中,全腹部接受60Co γ射线照射,上至胸骨剑突,下至耻骨联合,身体其余部位用5 cm厚铅砖屏蔽。照射剂量分别为4、5、6 Gy,剂量率为1 Gy/min。照射后小鼠可自由活动及饮水,并喂以标准鼠食。于照射前和照射后每天记录小鼠的生存情况和体质量变化,存活小鼠于照射后第15天处死取标本,分别观察肠系膜淋巴结细菌易位率和肠黏膜形态结构的变化。
观测指标
一般情况:观察小鼠的饮食、精神状态、存活情况、有无腹泻、血便及体质量变化。
细菌移位情况:小鼠用1%戊巴比妥钠(50 mg/kg)腹腔注射麻醉后,在无菌状态下取肠系膜淋巴结加1 ml无菌生理盐水匀浆后,加入5 ml TSB培养基中,37℃孵育24 h,观察肠系膜淋巴结细菌移位情况,培养基浑浊即为阳性。
肠黏膜形态结构的变化:取小鼠小肠组织,4%多聚甲醛固定24 h,石蜡包埋、切片,HE染色,然后于光学显微镜下观察肠黏膜及绒毛组织的形态学变化。
统计学处理采用SPSS 16.0统计软件,数据以均数±标准差表示,组间比较采用一元方差分析法,P<0.05为差异有统计学意义。
结 果
小鼠的存活情况空白对照组小鼠均存活。照射后15 d,4、5、6 Gy照射组小鼠的生存率分别为60%、50%、30%(图1)。
小鼠生理状况照射后第5天即可见5 Gy照射组和6 Gy照射组小鼠进食减少、毛发凌乱、活动减少,出现弓背、脱毛现象。4 Gy照射组小鼠粪便潜血实验阳性,阳性率80%(图2),5 Gy照射组和6 Gy照射组小鼠腹泻导致肛周红肿、脱肛,肉眼可见血便,阳性率100%(图3)。
小鼠体质量的变化照射前,空白对照组、4 Gy照射组、5 Gy照射组、6 Gy照射组小鼠的体质量分别为(22.60±2.23)、(22.94±1.02)、(22.54±1.27)、(23.06±1.31)g,各组间差异均无统计学意义(P均>0.05);照射后15 d,空白对照组、4 Gy照射组、5 Gy照射组、6 Gy照射组小鼠的体质量分别为(24.06±1.88)、(21.26±2.07)、(19.92±1.42)、(18.26±3.02)g,5 Gy照射组(P=0.015)和6 Gy照射组(P=0.011)小鼠的体质量明显低于空白对照组,4 Gy照射组与空白对照组差异无统计学意义(P>0.05)。
肠系膜淋巴结细菌移位率细菌培养实验结果显示,空白对照组、4 Gy照射组、5 Gy照射组、6 Gy照射组小鼠的细菌移位率分别为0、20%、50%、70%。
小鼠肠道组织的病理学变化解剖观察小鼠的小肠组织标本。
肉眼观察:空白对照组小鼠的肠管光滑,色泽正常;照射组各组小鼠的肠管肿胀或出血、颜色变暗,甚至出现黏连(图4)。

图1小鼠生存率
Fig1Survival rate of mice

A.空白对照组;B.4 Gy照射组;C.5 Gy照射组;D.6 Gy照射组
A.blank control group;B.4-Gy group;C.5-Gy group;D.6-Gy group
图2粪便潜血实验
Fig2Fecal occult blood test
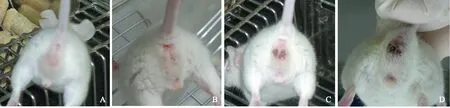
A.空白对照组;B.4 Gy照射组;C.5 Gy照射组;D.6 Gy照射组
A.blank control group;B.4-Gy group;C.5-Gy group;D.6-Gy group
图3小鼠肉眼血便情况
Fig3Visible blood in the stool of mice
镜下观察:与空白对照组相比,照射组小鼠肠组织的肠黏膜绒毛和腺体均受到破坏,4 Gy照射组小肠绒毛长度变低;5 Gy照射组肠黏膜绒毛结构宽大低平,并倒状,伴有上皮细胞脱落,腺体发生萎缩,隐窝结构破坏;6 Gy照射组肠黏膜绒毛结构受损,绒毛离断破碎,隐窝结构缺失,组织间有大量炎症细胞浸润,可见点状出血或坏死(图5)。
各组小肠绒毛长度的比较:照射后3 d,空白对照组、4 Gy照射组、5 Gy照射组、6 Gy照射组小鼠的小肠绒毛长度分别为(371.49±31.23)、(308.65±10.87)、(295.44±23.67)、(262.98±28.15)μm,其中,4 Gy照射组(P=0.023)、5 Gy照射组(P=0.009)、6 Gy照射组(P=0.001)均明显低于空白对照组;照射后7 d,空白对照组、4 Gy照射组、5 Gy照射组、6 Gy照射组小鼠的小肠绒毛长度分别为(380.06±52.28)、(284.03±31.19)、(261.87±21.02)、(230.40±22.10)μm,其中,4 Gy照射组(P=0.009)、5 Gy照射组(P=0.003)、6 Gy照射组(P=0.001)均明显低于空白对照组;照射后15 d,空白对照组、4 Gy照射组、5 Gy照射组、6 Gy照射组小鼠的小肠绒毛长度分别为(361.77±22.77)、(291.68±32.45)、(248.03±51.09)、(195.90±26.39)μm,其中,4 Gy照射组(P=0.005)、5 Gy照射组(P<0.001)、6 Gy照射组(P<0.001)均明显低于空白对照组,5 Gy照射组(P=0.041)和6 Gy照射组(P=0.001)明显低于4 Gy照射组,6 Gy照射组明显低于5 Gy照射组(P=0.020)。

A.空白对照组;B.4 Gy照射组;C.5 Gy照射组;D.6 Gy照射组
A.blank control group;B.4-Gy group;C.5-Gy group;D.6-Gy group
图4小鼠肠组织大体标本的观察
Fig4Morphological observation of intestinal tissues

A.空白对照组;B.4 Gy照射组;C.5 Gy照射组;D.6 Gy照射组
A.blank control group;B.4-Gy group;C.5-Gy group;D.6-Gy group
图5小鼠肠组织的病理学观察结果(HE,×100)
Fig5Pathological observation of intestinal tissues(HE,×100)
讨 论
随着科技的迅猛发展,核能技术在军事、医疗、科研及工农业等领域广泛应用。战争中的核爆炸、核事故及肿瘤放疗等均会造成不可避免的放射性损伤[9]。全球每年约有50万患者接受腹盆腔的放疗,其中5%~10%患者在未来10年内可进展成放射性肠损伤[10]。正常状态下,小肠黏膜的上皮细胞代谢活跃,更新速度快,隐窝上皮细胞不断增殖分化,向绒毛上皮移行,同时,绒毛上皮生理性脱落,通过动态平衡来维持肠黏膜结构的完整性和正常的生理功能。当机体受到一定剂量的辐射后,隐窝上皮细胞的增殖受到抑制,导致绒毛上皮缺乏更新,会破坏小肠绒毛的完整性,肠道细菌发生易位,黏膜溃疡、坏死及出血,最终导致内源性败血症或多脏器功能衰竭等致死性并发症[11- 12]。目前,临床有大量放射性肠损伤的病例,虽然其病理表现明确,但发病机制复杂,目前尚未完全清楚[13- 14]。放射性肠损伤尚缺乏特效的治疗手段[15]。因此,基于充分了解放射性肠损伤的稳定可靠的动物实验模型对其防治研究显得尤为重要。
文献报道的放射性肠损伤动物模型的辐射剂量和所用动物不完全一致[16- 17]。Brook等[18]应用4.25 Gy和10 Gy的60Co辐射的小鼠放射性肠炎模型实现降低肠道细菌易位率及死亡率。尽管不同研究所使用的辐射剂量及所用动物不完全一致,但公认应该产生肠黏膜的组织学损伤,伴随肠系膜淋巴结的细菌易位,死亡率与临床相似或略高[19]。NOD/SCID小鼠是在重症联合免疫缺陷(SCID)小鼠的基础上与非肥胖性糖尿病(NOD/Lt)小鼠品系回交的免疫缺陷鼠,既有先天免疫缺陷,又有T细胞和B淋巴细胞缺陷,较少发生免疫排斥反应,更适合临床疾病的研究[20- 21]。因此,本研究选用NOD/SCID小鼠作为实验对象,比较了4、5、6 Gy的60Co γ射线对NOD/SCID小鼠全腹照射后所形成动物模型的存活率、体质量变化、肠系膜淋巴结的细菌移位率及小肠标本的病理学变化等。结果显示,5 Gy60Co γ射线对全腹照射后小鼠的存活率为60%,体质量显著下降,肠系膜淋巴结细菌易位率为60%,肠黏膜绒毛出现脱落甚至坏死,与临床放射性肠损伤患者的发病率、症状及组织病理学改变相近,提示该照射剂量适当、照射范围合理,能较准确地反映临床急性放射性肠损伤的病理状态。因此,应用5 Gy的60Co γ射线全腹照射所形成放射性肠组织损伤的NOD/SCID小鼠模型,适合临床放射性肠损伤防治研究的需要。
[1] Harb AH,Abou Fadel C,Sharara AI. Radiation enteritis [J]. Curr Gastroenterol Rep,2014,16(5):383. DOI:10.1007/s11894- 014- 0383- 3.
[2] Kalita B,Ranjan R,Singh A,et al. A combination of podophyllotoxin and rutin attenuates radiation induced gastrointestinal injury by negatively regulating NF-kappaB/p53 signaling in lethally irradiated mice [J]. PLoS One,2016,11(12):e0168525. DOI:10.1371/journal.
[3] Webb GJ,Brooke R,De Silva AN. Chronic radiation enteritis and malnutrition [J]. J Dig Dis,2013,14(7):350- 357. DOI:10.1111/1751- 2980.
[5] Shao F,Xin FZ,Yang CG,et al. The impact of microbial immune enteral nutrition on the patients with acute radiation enteritis in bowel function and immune status [J]. Cell Biochem Biophys,2014,69 (2):357- 361. DOI:10.1007/s12013- 013- 9807- 1.
[6] Song S,Chen D,Ma T,et al. Molecular mechanism of acute radiation enteritis revealed using proteomics and biological signaling network analysis in rats [J]. Dig Dis Sci,2014,59 (11):2704- 2713. DOI:10.1007/s10620- 014- 3224- 1.
[7] Kountouras J,Zavos C. Recent advances in the management of radiation colitis[J]. World J Gastroenterol,2008,14:7289- 7301. DOI:10.3748/wjg.14.7289.
[8] Chapel A,Francois S,Douay L,et al. Fifteen years of preclinical and clinical experiences about biotherapy treatment of lesions induced by accidental irradiation and radiotherapy [J]. World J Stem Cells,2013,5(3):68- 72. DOI:10.4252/wjsc.v5. i3.68.
[9] Lee HJ,Kim YS,Shin SS,et al. Long-term outcomes of concomitant chemoradiotherapy incorporating high-dose-rate brachytherapy to treat locally advanced cervical cancer[J]. Tumor,2012,98:615- 621.DOI:10.1700/1190.13203.
[10] Yang C,Dai W,Chen H,et al. Application of human bone marrow-derived mesenchymal stem cells in the treatment of radiation-induced gastrointestinal syndrome [J]. Sci China Life Sci,2014,57 (12):1177- 1182. DOI:10.1007/s11427- 014- 4721- 3.
[11] Baranyai Z,Sinko D,Josa V,et al. Therapy of radiation enteritis-current challenges [J]. Orv Hetil,2011,152 (28):1120- 1124. DOI:10.1556/OH.2011.29141.
[12] Curtis NJ,Bryant T,Raj S,et al. Acute radiation enteritis causing small bowel obstruction [J]. Ann R Coll Surg Engl,2011,93 (7):e129-e130. DOI:10.1308/10. 1308/147870811X602122.
[13] Chandrakesan P,May R,Weygant N,et al. Intestinal tuft cells regulate the ATM mediated DNA Damage response via Dclk1 dependent mechanism for crypt restitution following radiation injury [J]. Sci Rep,2016,6(11):37667- 37685. DOI:10.1038/srep37667.
[14] Moussa L,Usunier B,Demarquay C,et al. Bowel radiation injury:complexity of the pathophysiology and promises of cell and tissue engineering [J]. Cell Transplant,2016,5(18):23- 29. DOI:10.3727/096368916X691664.
[15] Shadad AK,Sullivan FJ,Martin JD,et al. Gastrointestinal radiation injury:prevention and treatment [J]. World J Gastroenterol,2013,19 (2):199- 208. DOI: 10. 3748/wjg.v19.i2.199.
[16] Verginadis II,Kanade R,Bell B,et al. A novel mouse model to study image-guided,radiation-induced intestinal injury and preclinical screening of radioprotectors [J]. Cancer Res, 2016,77(4):908- 917. DOI:10.1158/0008- 5472.CAN- 16- 2724.
[17] Shim S,Jang WS,Lee SJ,et al. Development of a new minipig model to study radiation-induced gastrointestinal syndrome and its application in clinical research [J]. Radiat Res,2014,181 (4):387- 395. DOI:10.1667/RR13207.1.
[18] Brook I,Tom SP,Ledeny GD. Quinolone and glycopeptide therapy for infection in mouse following exposure to mixed field eutronrphoton radiation [J]. Int J Radiat Biol,1993,64(6):771- 777.
[19] Samples DC,Henry J,Bazan C,et al. A case of astroblastoma:Radiological and histopathological characteristics and a review of current treatment options[J].Surg Neurol Int,2016,12(40):S1008-S1012. DOI:10.4103/2152- 7806.195583.
[20] Song M,Lv Q,Zhang X,et al. Dynamic tracking human mesenchymal stem cells tropism following smoke inhalation injury in NOD/SCID mice [J]. Stem Cells Int,2016:1691856- 1981869. DOI:10.1155/2016/1691856.
[21] Levy C,Fusil F,Amirache F,et al. Baboon envelope pseudotyped lentiviral vectors efficiently transduce human B cells and allow active factor IX B cell secretioninvivoin NOD/SCIDgammac-/-mice [J]. J Thromb Haemost,2016,14 (12):2478- 2492. DOI:10.1111/jth.13520.

