罕见病政策国际经验及对我国的启示
马 正高嘉敏 赵艺皓 戴婉薇 郑晓瑛,3
1.北京大学人口研究所 北京 100871 2.北京大学战略研究所 北京 100871 3.北京大学亚太经合组织健康科学研究院 北京 100871
罕见病是一项重要的公共卫生议题,并对卫生服务体系的建设和完善提出挑战。全球范围内,大约有6%~7%的人口受罕见病影响[1]。罕见病发病率低,患病人数少,多为遗传性疾病,常导致个体残疾、精神障碍、生活质量下降等不良健康结局,并给家庭和社会带来负担。[2]相当数量的罕见病并未纳入到国际和国家疾病分类体系,缺乏相应的卫生信息。[3]
长期以来,我国尚无罕见病的官方定义,相关的法规政策长期处于空白。2018年5月11日,国家卫生健康委员会等5个部门联合制定了《第一批罕见病目录》,纳入了121种罕见病。尽管该目录涵盖的疾病种类有限,但为今后制定相应的罕见病相关政策和研究提供了依据,是我国罕见病领域的一项里程碑式事件。
目前我国对于罕见病相关政策的制定仍处于相对初始阶段,但国家和社会对罕见病的关注和重视程度不断提高,本研究通过总结和比较部分发达国家和地区罕见病相关政策的经验,以期对我国罕见病政策制定和干预策略提供参考。
1 罕见病概况
1.1 罕见病的定义及分类
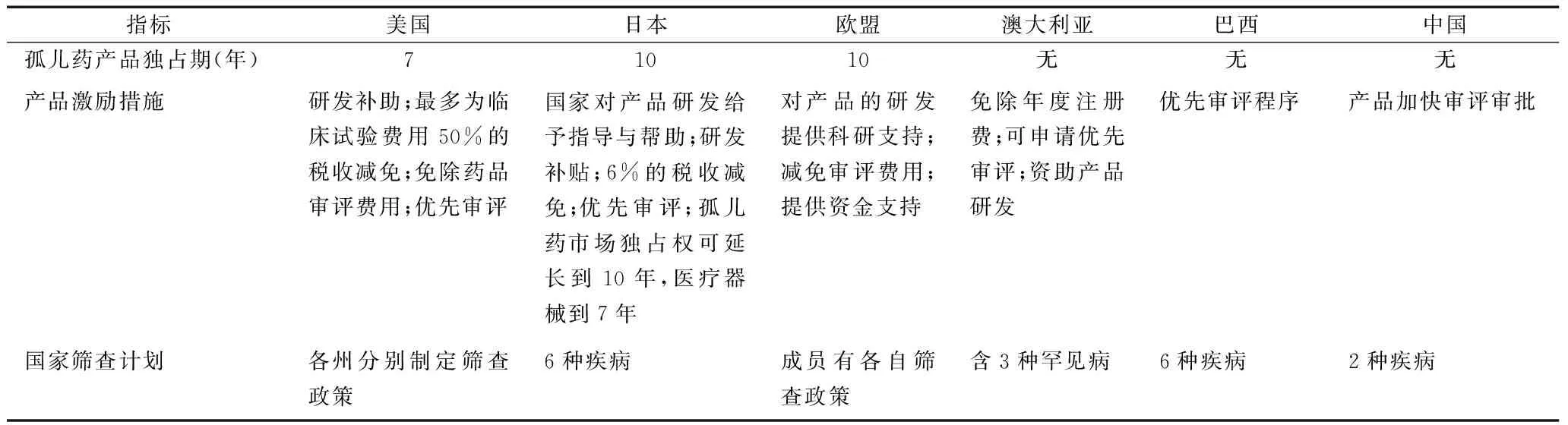
罕见病在世界范围内尚未有一个被广泛接受的统一标准定义。罕见病用药,又称孤儿药(Orphan Drug),是以罕见病为目标,用于治疗、预防、诊断这类疾病的药品。[4]为了保障罕见病患者享有平等的医疗待遇、改善企业研发罕见病产品市场环境,目前美国、欧盟、日本等主要发达国家和地区,通过制定各自的罕见病专项法律、法规,推动保护罕见病患者的合法权益。美国将罕见病定义为影响少于20万美国人口或影响超过20万美国人口但用于治疗该疾病药品的研发和生产无法在市场上实现收支平衡的疾病。[5]日本将罕见病界定为患病人数少于5万的疾病。[6]欧盟界定义罕见病的标准为欧盟地区内发病率低于0.05%的疾病[7],澳大利亚、巴西等国家也在通过推动相关的法案或卫生计划以立法或政策制定的形式对罕见病进行相关界定(表1)[8- 9]。
根据不同的分类依据,罕见病的分类方法有所不同,常用的几种分类方法包括以疾病的紧急程度、发生频率、疾病性质和病因分类。按疾病的紧急情况可分为急性和非急性;以发生频率大小为划分,则可分为极端罕见(发病率低于0.01%)、罕见(0.01%~0.1%)和少见(0.1%~0.5%);按照疾病性质,划分为代谢系统、消化系统、泌尿生殖系统、心血管和呼吸系统、肌肉—骨骼类、神经系统、内分泌系统等疾病类型;按病因则划分为遗传性疾病、感染性病变、肿瘤性和肿瘤样病变、损伤性疾病和其他病变。[10]
1.2 罕见病的特点
约80%的罕见病为遗传缺陷疾病,罕见性遗传病源于人体的基因突变,大约2 000多种单个基因突变导致罕见病已找到致病基因,但多数罕见病的基因突变病理尚未明确。约20%的非遗传性罕见病则由细菌、病毒、自身免疫病所致。[10]
从疾病特点上看,罕见病具有以下特征:(1)发生概率低、患者规模小;(2)病情严重,死亡率和致残率高;(3)具有遗传异质性;(4)诊断和治疗难度大,认知和关注薄弱;(5)社会保障和卫生服务供给不足;(6)具有人群、区域分布差异,部分罕见病可治性较低。[11]

表1 部分国家和地区罕见病定义及相关政策
(续)
数据来源:World Health Statistics 2018:Monitoring health for the SDGs [EB/OL]. http://apps.who.int/iris/bitstream/handle/10665/272596/9789241565585-eng.pdf?ua=1
2 部分国家或地区罕见病政策
目前,有较为完善的罕见病政策的主要是发达国家和地区。本文以美国、日本、欧盟为例,对国际上罕见病相关政策法规及相关药品情况进行介绍。
2.1 罕见病相关法案的产生
1983年1月4日美国《孤儿药法》(Orphan Drug Act)经国会表决生效。[12]该法案是世界上最早的关于罕见病药物的法律。随后在1984年、1985年和1988年经过反复修订。[13]1984年对《孤儿药法》的第一次修订明确了罕见病的定义,即“在美国患者少于20万人,或患者人数超过20万人,但治疗此类疾病或症状的药品在美国的销售额无法弥补研发和供应该类药品的成本”的一类疾病或症状。[14]
日本借鉴美国的《孤儿药法》, 1993年4月修订了《药事法》,分别从增加补贴、减税、免费咨询、缩减申请过程成本、审理优先权、纳入医保、独占期延长等方面进行修订。[15]《药事法》第77-2款根据日本国情,明确了罕见病和孤儿药的三条标准:(1)在日本境内患病人数必须少于50 000人;(2)该疾病目前还没有其他合适的治疗方法或者药品有效性和安全性优于现有的药品或者疗法;(3)药品研发必须有较高的成功率(药品的使用必须有切实的理论依据以及可行的研发方案)。[16]
1999年12月,欧洲议会通过了关于罕见病医药产品的法规《Regulation (EC) No141 /2000 of the European Parliament and of the Council of l6 December 1999 on Orphan Medicinal Products》,并于2000年1月22日生效,该法规第3条规定了能够认定为孤儿医药产品所需要满足的条件:(1)在提交申请时,产品是为了用于诊断、预防或治疗危害生命、慢性消耗性疾病,而且该疾病在欧盟境内发病率不能高于万分之五;或用于诊断、预防或治疗危害生命、慢性消耗性疾病的产品,如果在没有激励措施的情况下,在欧盟境内销售无法收回研发投入;(2)在欧盟境内缺乏有效的诊断、预防或治疗方法,或与既有的方法相比,该医药产品能较为显著地使相关疾病患者受益。[17]
2.2 管理机构
美国、日本和欧盟地区的罕见病政策制定和产品管理机构主要是以政府部门为主导,组建专门负责罕见病相关政策执行和产品审批工作的行政机构,并引导相关研究机构开展学术研究。
在美国,罕见病政策的制定和产品的管理由食品药品监督管理局(Food and Drug Administration,FDA)负责。1982年,FDA成立罕见病产品研发办公室(Office of Orphan Products Development, 简称OOPD),与医疗和研究机构、执业组织、科研单位、制药企业、罕见病民间组织相互合作,推动美国罕见病及孤儿药的政策发展。该部门的主要职责是实施《孤儿药法》的主要条文、为罕见病的产品研发提供激励性措施,指引、运营罕见病的项目及药品补贴管理,并为孤儿药的临床研究提供资金支持。
日本孤儿药的管理机构职责与美国类似,但在职能分配上存在差异,体现为行政事务和产品专业咨询、审评、研发指导分别由不同机构负责。日本罕见病相关政策的落实以及孤儿药的管理主要由厚生劳动省负责,药品医疗器械审评中心(Pharmaceuticals and Medical Devices Agency, 简称PMDA)主管罕见病药品和医疗器械的临床咨询和上市审评工作;国立生物医学创新研究所(National Institute for Biomedical Innovation,简称NIBIO)主要负责罕见病的产品申请人的研发补助管理、咨询指导等工作。[16]
欧盟授权欧洲药品管理局(European Medicines Agency, 简称EMA)统一管理欧盟地区医疗产品相关事宜。遵照欧盟141/2000法规,专门成立罕见病药品委员会(Committee for Orphan Medicinal Products, 简称COMP),在欧盟境内负责罕见病药品的认定程序、申请评审、药品注册等事宜的管理。[18]
2.3 药物政策和激励措施
美国、日本和欧盟的罕见病政策手段和激励措施类似,分别从法律保障、行政制约、税收激励、经费补助等角度制定和实施,但基于国情的不同,产品独占权的年限、补贴种类和计划存在差异(表1)。
2.3.1 美国
美国OOPD制定了罕见病产品临床试验补助计划(Orphan Products Clinical Trials Grants Program),为处于临床研究的孤儿药、生物制剂、医疗器械或医疗食品研发提供经费资助。一般而言,OOPD对孤儿产品研发的资助期限为3~4年,每财政年度增加12~18个新的补助。[19]I期临床研究最多可以在3年内每年获得至多20万美元的补助,II期或III期临床试验最多可以在三年内每年获得至多35万美元的补助。此外,孤儿药的临床研究费用在美国享受50%的免税优惠,并且具有延长免税时限的资格。药品获得孤儿药认定后,享受税收减免,减免金额上限为该药品相关临床试验费用的50%。美国还免除了罕见病产品的申请人应缴纳的FDA审评费用。[14,20]
在药品注册审批政策方面,FDA制定了罕见药快速审评政策,包括优先审评和加速审评项目,开通药品加速审评的绿色通道。此外,美国的罕见病产品的激励政策还包括7年的市场独占权,即药品认定为孤儿药当日起7年内,不会有其他同类产品的认定。而且根据《孤儿药法》,市场独占权既包括专利药品,也涵盖非专利药品。
2.3.2 日本
日本通过在相应的法律法规里制定激励政策来推动罕见病产品的研发和生产。一是对罕见病产品研发全过程提供50%的经费补助;二是10年市场独占权(其他药物为6年);三是非补助的剩余费用实施科研费用15%的税收减免及企业费用最高14%的税收减免;四是为罕见病药品的审评提供优先审评和快速通道服务,以及免费提供咨询支持和减免审评费用等相关措施。[8,15]然而,与美国不同的是,日本政府采取政策直接干预孤儿药的生产、销售和定价。
2.3.3 欧盟
欧洲药品管理局(EMA)在孤儿药的认定和审评审批方面建立了较为完善的机制。欧盟委员会基于EMA罕见病药物委员会的评估意见对孤儿药进行最终认定,由欧盟用药委员会采取集中式评审程序进行认定。[21]
在激励措施方面,欧盟的政策包括:(1)罕见病医药产品上市后可以获得最长达10年的市场独占期,除非出现例外情形,包括:原上市许可持有人同意;原上市许可持有人无法供应足量药品;另外的申请人能证明,与已获得许可药品相比,其申请的药品比之前批准的产品“更为安全、有效或有其他临床优越性”;(2)为罕见病医药产品申请者证明其药品的质量、安全性和有效性需要进行的各种检测和试验提供科学建议[22];(3)减免药品申请上市的审评费用,根据对罕见病医药产品认定情况,全部或部分免除与上市许可程序相关的EMA咨询和审评等费用[23];(4)对于罕见病或者罕见病用药项目进行资金援助[24]。
2.4 保障政策
发达国家的保障政策主要包括医疗保险、新生儿筛查计划、医疗信息平台等。美国罕见病患者治疗费用的支付途径主要包括政府的医疗保健计划、保健组织以及商业保险。商业医疗保险为罕见病治疗费用的主要承担方,患者可通过加入商业医疗保险公司的独立处方药计划或医方照顾计划来获得孤儿药。[25]
日本药品的价格由政府制定,国家健康保险体系(National Health Insurance,NHI)进行支付。一旦一个孤儿药被批准上市,NHI会与制药公司谈判价格,孤儿药可以有10%的溢价幅度。在130个认定的罕见病里,有56个可以获得报销,其中30%由保险公司支付,其余的部分由中央和地方政府支付。[5]
2009年欧洲理事会大力推动各成员国根据本国的发展程度、医疗保障体系、孤儿药可获得性和可及性的情况制定该国的罕见病防治计划。[26]鼓励各成员国完善医疗保险和报销体系、建立罕见病基金。尽管孤儿药的认定、激励方案和上市审批程序由欧盟集中管理,但罕见病产品的定价和报销工作由成员国负责,成员国医疗保险体系和药品报销覆盖范围影响居民对药物的可及性。希腊、葡萄牙和西班牙等国家目前已确定了国家罕见病计划的总体目标、优先改善领域及具体措施,其他欧盟成员国也陆续有类似的措施出台。欧洲国家罕见病保障计划具体领域主要包括罕见病特异性的识别;为患者和社会提供疾病信息等,如法国已建立罕见病信息网络平台;提高治疗和药物产品的可及性和可获得性;推动罕见病研究工作进展;加强医护人员系统性的专业培训;患者赋权;医疗和社会保障服务改善等。[27]
在新生儿筛查方面,1962年美国开展新生儿筛查。[28]2005年美国医学遗传学学会(American College of Medical Genetics, ACMG)建议对29种遗传性最强的严重罕见病进行筛查,获得了美国卫生与人类服务部婴儿与儿童遗传疾病专家组的支持。[29]目前,美国各州都制定了自己的新生儿筛查计划,随着筛查技术发展,越来越多遗传性罕见病纳入筛查的疾病范围。日本、欧盟以及世界上很多国家和地区也都有各自针对罕见病的新生儿筛查计划。
在医疗服务方面,欧盟通过建立了临床医学中心,修订Orphanet目录,加强诊断能力建设,对医护人员进行康复培训和制定患者辅助治疗补偿方案。在社会服务和知识方面,开展罕见病信息网络建设服务和社会照顾服务等工作,以此来增加医护人员针对罕见病的诊治水平,为罕见病患者提供支持性保障。
3 中国罕见病的相关政策
我国对罕见病的关注主要体现在医学领域,以基础和临床研究为主。目前,我国尚未明确制定罕见病或孤儿药的针对性的法律法规及支持性政策。[8]缺乏法律法规保障和指导,尚无罕见病的官方标准,支持性服务和环境的政策配套不足[30],使我国罕见病政策的发展仍处于初始阶段。
由表2、表3可以看出,2007年我国颁布《药品注册管理办法》和《新药注册特殊审批管理规定》,从审评审批角度鼓励罕见病药品的申请。随后发布了《新生儿疾病筛查管理办法》,在新生儿筛查中纳入部分遗传性疾病的筛查诊断工作。2013年国家食品药品监督管理局颁布《关于深化药品审评审批改革进一步鼓励药物创新的意见》,提及了针对罕用药新药研发的部分优惠措施,将罕见病用药纳入特殊审评审批的范畴,进行优先加快审评。2015年《国务院关于改革药品医疗器械审评审批制度的意见》要求加快审评审批防治艾滋病、恶性肿瘤、重大传染病、罕见病等疾病的创新药。2017年2月,国务院印发《“十三五”国家药品安全规划》,提出鼓励针对罕见病的有临床价值的新药和临床急需仿制药研发上市,实行优先审评审批,保证罕见病用药的市场供应。
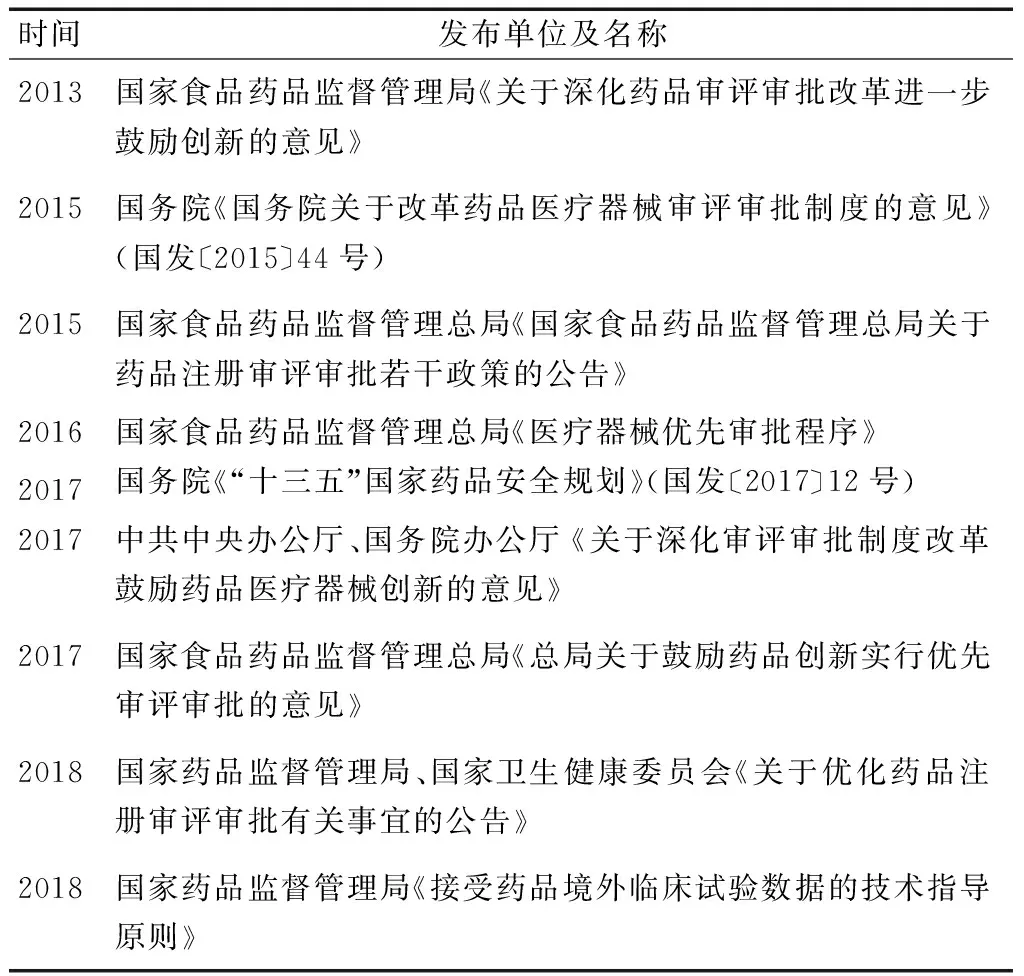
表2 我国罕见病相关政策文件

表3 我国罕见病相关法规
2017年10月,《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》进一步提出,“支持罕见病治疗药品医疗器械研发,国家卫生计生委或由其委托有关行业协(学)会公布罕见病目录,建立罕见病患者登记制度。罕见病治疗药品医疗器械注册申请人可提出减免临床试验的申请。对境外已批准上市的罕见病治疗药品医疗器械,可附带条件批准上市,企业应制定风险管控计划,按要求开展研究。”
随着国家卫生服务能力建设提高,罕见病患者药品需求日益明确,目前我国已对孤儿药实行了一定程度鼓励创新、加快审评审批等政策。2018年6月20日召开的国务院常务委员会上提出对治疗罕见病的药品简化上市要求,相关产品可提交境外研究资料等直接申报上市,监管部门在3个月内审结。[31]
但我国针对罕见病仍缺乏必要的技术咨询、资金补助、临床研究、专利保护和医疗保障等方面的干预政策支持。[32]尽管医保报销范围覆盖了一部分孤儿药,但仍有相当大部分孤儿药未纳入医保,孤儿药定价较高,罕见病患者无法承担相关药品费用。[33]近年来,各地政府积极完善医疗保障政策,将部分罕见病纳入门诊大病范围或提高医保报销标准,如青岛2012年将多发性硬化、重症肌无力症等纳入门诊大病范围等。[34]
4 罕见病国际经验对中国的启示
4.1 逐步建立系统的罕见病政策法规
虽然国家卫健委颁布了《第一批罕见病目录》,涵盖了部分罕见疾病。但是我国对于罕见病仍没有一个统一的官方法律法规,甚至规范性文件。建议通过借鉴部分发达国家相关法规,结合我国实际情况,循序渐进,首先建立罕见病或者孤儿药的专门管理机构,进而推动人大立法。
4.2 拓宽筹资渠道,为罕见病患者提供医疗保障
不同类型罕见病治疗费用相差悬殊,应考虑设计梯度保障方案,为治疗费用水平存在差异的罕见病患者提供保障。
4.2.1 治疗费用较低者:纳入医保
对于治疗费用较低的罕见病,可考虑将这些疾病纳入医保范围,并将相关药品纳入医保药品目录和基本药物目录,使罕见病患者通过基本医疗保险获得治疗。
4.2.2 治疗费用较高者:多渠道救助
推动各地区根据自己的社会经济发展程度,个性化地针对有明确疗效但是治疗费用较高的罕见病病种建立保障措施。将相关罕见病纳入各类公益基金的救助范围。制定政策鼓励制药企业或者其他部门对于罕见病药品进行捐助,并对捐助的企业采取税收优惠等激励措施。
4.3 扩大新生儿筛查疾病的范围
当前,我国规定的新生儿筛查疾病的范围主要是遗传代谢病,这也与大多数罕见病的病因相符。建议将更多的罕见遗传代谢疾病纳入新生儿筛查项目,尽早发现,及时治疗,尽可能减少罕见病的发生发展,为患者及时提供正确的诊断和治疗,降低患者家庭及社会医疗负担。
4.4 提高医护人员罕见病防治水平
罕见病发病率低,信息不完整,导致医生很难积累相关的诊断和治疗经验,常常使病人无法及时确诊进而得不到适当的治疗。建议加强对医生在罕见病领域培训,提高医生对罕见病的认识。在医生培训和继续教育中加入已知的罕见病防治内容,在执业医师资格考试和职称考试中增加罕见病防治的相关知识。
4.5 培育和合理引导罕见病患者组织
发达国家患者组织发展较为成熟,美国自发的罕见病组织有280余家,欧盟地区罕见病组织约有800个患者组织成员,日本也有相当规模的罕见病人组织。对于罕见病患者而言,患者组织能发挥及时分享疾病信息和医疗资源,化解患者及其家庭压力的重要作用。其在各国推动疾病的临床研究、孤儿药的研发和促进罕见病法规政策中的作用和地位不可忽视。培育和合理引导罕见病患者组织,有利于调动患者的积极性,增加公众卫生事业的参与度和罕见病认知度,塑造健康、无偏见的罕见病支持性环境。
作者声明本文无实际或潜在的利益冲突。

