鸡传染性喉气管炎病毒RPA-LFD检测方法的建立
马国和,高冬生,王 增,杨盼盼,杨 霞,王新卫*,边传周*,赵 军*
(1.河南农业大学 牧医工程学院,河南 郑州450002;2.河南牧业经济学院 动物医学系,河南 郑州450046)
鸡传染性喉气管炎病毒(Infectious laryngotracheitis virus,ILTV)属于疱疹病毒科、α-疱疹病毒亚科,病毒核酸为双股DNA。ILTV能够引起鸡的传染性喉气管炎(Infectious laryngotracheitis,ILT),ILT具有高度接触传染和急性感染的特征,临床表现主要为呼吸困难、咳嗽、咳出带血样的渗出物,可以引起鸡的死亡、结膜炎、产蛋率和蛋品质下降,是威胁养鸡业的重要呼吸道传染病之一。该病传播迅速,自1925年在美国被首次报道以来,现已遍及世界各个养鸡区域[1-3],近年来该病在我国多地也呈流行趋势,给养鸡业造成的经济损失不可忽视。
建立准确、快速的现地检测方法,是有效防控鸡ILT的前提。目前,国内外已经建立多种ILTV检测方法,包括病毒分离鉴定[4]、血清学检测[5]以及基于PCR的核酸检测[6-7]方法等,但这些方法均有一定的局限性:病毒分离鉴定耗时较长;血清学检测不适于急性感染期的检测;PCR方法需要特定的设备和严格的操作;环介导等温扩增技术(LAMP)虽然不需要特殊的仪器,但需要设计6对引物,并且对引物设计要求高,反应的非特异性也很强。因此,有必要研究和建立快速、简便和适用于现地ILTV检测的新方法,以弥补现有方法的不足。
重组酶聚合酶扩增(Recombinase ploymerase amplification,RPA)技术是由英国的TwistDx Inc公司于2006年研发的一种核酸恒温扩增技术[8]。该技术主要依赖重组酶、单链结合蛋白和链置换DNA聚合酶,可以在37℃~42℃条件下,实现对模板DNA的快速扩增;相较于其他的核酸体外扩增技术,RPA具有灵敏度高、特异性强、检测时间短、结果读取多元化、操作简便等优点。目前,该技术在包括细菌[9]、真菌[10]、病毒[11-12]、寄生虫[13-14]在内的动物病原检测领域得到广泛应用。RPA扩增产物的检测方法包括琼脂糖凝胶电泳、基于标记探针的实时荧光检测和依赖于特异性寡核苷酸引物或探针的侧向流试纸条(Lateral flow dipstick,LFD)技术。LFD检测系统需要设计末端标记的一对引物,扩增反应得到的双标记分子即可以夹心的方式在包被有特定抗体的试纸条上进行检测。迄今尚未见RPA用于检测鸡ILTV的报道。
本研究的目的是以RPA技术为基础,联合胶体金LFD技术,建立一种在临床上能够快速、准确、特异地检测鸡ILTV的方法,为鸡ILT的有效防控提供技术支持。
1 材料与方法
1.1 主要实验材料ILTV HNXY株、鸡新城疫病毒(NDV)Lasota株、禽流感病毒(AIV)H9N2亚型HP株、鸡传染性支气管炎病毒(IBV)Jin13株、鸡传染性法氏囊病毒(IBDV)HQ株、鸡白血病病毒(ALV)、鸡马立克病毒(MDV)均由河南农业大学禽病研究所分离保存;滑液囊支原体(MG)DNA已鉴定阳性并由实验室保存。57份疑似病料样品为采自临床疑似传染性喉气管炎病鸡的咽喉棉拭子。
TwistAmp basic kit购自TwistDx Inc公司;TaqDNA Polymerase、SYBR Green Premix ExTaqTM、pMD18-T载体均购自TaKaRa公司;DNA Blood Mini Kit、Qiagen QIAamp Viral RNA Mini Kit Plasmid Mini Kit购自QIAGEN公司;胶体金侧向流免疫层析试纸条购自杭州优思达生物技术有限公司,该试纸条设有抗FITC抗体检测线和生物素化抗体质控线。
1.2 引物的设计与筛选 对GenBank中登录的部分ILTV全 基 因 序 列(JX646899.1、KX165320.1、JN804826.1)进行比对,参照TwistDx公司RPA引物设计原则设计了6对引物(表1)。利用QIAamp DNA Blood Mini Kit提取ILTV的基因组DNA作为模板,以TwistAmp basic kit对RPA引物进行筛选。扩增反应参照试剂盒说明书进行,模板100 ng,反应条件采用37℃孵育20 min。反应结束后经2 %琼脂糖凝胶电泳检测RPA产物。选择扩增条带单一的一对引物,对上、下游引物5'端分别用异硫氰酸荧光素(FITC)和生物素(Biotin)进行标记。标记的引物用于后续的RPA-LFD方法的建立。引物由上海生工生物工程技术服务有限公司合成与标记。
1.3 重组质粒标准品的制备 以ILTV基因组DNA为模板,利用引物ILTV-3-F/ILTV-3-R扩增目的基因,50μL体系:10×Buffer(含Mg2+)5μL、dNTPs(10 mmol/L)1μL、上下游引物(25μM)各1μL、TaqTM聚 合 酶(5 U/μL)0.5μL、模 板DNA 10 ng,ddH2O补足。反应程序:95℃5 min;95℃30 s、58℃30 s、72℃20 s,30个循环;72℃5 min。将纯化后的目的片段克隆到pMD18-T载体构建标准质粒,测定核酸含量后按照公式(6.02×1023拷贝数/摩尔)×(ng/μL×10-9)/(DNA长度×660)=拷贝/μL换算为其拷贝数。

表1 用于ILTV检测的引物信息Table 1 Primers for ILTV detection
1.4 RPA-LFD方法的建立 为了利用LFD检测RPA扩增产物,本研究首先利用5'端分别标记FITC和Biotin优选RPA引物进行一系列RPA条件的优化。所有优化试验均采用100 ng的ILTV基因组DNA为模板。
对标记引物浓度(1 000 nmol/L、500 nmol/L、250 nmol/L、125 nmol/L、62.5 nmol/L、31.25 nmol/L、15.625 nmol/L、7.8125 nmol/L),反 应 温度(25℃、27.5℃、30℃、32.5℃、35℃、37.5℃、40℃、42.5℃),反应时间(2 min 30 s、5 min、7 min 30 s、10 min、12 min 30 s、15 min、17 min 30 s、20 min)进行优化,反应体系参照试剂盒进行。
所有优化试验的扩增产物均通过胶体金侧向流免疫层析试纸条检测。取5μL RPA扩增产物,与95μL Tris缓冲液(25 mmol/L Tris、150 mmol/L NaCl和0.05 % Tween-20)在1.5 mL EP管中混匀,将试纸条的偶联垫末端垂直插入EP管中,使其接触混合液,10 min后取出试纸条观察并拍照记录结果,选择阳性样品出现最强检测线和质控线而阴性样品不出现检测线仅出现质控线时的条件作为RPA-LFD的优化条件。
1.5 特异性试验 利用Qiagen QIAamp Viral RNA Mini Kit分别提取NDV、AIV H9N2、IBV、IBDV、ALV的RNA,并采用随机引物将其反转录为相应cDNA。采 用DNA Blood Mini Kit提 取MDV、ILTV、MG基因组DNA。分别取100 ng上述病毒的cDNA或DNA为模板,利用已优化的条件进行RPA扩增反应,在胶体金侧向流免疫层析试纸条上检测扩增产物。验证该方法的特异性。
1.6 敏感性试验 将构建的标准质粒进行100拷贝/μL~108拷贝/μL的梯度稀释,分别以其为模板进行RPA、常规PCR和荧光定量PCR检测,并比较三者的敏感性。RPA扩增反应按照优化的条件进行,扩增产物经胶体金侧向流免疫层析试纸条检测。确定该方法的敏感性。
普通PCR和SYBR Green I荧光定量PCR所用引物为依据非标记的优化引物,但引物长度按照普通PCR和SYBR Green I荧光定量PCR的引物设计原则与RPA-LFD方法中所用引物进行了缩短,序列为F:5'-CTGCCTAAGCGAGGCTCCGCAC-3'/R:5'-C AATTCAGCCGAGGATTTGG-3'。扩增产物长度为151 bp。普 通PCR为50μL体 系:10×Buffer(含Mg2+)5μL、dNTP(10 mmol/L)1μL、上下游引物(20μmol/L)各1μL、TaqTM聚合酶(5 U/μL)0.5μL、模板DNA 1μL,ddH2O补足。程序:95℃5 min;95℃30 s、58℃30 s、72℃20 s,30个循环;72℃1 min,扩增产物经2 %的琼脂糖凝胶电泳检测。
SYBR Green I荧光定量PCR为20μL体系:SYBR Green Premix ExTaqTM(2×)10μL、引物各0.5μL(20μmol/L)、模板1μL,ddH2O补足。反应程序为:95℃1 min;95℃5 s、56℃4 s、72℃7 s,共40个循环。
1.7 临床样品检测 利用所建立的RPA-LFD方法和普通PCR方法分别检测临床送检的疑似病料57份,比较两种方法的符合率。
2 结果
2.1 引物的筛选 根据RPA的引物设计原则共设计了6对ILTV特异性引物,利用TwistAmp basic kit对引物进行筛选。结果显示,6对引物均能够扩增出目的条带,但引物ILTV-3-F/ILTV-3-R扩增的产物比较单一(图1),因此选择其作为建立RPA-LDFD方法用的引物,并在上、下游引物的5'端分标记FITC和Biotin,以便用胶体金侧向流试纸条检测扩增产物。
2.2 反应条件的优化 本研究对反应体系中的引物浓度、反应时间和反应温度分别进行了优化。结果显示,引物浓度在62.5 nmol/L~250 nmol/L时,阳性对照和阴性对照均成立(图2A),本实验优选250 nmol/L的浓度作为后续试验的使用浓度。
反应时间优化结果显示,RPA反应为10 min~20 min时,试纸条均可以检测到扩增产物(图2B),本实验优选20 min作为后续试验的反应时间。在确定最佳引物浓度和反应时间的基础上,进行了反应温度优化。结果显示,温度在30℃~42.5℃时,试纸条均可以特异性检出RPA扩增产物(图2C),本实验优选37℃作为后续试验的反应温度。
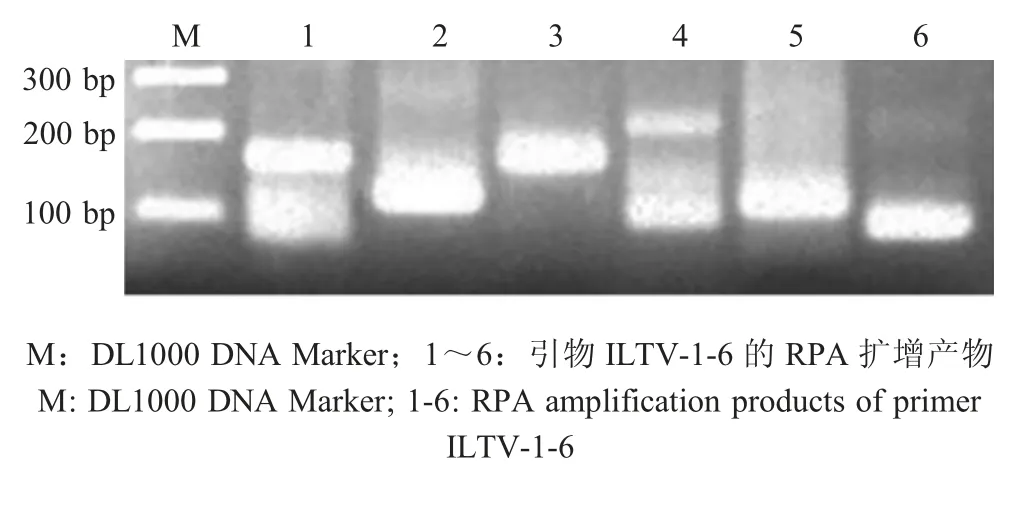
图1 ILTV的RPA引物筛选Fig.1 Primer screening of the RPA for ILTV by RPA

图2 检测ILTV的RPA-LFD反应条件的优化Fig.2 Optimization of the RPA-LFD reaction conditions for ILTV detection
2.3 特异性试验 分别以NDV、AIV H9N2亚型、IBV、IBDV、ALV的cDNA和MDV、ILTV的DNA为模板验证所建立的检测ILTV的RPA-LFD方法的特异性。结果显示,仅以ILTV的DNA为模板的RPA扩增产物在试纸条上同时出现检测线和质控线,而其它病原的扩增产物仅出现质控线(图3),表明该方法的特异性良好。

图3 检测ILTV的RPA-LFD方法的特异性Fig.3 Specificity of the RPA-LFD method for ILTV detection
2.4 敏感性试验 采用倍比稀释的标准质粒作为模板,比较所建立的RPA-LFD方法与常规PCR、SYBR Green I荧光定量PCR的敏感性。结果显示,本实验建立的RPA-LFD检测方法最低检出限为102拷贝/μL(图4A),普通PCR的检出限仅为104拷贝/μL(图4B),荧光定量PCR的检出限为10拷贝/μL(图4C),表明本研究建立的RPA-LFD方法敏感性高于普通PCR,但低于荧光定量PCR。

图4 检测ILTV的RPA-LFD方法的敏感性Fig.4 Sensitivity test of the RPA-LFD assay for ILTV detection
2.5 临床样品检测 利用所建立的RPA-LFD方法与PCR方法分别检测临床送检的疑似病料57份,结果显示RPA-LFD检测出阳性样品46份,阴性样品11份;普通PCR检出阳性样品42份,阴性15。两种方法的符合率为93 %。表明,本研究建立的PPA-LFD方法可用于ILTV的现地检测。
3 讨论
由ILTV引起的ILT是鸡的一种急性、接触性上呼吸道传染病,该病的临床症状和病理变化容易与其它禽呼吸道病如鸡新城疫、禽流感和鸡传染性支气管炎等相混淆,尤其是发生混合感染时,更容易发生误诊,给ILT的临床诊断带来一定的困难。现有的ILTV检测方法通常需要特定的仪器和熟练的实验室操作人员,不适用于对疾病的现地检测。
RPA是一种借助于重组酶、链置换聚合酶和单链结合蛋白的新型等温扩增技术。与其它DNA扩增技术相比,RPA不需要特殊设备即可在更短时间内和较低温度下扩增目的DNA至可检测水平。LFD技术是一种不需要昂贵和复杂仪器以及训练有素的人员即可操作的可视化检测工具。本研究将RPA和LFD技术结合建立了一种检测ILTV的方法。利用分子标记的ILTV特异性RPA引物,通过RPA反应产生双标记的DNA扩增子,标记的扩增产物可以很方便地用LFD进行可视化检测。建立的RPA-LFD方法可以特异性检测ILTV,而不与其它禽病病原发生交叉反应,且RPA-LFD的敏感性比普通PCR高100倍。值得指出的是,目前绝大多数的RPA方法均使用英国TwistDX Inc公司的RPA试剂盒,该公司设计的TwistAmpTMnfo试剂盒的扩增产物可以用LFD检测,该试剂盒的工作原理是借助于特别设计的兼容性标记探针和标记的下游引物生成的双标记扩增产物实现LFD检测。兼容性探针由与靶序列同源的寡核苷酸组成,其5'端带有抗原性标记,内部带有一个核苷酸类似物(通常为四氢呋喃残基或THF)以替代靶序列特殊位置中的一个核苷酸(A或T),以及3'端一个聚合酶延伸阻遏基团。探针的长度通常需要46~52个碱基,其中THF位点的5'端至少要有30个碱基,3'端至少要有15个碱基[15]。尽管探针有助于提高RPA扩增的特异性,但这样的探针在一个特定的基因中通常较难找到,而且合成如此复杂探针通常价格昂贵。本研究室针对该试剂盒缺陷,直接用优化的ILTV特异性上游引物替代复杂的探针,通过优化引物的浓度、反应温度和时间等因素,建立了检测ILTV的RPA-LFD方法。该方法不需要特殊的仪器设备,在恒定的温度下实现ILTV的快速检测,且敏感性与荧光定量PCR相当,比常规PCR高100倍。
总之,本研究综合RPA和LFD的各自优势,建立了一种快速、特异、灵敏、简便的检测ILTV的方法,该方法不需特殊设备,仅需一台能控温的水浴锅,并且结果无需仪器而仅通过肉眼即可判定,对操作人员的要求不高,非常适合在我国兽医临床和基层实验室中应用,具有较好的应用前景。

