液相还原法制备纳米钴粉试验研究
任 娇,何 刚,金永中,陈 建,梁家宁,曾 俊
(四川理工学院 材料科学与工程学院,四川 自贡 643000)
超细钴粉,特别是纳米级钴粉具有极大的体积效应和表面效应[1-2],其电、磁、敏感特性和表面稳定性等十分优异,在磁性材料、硬质合金、表面喷涂、化学催化[3-7]、陶瓷及电池行业等有广泛应用。如硬质合金中掺入超细钴粉,其耐磨性与抗裂性大大提高[8],断裂强度、硬度和密度等综合性能得到极大改善。纳米钴粉可以显著改善陶瓷材料的显微组织,优化其性能。纳米钴粉压成块材后,其颗粒之间界面具有高能量,在较低温度下烧结就能达到致密化,因此特别适用于电子陶瓷的制备。纳米钴粉具有高比表面积、高活性,对外界环境(如温度、光、湿气等)十分敏感,其表面或表面离子价态和电子运输会随外界环境改变迅速发生变化,从而引起电阻的显著改变,这使其在传感器方面得到广泛应用。纳米钴粉的制备有机械粉碎法、化学反应法[9]、物理沉积法、喷雾热解法[10-11]、多元醇法[12]等。化学反应法有液相反应沉积法,这种方法生产条件简单,易于工业化生产,但工艺较复杂,成本和能耗较高,制备方法不够成熟;而液相还原法相对较简单,成本较低[13-14],但用于制备纳米钴粉的研究相对较少。试验以硫酸钴为原料、硼氢化钠为晶核引发剂、水合肼作还原剂、PVP为分散剂,研究了采用液相还原法制备纳米钴粉。
1 试验部分
1.1 试验试剂与设备
试验试剂:硫酸钴(CoSO4·7H2O),水合肼(N2H4·H2O),硼氢化钠(NaBH4),次亚磷酸钠(NaH2PO2),聚乙烯吡咯烷酮(PVP),无水乙醇(CH3CH2OH),氢氧化钠(NaOH),丙酮(CH3COCH3),氨水(NH3·H2O),柠檬酸钠(Na3C6H5O7·2H2O),均为分析纯。
试验设备:电子天平(CP114)、pH计(Starter 2C),奥豪斯仪器(上海)有限公司;电热鼓风干燥箱(DHG-9140A),常州普天仪器制造有限公司;AS系列超声波清洗机(AS10200A),天津奥特赛恩斯仪器有限公司;恒温水浴锅(DZKW-D-2),北京市永光明医疗仪器有限公司;精密增力电动搅拌器(JJ-1),常州国华电器有限公司;真空干燥箱(DZF-6020),常州衡正电子仪器有限公司;X射线衍射仪(DX-2600),丹东方圆仪器有限公司;扫描电子显微镜(VEGA 3 SBU),捷克Tescan公司;高真空原子力显微镜(E-Sweep),日本日立有限公司。
1.2 试验方法
称取4.22 g CoSO4,配制成500 mL(水醇体积比=3∶2)溶液,溶液中Co2+浓度为0.03 mol/L。移取100 mL溶液于500 mL三口烧瓶中,置于恒温水浴锅中加热到40 ℃并搅拌。称取1.69 g PVP(CoSO4质量的40%)于三口烧瓶中,待完全分散后加入含有0.05 g NaBH4的NaOH溶液(NaOH浓度2 mol/L)调节pH为7~11。量取5 mL水合肼(质量分数为80%)移入恒压滴液漏斗中,以1.5 mL/min的速度滴加到反应体系中,滴加完成后反应约20 min,得到灰黑色钴粉粒子。用布氏漏斗抽滤,先用去离子水洗涤4~5次,再用无水乙醇洗涤2次,最后用丙酮洗涤2次。洗涤后,将产物置于真空干燥箱中,在50 ℃下干燥2 h得到产品。
2 试验结果与讨论
2.1 引发剂用量的影响
碱性溶液中,Co2+先与OH-发生反应生成Co(OH)2沉淀。Co(OH)2具有两性,会与过量OH-发生配位反应:

(1)

(2)
水合肼与Co2+的配位化合物发生氧化-还原反应:

(3)
NaBH4引发剂用量对钴粉产率的影响试验结果如图1所示。
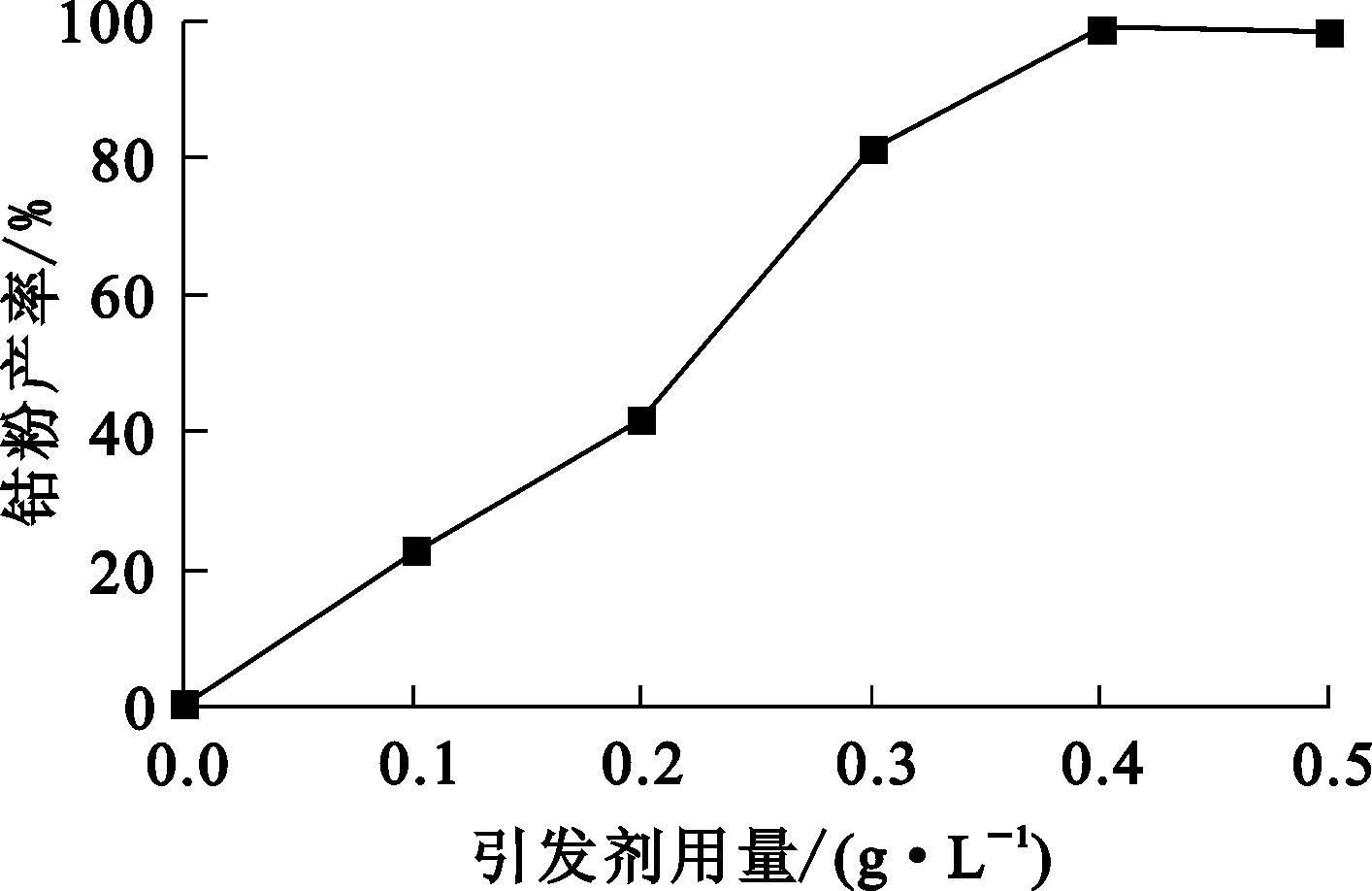
图1 引发剂用量对钴粉产率的影响
由图1看出:随引发剂用量增加,钴粉产率持续提高;引发剂用量为0.4 g/L时,钴粉产率达最高,为98.7%。引发剂用量较少时,由于水合肼的还原作用较弱,无法显著提高初期行核速率,行核数量增加幅度小且少量引发剂被很快耗尽,新生成的细核不但数量少,还失去了引发剂的协同作用,催化效果大大减弱,反应进行得十分缓慢,最终因动力不足而停止,钴粉产率较低。综合考虑,试验确定引发剂最佳用量为0.4 g/L。
2.2 温度的影响
在液相反应体系中,温度很重要。随温度升高,分子自由移动速度加快,促使反应正向进行。图2为不同温度下所得钴粉的形貌。

温度:a—30 ℃;b—35 ℃;c—40 ℃;d—45 ℃;e—50 ℃。
由图2看出:反应温度为30 ℃时,所得钴粉粉末粒径较大,平均约200 nm,颗粒团聚现象较明显;反应温度为35 ℃时(对比图2(a)),粉末分散性更好,粒径减小到160 nm;反应温度为50 ℃时,平均粒径约为120 nm,有少量团聚。随反应温度升高,粉末粒径减小,分散性更好。
反应温度对钴粉产率的影响试验结果如图3所示。可以看出:随温度升高,粉末产率升高;温度超过50 ℃后,产率有所降低。所以,确定温度以40~45 ℃为宜。

图3 温度对钴粉产率的影响
2.3 体系pH的影响
体系pH对钴粉产率的影响试验结果如图4所示。

图4 pH对钴粉产率的影响
由图4看出:pH<10条件下,钴粉产率随pH增大而提高,至pH=10时,钴粉产率达最大98.6%;之后,随pH增大,钴粉产率略有下降。试验中观察到,pH增至12时,体系中存在大量蓝绿色悬浊物,只有少量钴粉产物生成。水合肼的还原能力随pH变化而变化。CoSO4溶液pH约为6时滴加水合肼,无论怎样调节温度和Co2+浓度都没有灰黑色钴粉出现,这也表明水合肼只有在碱性溶液中才具有很强的还原能力。在体系还原过程中,NaOH有两方面作用:一是促使Co2+生成Co(OH)2沉淀;二是保持反应体系呈碱性,让反应正常进行。
在7~11范围内调整pH并观察所得产品形貌,结果如图5所示。试验中观察到,体系pH直接影响水合肼的还原能力:pH越高,水合肼的还原能力越强;但pH=12时,会生成大量绿色和红色沉淀,也就是OH-浓度增大反而会抑制水合肼的还原能力,使它无法将Co(OH)2全部还原出来。

pH:a—7;b—8;c—9;d—10;e—11。
由图5看出:pH=7时,粉末粒径分布极不均匀,最小颗粒粒径约80 nm,最大颗粒粒径约300 nm;pH=8时,粉末颗粒分散性良好,粒径均匀,平均粒径约为160 nm;pH=9时,团聚现象严重,许多小颗粒团聚在一起,团聚体粒径约为600 nm;pH大于10后,粉末粒径较小,分散性较高,粒径约为100 nm。所以,综合考虑,试验确定pH=10为制备纳米钴粉的适宜条件。
2.4 Co2+初始浓度对钴粉粒径的影响
Co2+初始浓度影响反应速度,也影响生成的钴粉颗粒大小。溶液中Co2+浓度较低时,前期反应迅速,反应进行到一定程度后,由于分子间作用减弱,很难再相遇发生碰撞,反应被迫停止;Co2+浓度较高时,由于水合肼的逐滴加入,在前期会因为动力不足而使反应缓慢,后期反应会迅速进行,直到浓度降至无法反应为止。
在温度40 ℃、体系pH=10、NaBH4质量浓度0.04 g/L条件下,Co2+浓度对钴粉产率的影响试验结果如图6所示。Co2+浓度对钴粉颗粒粒径的影响试验结果如图7所示。

图6 Co2+初始浓度对产率的影响
由图6看出:随Co2+初始浓度提高,钴粉产率提高;Co2+初始浓度为0.05 mol/L时,钴粉产率达97.6%。

初始c(Co2+)/(mol·L-1):a—0.01;b—0.02;c—0.03; d—0.04;e—0.05。
由图7看出:Co2+初始浓度为0.01 mol/L时,所得钴粉颗粒明显较大,粒径范围也比较宽,在80~200 nm之间,分散性相对较差;Co2+初始浓度为0.02 mol/L时,所得钴粉粒径减小,粒度分布趋向均匀,粒径在60~140 nm范围内,而且分散性也更明显;Co2+初始浓度大于0.03 mol/L时,所得钴粉颗粒粒径进一步减小,但分散性变差。
对图7中形貌最好的试样d进行原子力形貌表征,结果如图8所示。
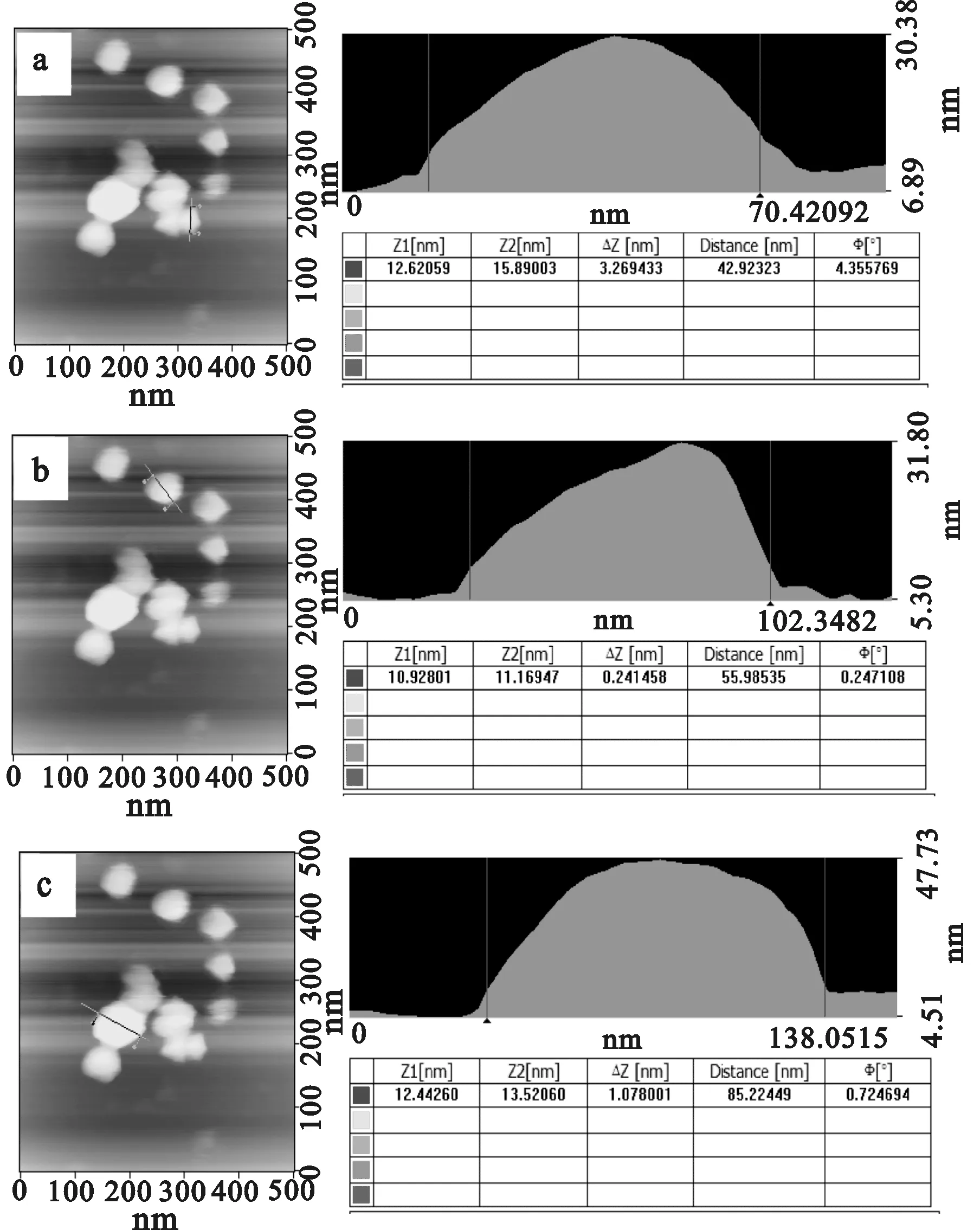
图8 纳米钴粉的AFM形貌
分别选取视场中大、中、小3个粒子进行粒径分析,可以看出,在温度40 ℃、体系pH=9、PVP质量分数为40%、Co2+浓度为0.04 mol/L条件下所得钴粉颗粒粒径在40~90 nm之间,平均粒径约55 nm。
3 结论
采用液相还原法可制备出粒径均匀、分散性好的纳米钴粉,适宜条件下,所得钴粉粒径约为55 nm。在溶液中,NaBH4具有很强的还原能力,能与CoSO4发生剧烈反应,最佳用量为0.4 g/L。温度对钴粉粒径影响较大,以40~45 ℃为宜,超过50 ℃,粉末会出现团聚现象。随体系pH、Co2+浓度提高,钴粉粒径减小,以pH=10、Co2+浓度0.04 mol/L为最佳。
[1] 许并社.纳米材料及应用技术[M].北京:化学工业出版社,2003.
[2] 胡志荣,余焕潮,蒙铭祖,等.含钴元素的纳米材料的进展[J].广州化工,2000,28(4):165-169
[3] 王玉棉,李军强,张亮亮,等.超细钴粉制备工艺及研究进展[J].甘肃冶金,2004,26(3):60-62.
[4] ZHU Y,ZHENG H,YANG Q,et al.Growth of dendritic cobalt nanocrystals at room temperature[J].Journal of Crystal Growth,2004,260(3/4):427-434.
[5] GURMEN S,STOPIC S,FRIEDRICH B,et al.Synthesis of nanosized spherical cobalt powder by ultrasonic spray pyrolysis[J].Materials Research Bulletin,2006,41(10):1882-1890.
[6] 李智渝,韩承辉,沈俭一.溶液中肼还原钴离子制备纳米金属钴的反应动力学[J].化学学报,2006,64(4):295-300.
[7] WON H I,NERSISYAN H H,WON C W.Cobalt powders and porous cobalt particles prepared by co-reduction of hydrazine and sodium phosphate and its formation mechanism[J].Materials Chemistry&Physics,2012,133(1):225-231.
[8] 蒙海宁,赵芳霞,张振忠.纳米钴粉的制备及其在乙醇中的分散性能[J].中南大学学报(自然科学版),2012,43(8):2986-2992.
[9] 郑化桂,曾京辉,梁家和.Fe,Co,Ni纳米粉化学还原制备机理的光谱研究[J].金属学报,1999,35(8):837-840.
[10] 吴琳琳,湛菁,黎昌俊,等.超细钴粉制备的研究进展[J].四川有色金属,2001(2):30-33.
[11] 王占峰,罗崇玲,陈飞.超细钴粉制备工艺的研究进展[J].硬质合金,2008,25(1):63-66.
[12] 罗振勇,刘志宏.金属钴粉的制备及应用[J].粉末冶金工业,2008,18(2):40-45.
[13] 曾青云,赵娟刚,肖婷,等.外场辅助液相法制备红色球形Y2O3:Eu3+荧光粉[J].湿法冶金,2016,35(2):150-153.
[14] 缪新,杨声海,陈永明.液相还原法制备单分散球形超细银粉[J].湿法冶金,2013,32(6):403-406.

