ClC-3氯通道过表达对小鼠甲状腺结构及功能的影响*
谭秋婵, 陈湛如, 俞美声 , 梁协稠, 赵 婵 , 高 宏, 郑衍芳, 伍嘉宝, 朱林燕, 王立伟△, 陈丽新△
(暨南大学基础医学院 1生理学系, 2药理学系, 广东 广州 510632; 3广东省计划生育科学技术研究所, 广东 广州 510600)
甲状腺激素对人体发育以及代谢起着重要的调控作用。碘(I)是甲状腺激素合成不可缺少的原材料,甲状腺含碘量占全身总碘量的90%。碘以碘离子(I-)的形式存在于血液中,I-从血液进入甲状腺合成甲状腺激素经历了一系列转运过程。现已被公认,甲状腺细胞基底膜的碘离子摄取是由钠碘同向转运体(sodium iodide symporter,NIS)特异性介导的[1]。甲状腺激素合成的一个重要环节是I-从甲状腺滤泡上皮细胞流入滤泡腔中参与甲状腺球蛋白碘化,有研究指出,该过程是多种转运体和阴离子通道等共同作用的结果,氯通道也可能参与I-排出的过程[2-3]。
电压门控氯离子通道(voltage-gated chloride channel,ClC) 由CLCN基因编码,ClC-3是ClC家族中的一员,广泛分布于脑、肾、心脏、骨骼肌和腺体组织,在质膜、细胞核和细胞器上都有表达。我们前期对ClC-3氯通道做了一系列研究, 证明该通道受多种因素调控,参与了细胞的容积调节、 周期调节和凋亡等多种生理活动[4-6]。我们在对ClC-3氯通道的研究过程中发现其对阴离子选择性并不高,阴离子通透性大小表现为I->Br->Cl-> 葡萄糖酸根[7-8],提示ClC-3很有可能参与了甲状腺I-的跨膜转运进而影响甲状腺激素的合成与分泌, 但是ClC-3对甲状腺的影响目前还未见报道。 本研究拟构建ClC-3转基因小鼠,探讨ClC-3的表达与甲状腺结构与功能的关系。
材 料 和 方 法
1动物
ClC-3转基因小鼠委托Cyagen Biosciences构建,动物合格编号为TGS120401AH01,小鼠品系为FVB,FVB野生型(wild type,WT)小鼠为本实验对照组小鼠。实验小鼠在SPF级环境中分笼饲养,室温为(22±2)℃,湿度为60%~80%,12 h昼夜交替照明,隔日更换垫料,自由摄食摄水。
2主要试剂
引物由生工生物工程有限公司合成,见表1;Prime ScriptTMRT Reagent Kit购自TaKaRa;2×Tap PCR Master Mix试剂盒购自天根生化科技有限公司;兔抗小鼠ClC-3多克隆抗体购自Abcam;小鼠总三碘甲状腺原氨酸(total triiodothyronine,TT3)、小鼠总甲状腺素(total thyroxine,TT4)和小鼠促甲状腺素(thyrotropin,TSH) ELISA试剂盒均购自Bio-Swamp。
3主要方法
3.1ClC-3转基因小鼠鉴定 剪取3周龄转基因小鼠尾尖0.4 cm~0.6 cm,采用苯酚抽提法提取基因组DNA,行PCR反应扩增ClC-3基因。引物序列见表1。取10 μL PCR产物进行1%的琼脂糖凝胶电泳,凝胶成像系统采集结果。在440 bp出现阳性条带的小鼠分组到ClC-3高表达组中,出现阴性条带的小鼠则舍弃。
3.2标本的采集 对3月龄的WT小鼠和经鉴定为ClC-3高表达的小鼠进行行为学监测,称重后测量肛温,摘取眼球采血后处死。取出甲状腺组织后称重并常规行HE染色观察其结构的变化。
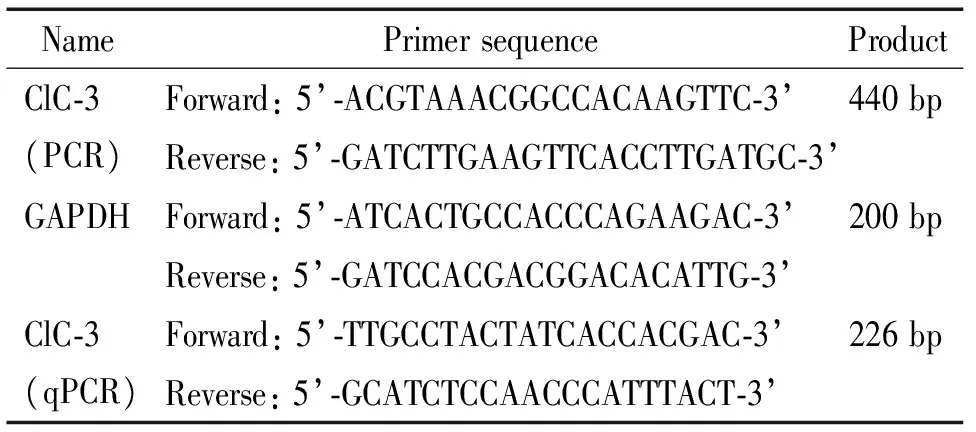
表1 引物序列
3.3qPCR检测甲状腺ClC-3 mRNA的表达 苯酚法提取甲状腺组织总RNA,于微量紫外分光光度计测定RNA的A260/A280,其值在1.9~2.1表明纯度较好。 参照PrimeScriptTMRT reagent Kit说明进行逆转录,参照北京天根公司2×Tap PCR Master Mix试剂盒说明进行qPCR检测。引物序物见表1。
3.4Western blot检测小鼠甲状腺ClC-3蛋白的表达 收集甲状腺组织,按50 g/L 加入RIPA裂解液,冰上匀浆30 min,4℃、 12 000×g离心10 min,取上清,BCA 法进行蛋白定量。制备7% SDS-PAG,电泳分离蛋白,电转移蛋白至PVDF膜上,5%脱脂奶粉封闭2 h,兔抗小鼠ClC-3Ⅰ抗(1∶800) 4℃孵育过夜,辣根过氧化物酶标记的山羊抗兔IgG( 1∶5 000) 37℃孵育1 h,洗涤后于凝胶成像系统采集数据。
3.5免疫荧光技术检测小鼠甲状腺ClC-3的表达和分布 甲状腺组织经多聚甲醛固定,乙醇梯度脱水,石蜡包埋后切片。石蜡切片经60 ℃烘片24 h,二甲苯脱蜡,梯度乙醇复水;0.1 mol/L、pH 6.0的枸橼酸液修复, 0.3 % Triton X-100透膜,10 %绵羊血清封闭;ClC-3Ⅰ抗(1∶50)4℃孵育过夜;Cy3标记的Ⅱ抗(1∶100)室温避光孵育1 h;5 mg/L的DAPI室温下染色5 min;激光共聚焦显微镜下观察。
3.6ELISA法测小鼠TT3、TT4和TSH 摘取小鼠眼球收集血液,室温自然凝固30 min,1 000 ×g离心15 min,收集上清。按Bio-Swamp ELISA试剂盒说明操作,450 nm 波长处依序测量各孔的A值。以标准品的浓度为横坐标,A值为纵坐标绘制标准曲线,根据样品的A值由标准曲线计算出样品浓度。
4统计学处理
用SPSS 20.0统计软件进行分析,数据均采用均数±标准差(mean±SD)表示,组间差异采用t检验方法,以P<0.05为差异有统计学意义。
结 果
1ClC-3转基因小鼠的鉴定
本研究中构建ClC-3转基因小鼠转入质粒为pLV.EX3d.P/neo-EF1A>CLCN3> IRES/eGFP。采用PCR检测鼠尾组织并鉴定。在琼脂糖凝胶上,转基因小鼠会出现440 bp的条带,野生型小鼠则在此不会出现条带,200 bp处显示内参照条带,见图1。
2ClC-3转基因和WT小鼠甲状腺ClC-3的表达差异
通过qPCR和Western blot检测2组小鼠甲状腺中ClC-3的表达情况,发现无论是在mRNA水平还是蛋白水平,ClC-3转基因小鼠ClC-3的表达量都高于野生型小鼠(P<0.05)。通过免疫荧光观察2组小鼠甲状腺ClC-3的表达与分布,结果发现,2组小鼠中均观察到被红色荧光标记的ClC-3,主要分布在甲状腺滤泡上皮细胞的胞膜上,ClC-3转基因鼠表达量明显较高,见图2。
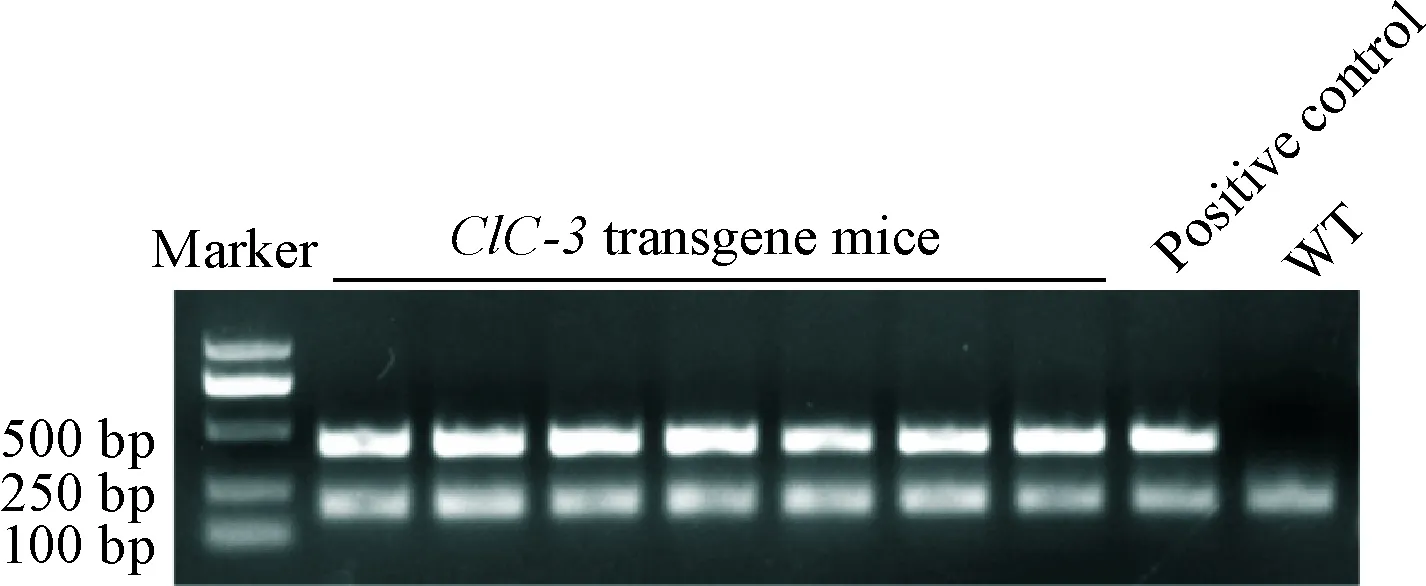
Figure 1. PCR was performed with DNA extracted from the tail of 3-weeks-old FVB mice.
图1PCR鉴定ClC-3高表达小鼠
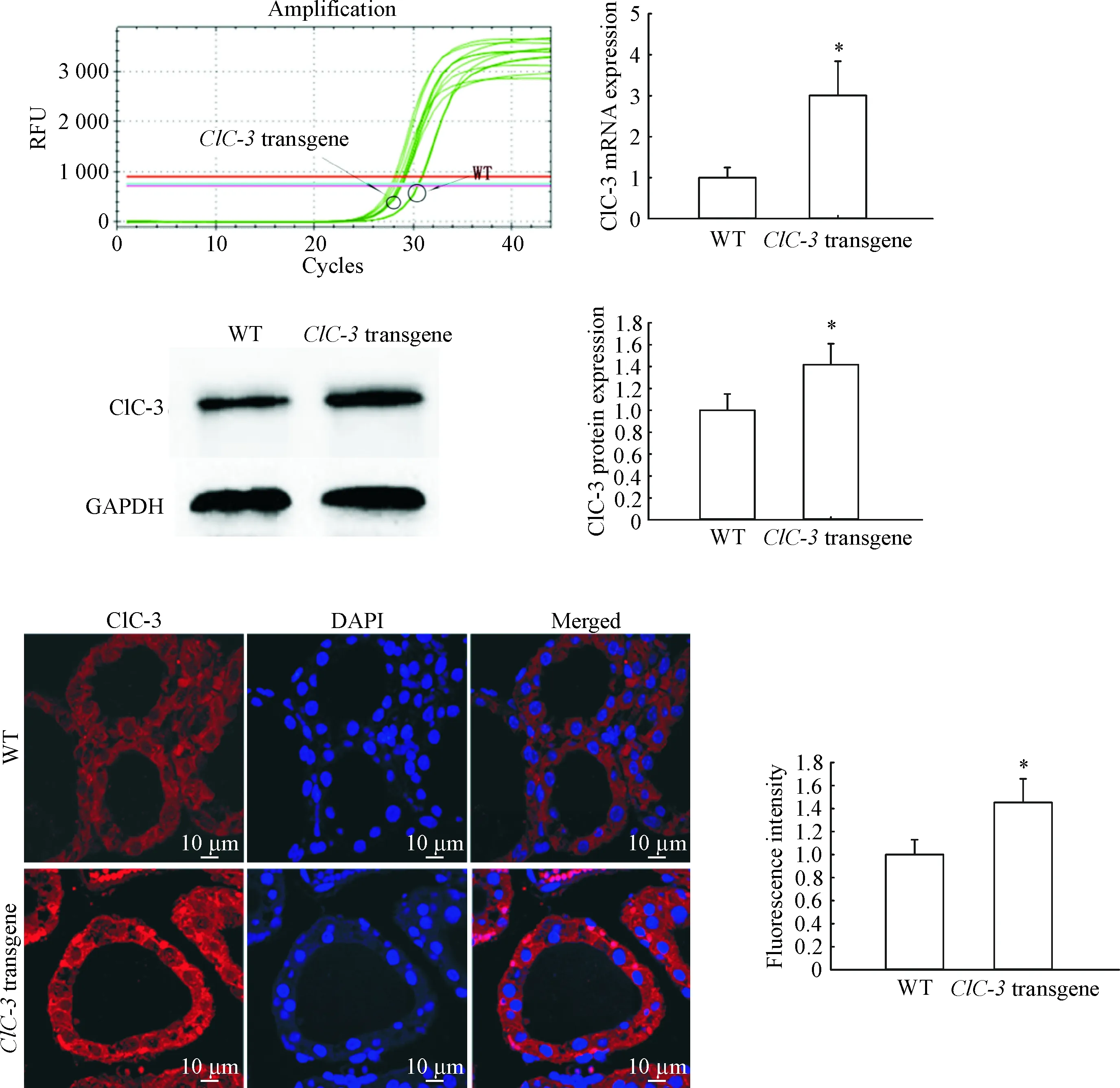
Figure 2. ClC-3 expression and distribution in the thyroid gland from wild type andClC-3 transgene mice. Mean±SD.n=20.*P<0.05vsWT group.
图2野生型和ClC-3转基因小鼠甲状腺ClC-3的表达与分布
3ClC-3转基因小鼠甲状腺形态及结构的改变
大体形态上,ClC-3转基因小鼠甲状腺相比野生型小鼠的更大,组织明显充血,见图3A;称量结果显示,ClC-3转基因小鼠甲状腺重量普遍增加(P<0.05),见图3B。HE染色结果显示, 野生型小鼠甲状腺滤泡上皮细胞多为单层立方或扁平状,甲状腺滤泡腔多为中等大小,滤泡腔内充满红染胶质;而ClC-3转基因小鼠滤泡上皮细胞明显肿大,增生变化明显,细胞呈高柱状改变,甲状腺滤泡腔大小差异较大,部分甲状腺滤泡腔增大,胶质增多,见图3C。统计结果显示,与野生型小鼠甲状腺滤泡腔面积相比,高表达组滤泡腔平均面积明显较大 (P<0.05),见图3D。
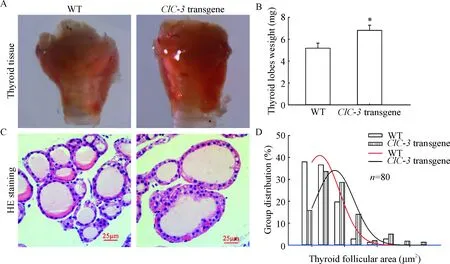
Figure 3. Transgene mice have morphologic and histologic changes in the thyroid gland. Mean±SD.n=20.*P<0.05vsWT group.
图3转基因小鼠甲状腺形态结构的改变
4ClC-3转基因小鼠体重、肛温及行为表现的改变
与野生型小鼠相比,ClC-3转基因小鼠体型略小,体重偏低(P<0.05);肛温较高,但无统计学差异; 摄食量也明显增大(P<0.05),饮水量未见明显差异,见表2。行为学观察发现,大部分ClC-3转基因小鼠活动较频繁、易激怒、好斗、毛须竖起,甚至脱落。总体表现与甲亢高代谢症候群相似。
表2野生型小鼠和ClC-3转基因小鼠体重、肛温、饮水量以及摄食量的测量
Table 2. Detection of weight, anal temperature, water intake and food consumption of WT andClC-3 transgene mice(Mean±SD.n=20)

GroupWeight(g)Analtemperature(℃)Waterintake(mL)Foodconsumption(g)WT28.16±0.6536.35±0.124.37±0.234.59±0.32ClC⁃3transgene25.32±1.03∗36.72±0.214.23±0.316.38±0.58∗
*P<0.05vsWT group.
5ClC-3转基因小鼠血清中的TT3、TT4和TSH的改变
ClC-3转基因小鼠血清中TT3和TT4平均浓度均明显高于野生型小鼠(P<0.05);虽然ClC-3转基因小鼠TSH浓度与野生型小鼠的浓度不具有统计学差异,但ClC-3转基因小鼠TSH浓度有降低的趋势,见图4。
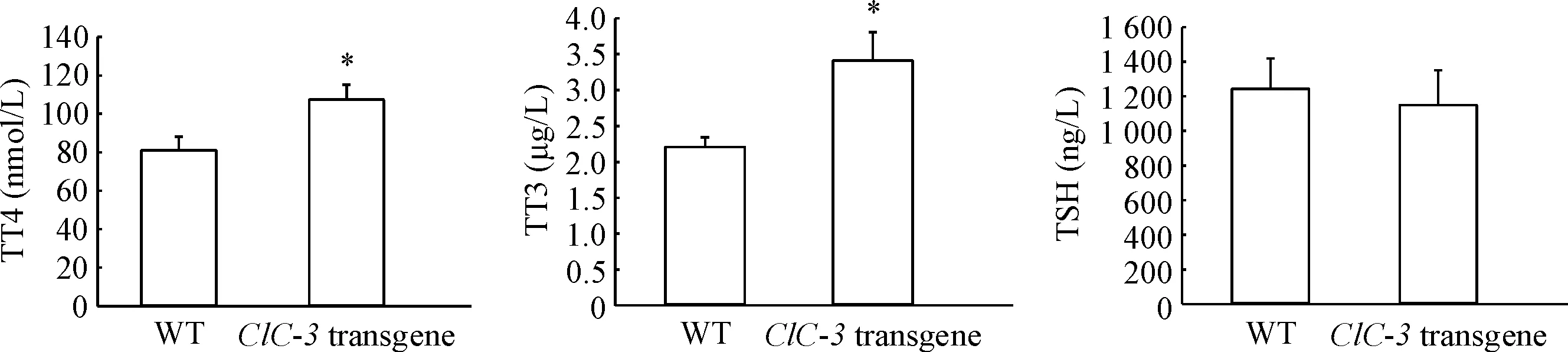
Figure 4. Detection of serum TT4, TT3 and TSH concentrations inClC-3 transgene mice and WT mice. Mean±SD.n=20.*P<0.05vsWT group.
图4野生型和ClC-3转基因小鼠血清中的TT4、TT3和TSH的表达
讨 论
氯通道是体内最主要的阴离子通道,氯通道有多种不同类型,包括钙激活氯通道、囊性纤维化跨膜转运调节因子(cystic fibrosis transmembrane conduc-tance regulator, CFTR)氯通道、电压依赖性氯通道和容积敏感氯通道等,它介导体内最多的阴离子-Cl-顺电-化学梯度被动扩散。氯通道在甲状腺中的作用近来受到重视。CFTR在甲状腺上有表达,并且可能与滤泡增生相关[9],囊性纤维化病人(CFTR基因缺陷)存在亚临床甲状腺功能减退[10]。钙激活性氯通道ANO1主要分布在甲状腺滤泡上皮细胞的顶膜上,可能介导顶膜的I-流出[11]。ClC-5是ClC氯通道家族中的一个亚型,其缺失可导致I-外流延迟,并且可导致TSH和T4正常的甲状腺肿[12]。我们的前期实验发现,人甲状腺细胞表达ClC氯通道家族ClC-1~ClC-7的mRNA中 ClC-3表达最高,是ClC-5的10多倍,那ClC-3是否影响着甲状腺的结构和功能呢?
本课题组在对ClC-3氯通道的研究中发现,当ClC-3通道开放时,产生一个有较明显外向整流、无时间依赖性和电压依赖性失活、对容积改变敏感的氯电流,该通道对I-的通透性大于Cl-, 提示ClC-3很有可能参与了甲状腺I-转运进而影响甲状腺激素合成与分泌。
与WT组小鼠相比,ClC-3转基因组小鼠甲状腺ClC-3表达明显增多,且主要分布在细胞膜上。ClC-3氯通道主要介导阴离子顺着浓度梯度的跨膜转运,尤其是对I-的通透性最为明显,因而我们推测ClC-3很可能参与了细胞内高碘的甲状腺细胞的碘外排。
形态学研究发现,ClC-3转基因小鼠倾向于发生甲状腺增生肥大,滤泡上皮细胞增生肥大,呈高柱状改变,滤泡腔明显增大。这可能是由于ClC-3高表达后,促进了碘的外排,更多的碘离子外排到滤泡腔内,甲状腺球蛋白碘化增多,一方面导致甲状腺细胞中甲状腺球蛋白合成增多,细胞体积增大;另一方面导致大量的碘化甲状腺球蛋白堆积在滤泡腔内,滤泡腔增大,最终导致小鼠甲状腺组织增生肥大。
日常行为表现和体征研究发现,ClC-3转基因小鼠行为表现与甲亢的的高代谢症候群相似。血清总甲状腺素TT3和TT4是判定甲状腺功能最基本的指标。采血测甲状腺激素水平则发现ClC-3过表达组小鼠TT4明显增高,TT3也有增高的趋势,甲状腺分泌功能明显增强。这很可能是因为ClC-3表达增多后,促进碘离子外排到滤泡腔内,促进了甲状腺球蛋白的碘化过程,从而促进了甲状腺激素的合成;研究还发现转基因组小鼠TSH有下降的趋势但并不具有统计学差异。TSH是腺垂体分泌的促进甲状腺生长和机能的激素,一方面受到T3和T4反馈性抑制[13],另一方面受下丘脑分泌的促甲状腺激素释放激素的促进,二者互相拮抗,它们组成下丘脑-腺垂体-甲状腺轴。因此,本研究中TSH的变化不明显,很可能与下丘脑和垂体的功能相关。
综上所述,本研究发现ClC-3过表达可引起小鼠甲状腺组织增生,T3和T4分泌增多;ClC-3过表达小鼠表现类似甲状腺功能亢进的高代谢症状。
[1] Dohan O, De la Vieja A, Paroder V, et al. The sodium/iodide Symporter (NIS): characterization, regulation, and medical significance[J].Endocr Rev, 2003, 24(1):48-77.
[2] Fong P. Thyroid iodide efflux: a team effort?[J]. J Physiol, 2011, 589(Pt 24):5929-5939.
[3] Tang J, Pecka JL, Tan X, et al. Engineered pendrin protein,an anion transporter and molecular motor[J]. J Biol Chem, 2011, 286(35):31014-31021.
[4] 林 娜, 左婉红, 赖周毅, 等.乙醇激活的鼻咽癌细胞氯电流的分子机制[J].中国病理生理杂志, 2014, 30(7):1179-1183.
[5] Xu B, Mao J, Wang L, et al. ClC-3 chloride channels are essential for cell proliferation and cell cycle progression in nasopharyngeal carcinoma cells[J]. Acta Biochim Biophys Sin, 2010, 42(6):370-380.
[6] 叶 东, 邢德刚, 曾 志, 等. 沉默ClC-3氯通道基因对HeLa细胞周期分布的影响[J]. 中国病理生理杂志,2017, 33(2):257-262.
[7] Deng Z, Peng S, Zheng Y, et al. Estradiol activates chloride channels via estrogen receptor-α in the cell membranes of osteoblasts[J]. Am J Physiol Cell Physiol, 2017, 313(2): C162-C172.
[8] Wang L, Ma W, Zhu L, et al.ClC-3 is a candidate of the channel proteins mediating acid-activated chloride currents in nasopharyngeal carcinoma cells[J]. Am J Physiol Cell Physiol, 2012, 303(1):C14-C23.
[9] Li H, Ganta S, Fong P. Altered ion transport by thyroid epithelia fromCFTR(-/-)pigs suggests mechanisms for hypothyroidism in cystic fibrosis[J].Exp Physiol, 2010, 95(12):1132-1144.
[10] Naehrlich L,Dörr HG,Bagheri-Behrouzi A, et al. Iodine deficiency and subclinical hypothyroidism are common in cystic fibrosis patients[J]. J Trace Elem Med Biol, 2013, 27(2):122-125.
[11] Iosco C, Cosentino C, Sirna L, et al. Anoctamin 1 is apically expressed on thyroid follicular cells and contributes to ATP- and calcium-activated iodide efflux[J]. Cell Physiol Biochem, 2014, 34(3):966-980.
[12] van den Hove MF, Croizet-Berger K, Jouret F, et al. The loss of the chloride channel,ClC-5,delays apical iodide efflux and induces a euthyroid goiter in the mouse thyroid gland[J]. Endocrinology, 2006, 147(3):1287-1296.
[13] Hattori N, Ishihara T, Yamagami K, et al. Macro TSH in patients with subclinical hypothyroidism[J]. Clin Endocrinol (Oxf), 2015, 83(6):923-930.

