宁夏甜瓜酒优良酵母菌的筛选及鉴定
张春芝,莫寅斌,江志国,章洋
(宁夏葡萄酒与防沙治沙职业技术学院,宁夏银川750199)
甜瓜(Cucumis melo L.)又称洋香瓜,香瓜等,属葫芦科甜瓜属,是一种世界性的重要水果。其果实汁多而味甜,具有浓郁的香气,并含有大量人体所需的葡萄糖、维生素、有机酸及矿物质;据测定,甜瓜果实干物质含量6%~18.5%,其中总糖含量为4.6%~15.8%(包括葡萄糖2%~3.6%,果糖0.5%~3.6%,蔗糖1%~11.2%);果酸0.054%~0.128%;果胶0.8%~4.5%;纤维素和半纤维素2.6%~6.7%;而且每100克甜瓜中含有维生素C 29 mg~39.1 mg。宁夏得天独厚的光热资源和区位优势,甜瓜产业得到了快速发展,已经成为宁夏中部干旱带的优势特色农业产业。同时也为生产甜瓜酒,丰富酒类产品品种,提高产品的高附加值,奠定了扎实的物质基础[1-2]。
酵母菌是甜瓜酒酿造过程中最重要的微生物,它不但影响发酵速度,也影响着甜瓜酒的品质和风格[3-5]。生产甜瓜酒一般都是利用商业酵母作为发酵菌株[6-7],而选择利用来源于甜瓜的酵母进行甜瓜酒发酵报道不多[8-9]。本研究以自然发酵的甜瓜汁作为分离源进行酵母菌的分离、纯化与鉴定,得到适合酿造甜瓜酒的酵母菌株NT13。并对其酿酒特性进行探索研究,为进一步开展甜瓜酒的应用和开发研究提供理论依据和技术支持。
1 材料与方法
1.1 材料与培养基
1.1.1 样品
选择成熟度好的宁夏黄甜瓜,购自银川市农贸市场。
1.1.2 培养基
酵母膏胨葡萄糖(YPD)培养基:葡萄糖20 g/L、蛋白胨20 g/L、酵母浸粉10 g/L(固体培养基加入琼脂粉20 g/L)。
WL营养琼脂培养基:酵母浸粉0.5%、胰蛋白胨0.5%、葡萄糖5%、磷酸二氢钾0.055%、氯化钾0.042 5%、氯化钙0.012 5%、氯化铁0.000 25%、硫酸镁0.012 5%、硫酸锰0.000 25%、溴甲酚绿0.002 2%、琼脂2%,pH 6.5;121℃灭菌20 min。
氯化三苯基四氮唑(TTC)培养基[10]:由上层培养基与下层培养基组成。其中TTC上层培养基:TTC 0.5 g/L、葡萄糖5 g/L、琼脂15 g/L、现配现用;TTC下层培养基:葡萄糖10 g/L、蛋白胨2 g/L、酵母膏1.5 g/L、磷酸氢二钾1 g/L、硫酸镁0.4 g/L、柠檬酸0.3 g/L、琼脂30 g/L。
甜瓜汁培养基:以甜瓜为原料制备的清汁,糖度为 18°Brix,100℃灭菌 10 min。
1.2 仪器与设备
T6新悦-可见分光光度计:北京普析通用仪器有限责任公司;H.B11.600-S-Ⅱ型电热恒温培养箱:上海跃进医疗器械厂;pHS-3C酸度计:上海虹益仪器厂;手持糖度计:上海米青科实业有限公司;SW-CJ-1FD型单人单面洁净工作台:苏洁净化设备有限公司;DYCP-31DN DNA电泳槽:北京六一仪器厂;FR980凝胶成像仪:上海复日科技仪器有限公司;2720 thermal cycler PCR仪:Applied Biosystems公司;HC-2518R冷冻高速离心机:BBI公司;SP10-1000 Surf系列精密单道可调移液器:上海生工生物工程(上海)股份有限公司。
1.3 试验方法
1.3.1 酵母菌的分离
取新鲜成熟度好的甜瓜,带皮剁碎,称取100 g装入500 mL无菌三角瓶中,用无菌纱布盖住瓶口,28℃培养2 d~3 d,待发酵醪液出现发泡现象后即可分离。将上述发酵醪液适当稀释,取0.2 mL涂布于YPD培养基上,每个梯度做3个平行,28℃培养2 d~3 d。长出菌落后,挑取具有典型酵母菌菌落特征的单菌落采用划线分离法进一步纯化。将纯化后的酵母菌种置于4℃冰箱保藏。
1.3.2 酵母菌的初筛
将分离纯化后的酵母菌株以划线分离的方式接种到WL营养培养基进行酿酒酵母的筛选,置于28℃恒温培养箱中培养3 d~5 d后,观察菌落特征。
1.3.3 酵母菌的复筛
一级复筛:TTC显色法对初筛得到的酵母菌株的产酒精能力进行测定[11]。挑取红色菌落进行二级筛选。
二级复筛:利用杜氏管发酵法[12],在同等条件下,将一级筛选得到的菌株进行活化,以10%的接种量接入附有杜氏小管的甜瓜汁培养基中,置于25℃恒温培养箱中静置培养48 h,每隔12 h观察并记录杜氏小管中产气情况。选取起酵速度快且发酵能力强的菌株进入三级筛选。
三级复筛:将二级筛选的菌株继续培养1 d,由5位有品尝经验的教师组成的品评小组对发酵液进行感官评定酒的风味(色泽、香气等)。
1.3.4 菌株的生理生化特性试验
1.3.4.1 糖发酵鉴定[13]
分别用葡萄糖、蔗糖、麦芽糖、乳糖、半乳糖、核糖、棉子糖进行糖发酵试验,菌株作3个重复。
1.3.4.2 同化碳源试验[13]
分别用D-半乳糖、蔗糖、麦芽糖、D-木糖、纤维二糖、海藻糖、D-核糖、柠檬酸、乳糖、L-鼠李糖、肌醇、D-甘露糖、山梨醇、菊糖代替YPD培养基中的葡萄糖,菌株作3个重复。
1.3.5 菌株耐受性测定[14-15]
采用杜氏管发酵法,将筛选得到的菌株活化后分别以5%的接种量接种到不同含糖量(250、280、310、340、370、400、420 g/L)、不同乙醇含量(10%、12%、14%、15%、16%、17%和18%)、不同pH值(3.73、3.37、3.08、2.96、2.87、2.80 和 2.74)、不同 SO2浓度(120、160、200、230、250、280、300 mg/L) 的 10 mL 附有杜氏小管的灭菌甜瓜汁中,置于25℃恒温培养箱中静置培养3 d,观察杜氏小管中气体的高度,以未做处理的甜瓜汁培养基作对照。
1.3.6 酵母菌性质实验
1.3.6.1 菌株的产乙醇能力
甜瓜汁发酵法:将筛选得到的酵母菌株活化,以6%的接种量接种到200 mL灭菌甜瓜汁中,于25℃恒温培养箱中静置培养5 d,采用密度瓶法测定其乙醇体积分数[16]。
1.3.6.2 菌株的生长曲线测定[17]
将筛选得到的酵母菌株接种到灭菌的YPD液体培养基中,于25℃恒温培养箱中静置培养48 h,观察菌株的生产情况,前期间隔2 h取样,后期间隔12 h取样,用可见分光光度计在560 nm波长处测定吸光度,重复3次,绘制菌株的生长曲线。
1.3.7 酵母菌的分子生物学鉴定
采用26S rDNA D1/D2区序列分析对筛选出的酵母菌株进行分子生物学鉴定[17]。将菌株平板送生工生物工程(上海)股份有限公司测序。将测定的基因序列与GenBank数据库中区域序列进行BLAST比对,分析该菌株的分类地位。
2 结果与分析
2.1 酵母菌的分离
经初步分离,共得到56株具有典型酵母菌菌落特征的菌株,分别记号为NT1~NT56。
2.2 酵母菌的初筛
通过WL营养琼脂培养基的初步筛选,挑取菌落颜色为奶油色至绿色,球形突起,表面光滑,不透明,奶油状的单菌落,共筛选出23株。
2.3 酵母菌的复筛
2.3.1 一级筛选
通过TTC显色反应筛选出9株菌落颜色为红色或深红色的菌株 (图 1),分别为 NT4、NT6、NT11、NT13、NT17、NT29、NT34、NT42、NT45,说明产酒精能力强。
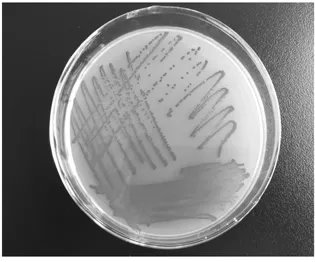
图1 TTC显色反应结果Fig.1 Yeast strain cultured in TTC chromogenic medium
2.3.2 二级筛选
将9株一级筛选的菌株接种到附有杜氏小管的甜瓜汁培养基中,置于28℃恒温培养箱中静置培养48 h,观察产气情况,结果见表1。
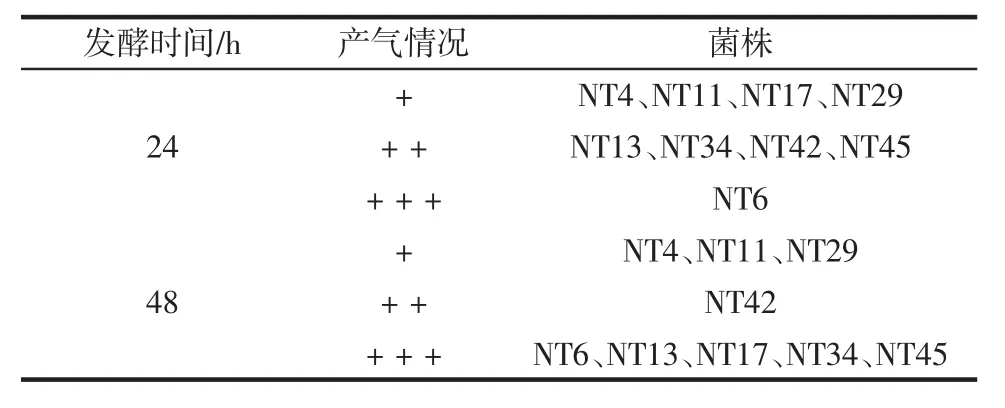
表1 酵母菌的杜氏小管产气情况Table 1 The produce gas of 9 yeast strains
由表1可知,有5株酵母产气充满杜氏小管,并能闻到淡淡的酒香,说明这些菌株具有较强的起酵能力和发酵力。
2.3.3 三级筛选
将5株二级筛选的菌株继续培养1 d,进行感官评定,结果见表2。

表2 5株酵母菌株发酵甜瓜酒的感官评定Table 2 The sensory evaluation of 5 yeast strains fermented melon wine
经过综合评定,NT13菌株发酵的甜瓜酒,色泽金黄,酒香浓郁,果香典型性强,适合作为甜瓜酒发酵菌种。
2.4 菌株生理生化鉴定
将NT13菌株进行进一步生理生化鉴定,结果见表3。
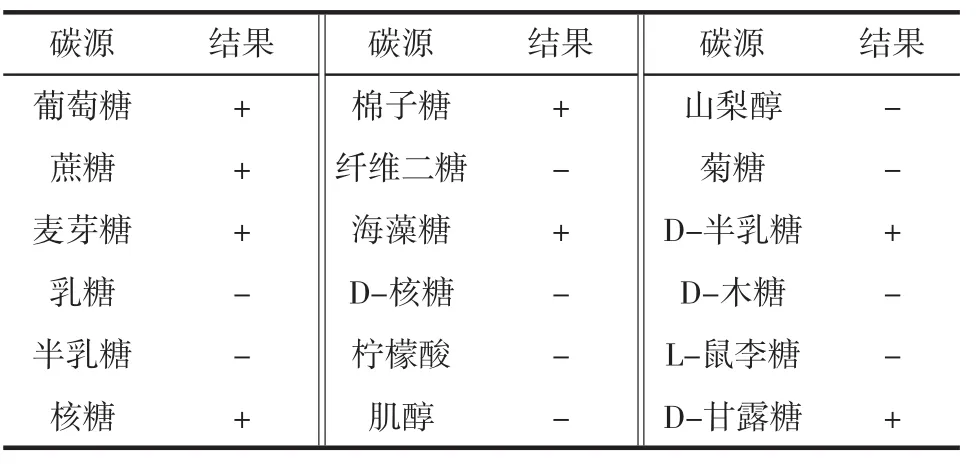
表3 酵母NT13菌株利用碳源试验Table 3 The carbon sources tested of NT13
根据表3的试验结果,对比《真菌鉴定手册》初步判断NT13菌株为酵母属的酿酒酵母(Saccharomyces cerevisiae)。
2.5 NT13菌株耐受性测定
2.5.1 耐糖量测定
试管中加入10 mL完全溶解的不同糖浓度的甜瓜汁培养基,灭菌后以5%的接种量接入NT13菌株,置于25℃恒温培养箱中静置培养3 d,观察杜氏小管的产气高度,结果见表4。
由表4可知,NT13菌株在含糖量为40%左右,可以良好地生长,且香气较好,符合果酒酵母的要求。
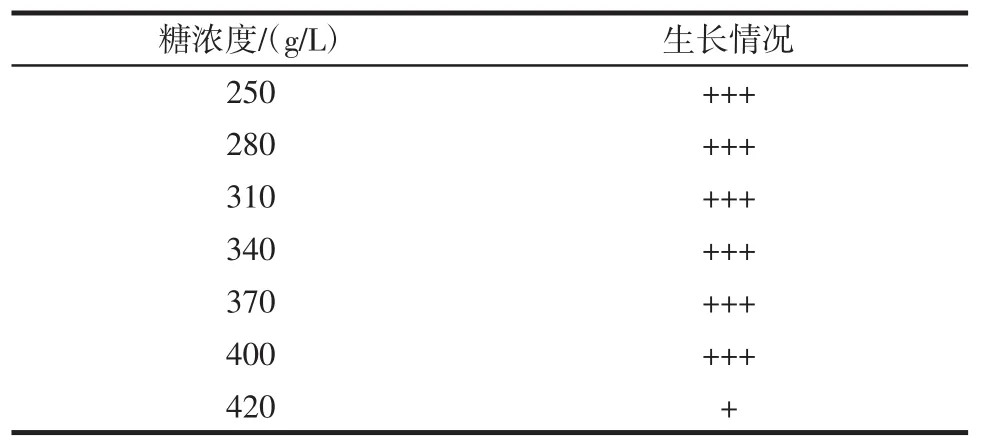
表4 NT13菌株在不同糖浓度下的生长情况Table 4 The effects of different sugar content to NT13
2.5.2 耐酒精测定
试管中加入10 mL甜瓜汁培养基,灭菌冷却后分别加入食用酒精,摇匀后以5%的接种量接入NT13菌株,置于25℃恒温培养箱中静置培养3 d,观察杜氏小管的产气高度,结果见表5。

表5 NT13菌株在不同乙醇体积分数下的生长情况Table 5 The effects of different alcohol content to NT13
由表5可知,NT13菌株可以耐受17%vol的乙醇,符合一般发酵果酒10%vol~14%vol的乙醇含量的要求。
2.5.3 耐pH值测定
试管中加入10 mL以柠檬酸调整pH值后的甜瓜汁培养基,灭菌冷却后以5%的接种量接入NT13菌株,置于25℃恒温培养箱中静置培养3 d,观察杜氏小管的产气高度,结果见表6。

表6 NT13菌株在不同pH值下的生长情况Table 6 The effects of different pH to NT13
由表6可知,NT13菌株能够在pH2.74的条件下存活,说明其耐酸能力可以达到果酒酿造要求。
2.5.4 耐SO2测定
试管中加入10 mL甜瓜汁培养基,灭菌冷却后分别加入亚硫酸,摇匀后以5%的接种量接入NT13菌株,置于25℃恒温培养箱中静置培养3 d,观察杜氏小管的产气高度,结果见表7。

表7 NT13菌株在不同质量浓度SO2下的生长情况Table 7 The effects of different SO2concentrations to NT13
表7可知,NT13菌株有较强的SO2耐受能力,符合国标中对于果酒中SO2的最大残留量250 mg/L的要求。试验证明其在250 mg/L的条件下依然有较好的香气。
2.6 NT13菌株性质试验
2.6.1 产乙醇能力
根据GB 5009.225-2016《食品安全国家标准酒中乙醇浓度的测定》酒精度的测定方法,采用第一法即密度瓶法进行测定,结果见表8。
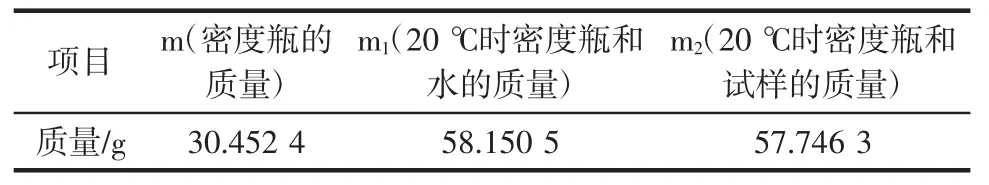
表8 NT13菌株产乙醇能力Table 8 The ethanol yield of NT13
将试验结果代入计算公式,查附录A后可得出NT13菌株产乙醇约为10.9%vol。
2.6.2 生长曲线测定
NT13菌株的生长曲线见图2。
由图2可见,培养2 h后NT13菌株大量生长繁殖,菌量以指数级增加,10 h后达到最高值,之后趋于稳定。这与文献有关酵母生长曲线的报道一致[18]。
2.7 NT13菌株的分子生物学鉴定
2.7.1 NT13菌株的26S rDNA D1/D2区鉴定结果
NT13菌株PCR产物琼脂糖电泳图见图3,NT13菌株的26S rDNA D1/D2区鉴定结果见表9。
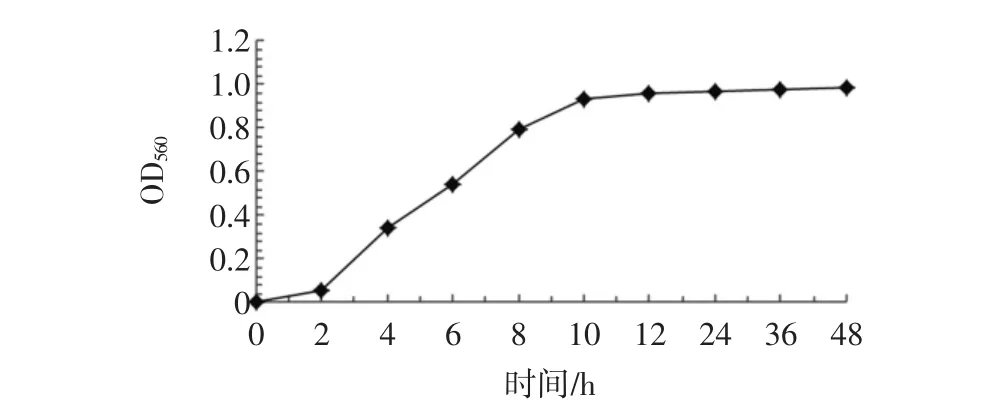
图2 NT13菌株的生长曲线Fig.2 The microbial growth curve of yeast NT13
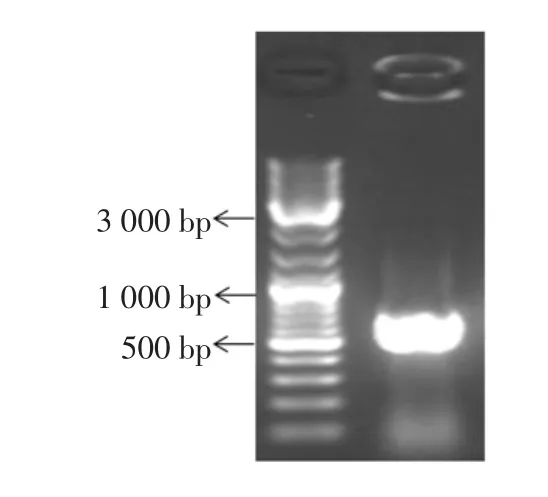
图3 NT13菌株PCR产物琼脂糖电泳图Fig.3 PCR products by agaros electrophoresis of yeast NT13
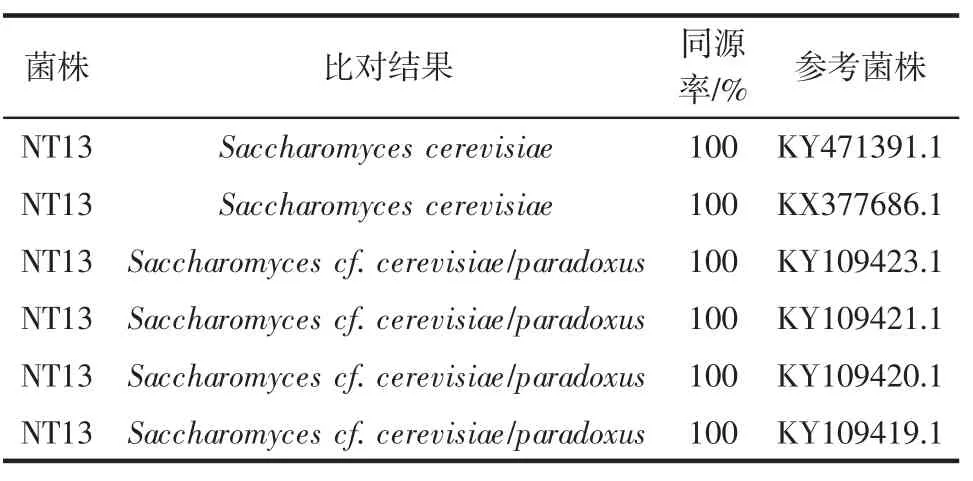
表9 NT13菌株的26S rDNA D1/D2区鉴定结果Table 9 Identification result based on 26S rDNA D1/D2 of NT13
如图3所示,NT13菌株的26S rDNA序列长度为594 bp。经基因测序,在NCBI网站上进行BLAST序列比对(表9),结果表明NT13与酵母属酿酒酵母Saccharomyces cerevisiae相似性为100%,故将其鉴定为酵母属酿酒酵母。
3 结论
本试验从宁夏黄甜瓜自然发酵醪中分离筛选出1株优良酵母菌,该菌株产酒精能力和发酵能力强。经感官鉴定,产果香酒香浓郁,典型性强。耐受实验结果表明其能够耐受40%的含糖量、18%的乙醇和300 mg/L的SO2含量,能够在pH2.74的酸性条件下良好生长。通过密度瓶法测其能够自然发酵产乙醇约为10.9%vol,生长曲线测定实验表明菌量在2 h后以指数级增加,10 h后趋于稳定。经生理生化鉴定及26S rDNA D1/D2鉴定为酵母属酿酒酵母。以上试验结果表明,NT13菌株符合一般果酒发酵的要求,可以应用于甜瓜酒的酿造。但有关该酵母菌的发酵工艺特性还有待于进一步研究。
[1] 江志国,张春芝.银川平原甜瓜种植气候条件分析初探[J].现代农业,2011(7):76-78
[2] 倪志婧,马文平.甜瓜果酒酿造工艺研究[J].安徽农业科学,2011,39(11):6534-6535
[3] 曹倩雯,郑飞云,赵佳迪,等.桑葚果酒专用酵母的分离、筛选及鉴定[J].食品与发酵工业,2017(3):94-98
[4] 张大为,张洁,高健,等.柑橘酒酿造酵母的筛选及鉴定[J].酿酒科技,2016(7):42-46
[5] 李丹,严红光,袁亮.蓝莓果酒专用酵母的筛选、鉴定与性能研究[J].食品与发酵科技,2015(5):75-79
[6] 杨婷,祝霞,赵宾宾,等.不同酿酒酵母对甜瓜酒香气品质的影响分析[J].食品科学,2015,36(14):145-150
[7] 韩琛,雷静,王婷.优质哈密瓜酒酿造工艺的研究[J].酿酒科技,2016(8):97-99
[8] 李晓华.3株哈密瓜酒酵母的分子生物学鉴定[J].中国酿造,2013,32(2):73-76
[9] 傅力,章运,郑灿龙.哈密瓜酒酵母的筛选及哈密瓜酒酿造工艺初探[J].食品工业科技,2004(12):80-82
[10]王梅,张澎湃,帅桂兰.TTC在黄酒酵母选育中的应用[J].酿酒,2001,28(5):62-64
[11]岑涛,岳田利,袁亚宏,等.云南芒果中酵母分离鉴定及芒果酒发酵应用[J].食品科学,2015,36(11):119-124
[12]伍鹤,李珂,赵琳,等.蓝莓果酒专用酵母的分离、筛选及鉴定[J].食品与发酵工业,2014(12):56-60
[13]李宝坤,毛晓英,陈俊,等.自然发酵哈密瓜果汁中酵母分离与鉴定[J].酿酒,2009(1):41-43
[14]杜晶,余培斌,苏琪,等.杨梅果酒酿造酵母的筛选、鉴定及耐受性研究[J].食品与发酵工业,2015(9):34-39
[15]阎贺静,时月,刘畅,等.玫瑰香干红葡萄酒自然发酵过程中优势酵母分离鉴定及其应用潜力分析[J/OL].食品科学:1-11.(2017-03-03)[2017-7-10].http://kns.cnki.net/KCMS/detail/11.2206.TS.20170303.1353.024.html
[16]GB 5009.225-2016《食品安全国家标准酒中乙醇浓度的测定》
[17]郝瑶,王陶,李文,等.富硒猕猴桃果酒酵母的筛选及鉴定[J].食品科学,2014(21):175-179
[18]REGODÓDÓN J A,PÉREZ F,VALDÉS M,et al.A simple and effective procedure for selection of wine yeast strains[J].FoodMicrobiology,1997(14):247-254.DOI:10.1006/fmic.1996.0091

