RF-LAMP技术检测鸡肉中小肠结肠炎耶尔森氏菌
张蕴哲,杨倩,马晓燕,杨澜,张伟,,*
(1.河北农业大学食品科技学院,河北保定071000;2.河北农业大学理工学院,河北沧州061100)
小肠结肠炎耶尔森氏菌(Yersinia enterocolitica,Y.enterocolitica)作为一种食源性的病原菌,是革兰氏阴性菌,不产芽孢,菌体外无荚膜,菌体周围有周鞭毛生长[1]。该菌广泛存在于各种动物的体内,动物可长期携带该菌并通过粪便排出,进而引起食品的污染[2]。Y.enterocolitica是一种嗜冷菌,在0℃也可存活并缓慢生长。在冷藏过程中可能被Y.enterocolitica污染的肉制品,会增加家中儿童与该菌直接接触的概率[2-3]。由肉制品感染给儿童的过程是亚洲人群感染耶氏菌的主要途径[4]。因此,建立一种高效、快速的检测食品中小肠结肠炎耶尔森氏菌的方法,对于保障人类健康和食品安全显得尤为迫切。
目前国内检测Y.enterocolitica的方法以传统生化培养方法为主,该种方法操作复杂、耗时长,不能满足快速检测的需求[5]。快速检测Y.enterocolitica的方法有免疫学检测方法和分子生物学检测方法等。其中,分子生物学检测方法包括聚合酶链式反应(Polymerase chain reaction,PCR)[6]、实时荧光 PCR[7-8]、环介导等温扩增(Loop mediated isothermal amplification,LAMP)[5]、滚环扩增(Rolling circle amplification,RCA)[9]等方法。PCR方法快速、灵敏,但结果的判定需要进行繁琐的电泳,不利于在基层检测机构普及。
LAMP反应在具有链置换活性的DNA聚合酶催化下[10],于恒温条件中短时间即可完成靶基因的高效扩增,在微生物检测领域有广泛的应用。本研究在LAMP技术的基础上,将荧光染料SYBR GreenⅠ加入反应体系。通过实时荧光监测仪对荧光信号强度的搜集,实现实时定性检测,建立实时荧光环介导等温扩增技术(Real-time fluorescence loop-mediated isothermal amplification,RF-LAMP)检测小肠结肠炎耶尔森氏菌的方法。
1 材料与方法
1.1 材料
1.1.1 菌株
本试验所用菌株见表1。
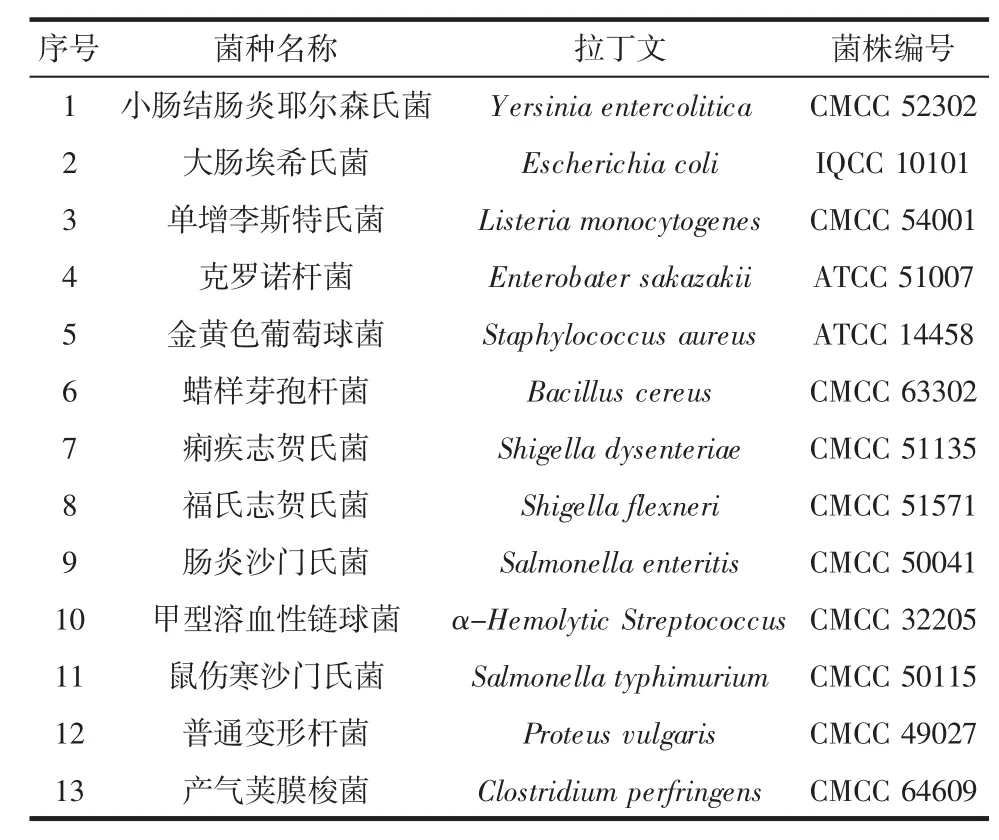
表1 试验用菌种Table 1 Bacterial strains used in this study
1.1.2 样品
鸡肉:保定市某超市。
1.1.3 主要培养基和试剂
营养肉汤、营养琼脂、LB液体培养基和LB固体培养基:北京陆桥技术股份有限公司。Bst DNA聚合酶、限制性内切酶TaqⅠ、MgCl2和dNTPs:大连宝生物工程有限公司;甜菜碱和荧光试剂:Sigma公司;实时荧光LAMP内、外引物合成于大连宝生物工程有限公司;DNA凝胶回收试剂盒、质粒DNA大量提取试剂盒:北京华大基因科技股份有限公司。
1.1.4 主要仪器
数显超级恒温水浴锅:金坛市杰瑞尔电器有限公司;DH6000AB型电热恒温培养箱:天津市泰斯特仪器有限公司;实时荧光监测仪:德国ESE Gmbh公司;DYY-10C型电泳仪:北京市六一仪器厂;UVI pro凝胶成像系统:英国UVITEC公司;QYC-200全温摇床:上海新苗医疗器械制造有限公司;TGL-16G离心机:上海安亭科学仪器厂;Whatman T Gradient PCR扩增仪:德国Biometra公司。
1.2 方法
1.2.1 纯菌的培养
取保藏的 Y.enterocolitica(CMCC 52302)接种于灭菌的LB液体培养基中,28℃振荡培养过夜。
1.2.2 DNA模板的制备
采用热裂解法进行DNA模板的提取。
1)取过夜培养的菌悬液1.5 mL于灭菌离心管中,11 000 r/m离心1 min,将上清液弃去。
2)用100 μL灭菌水将菌体沉淀洗涤2次,然后再加入灭菌水100 μL,振荡使菌体充分悬浮。
3)在沸水浴中将菌悬液煮沸10 min,取出离心,11 000 r/min离心1 min,将上清液转移至另一新的灭菌离心管中,保存在-20℃,备用。
1.2.3 引物设计
引物设计的好坏直接影响反应的特异性和扩增效率[11]。对Genebank中已经公布的小肠结肠炎耶尔森氏菌ail基因的序列进行同源性对比分析(基因号为AY004311.1)。针对Y.enterocolitica的保守序列利用在线设计软件(http://primerexplorer.jp/elamp4.0.0/index.html)设计引物,最终确定的引物包括2条外引物(F3和B3)和2条内引物(FIP和BIP),引物信息如表2所示。
1.2.4 实时荧光LAMP反应体系
外引物F3和B3为0.5 μmol/L、内引物FIP和BIP为 3 μmol/L、dNTPs添加量为 2.5 μL、甜菜碱 1 mmol/L、MgSO4为 0.5 mmol/L、Bst DNA 聚合酶添加量为 1 μL、10×Bst DNA聚合酶缓冲液添加量为2.0 μL、模板DNA 1 μL、荧光染料 0.5 μL,无菌双蒸水补足体积至 25 μL。扩增反应条件:62℃、60 min。
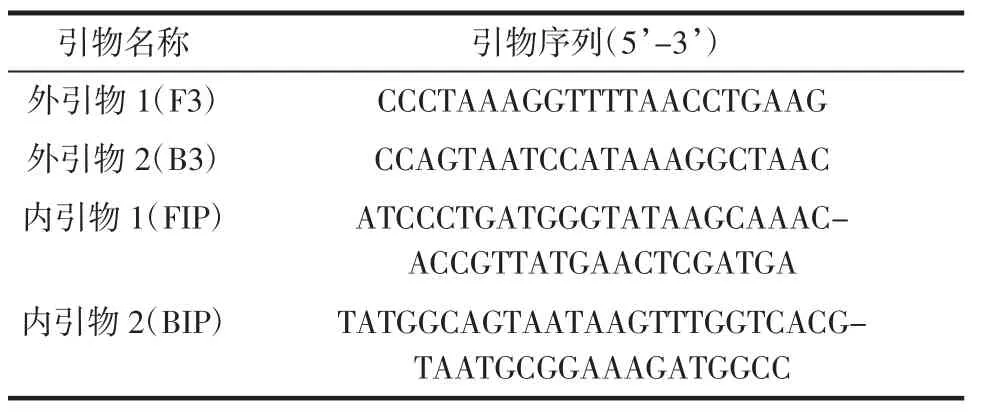
表2 实时荧光LAMP所用引物Table 2 Primers used in RF-LAMP
1.2.5 酶切分析实时荧光LAMP反应产物
对实时荧光LAMP产物进行酶切分析,用于验证其产物的特异性[12]。具体反应体系如下:LAMP扩增产物为5 μL,Taq I buffer(10×)为2 μL,Taq I限制性内切酶为2 μL,无菌双蒸水补足体积至20 μL,轻轻混匀然后离心,37℃下保存1 h~16 h。酶切产物进行3.0%琼脂糖凝胶电泳,观察并分析结果。
1.2.6 实时荧光LAMP的特异性
对表1所列特异性试验菌株采用热裂解法进行基因组DNA的提取,阴性对照以无菌双蒸水作为模板。按照前述建立的实时荧光LAMP反应体系及程序进行反应,扩增后取5 μL扩增产物进行1.5%琼脂糖凝胶电泳分析,以验证实时荧光LAMP引物的特异性。
1.2.7 实时荧光LAMP检测纯菌的灵敏度
用灭菌的生理盐水对过夜培养的Y.enterocolitica菌液进行10倍系列梯度稀释。将稀释的菌液涂板计数,以确定其纯培养物的活菌数。此外,每个稀释度的菌液分别吸取1 mL,12 000 r/min离心1 min,弃去上清液,用1 mL生理盐水将菌体沉淀悬浮,采用热裂解法提取基因组DNA,进行实时荧光LAMP反应,以确定实时荧光LAMP反应的灵敏度。
1.2.8 实时荧光LAMP检测人工污染鸡肉的检出限
在对鸡肉进行Y.enterocolitica的人工污染前,按照国标法GB/T 4789.8-2016《食品微生物学检验——小肠结肠炎耶尔森氏菌检验》对鸡肉进行检测,确定鸡肉中是没有Y.enterocolitica存在的。取25 g均质的鸡肉,加入225 mL灭菌生理盐水,制成鸡肉匀浆液。用灭菌的生理盐水对匀浆液进行10倍系列梯度稀释,采用热裂解法对每个稀释度进行Y.enterocolitica基因组DNA的提取,用于实时荧光LAMP检出限的测定。
2 结果与分析
2.1 酶切分析实时荧光LAMP反应产物
实时荧光LAMP反应产物是按照一定的方式生成的,通过酶切反应将反应产物的大小单一化,进而可以确定扩增是否准确[13]。本研究利用TaqⅠ限制性内切酶,主要产生143 bp和197 bp的DNA片段。酶切结果如图1所示,片段大小与理论值相符。
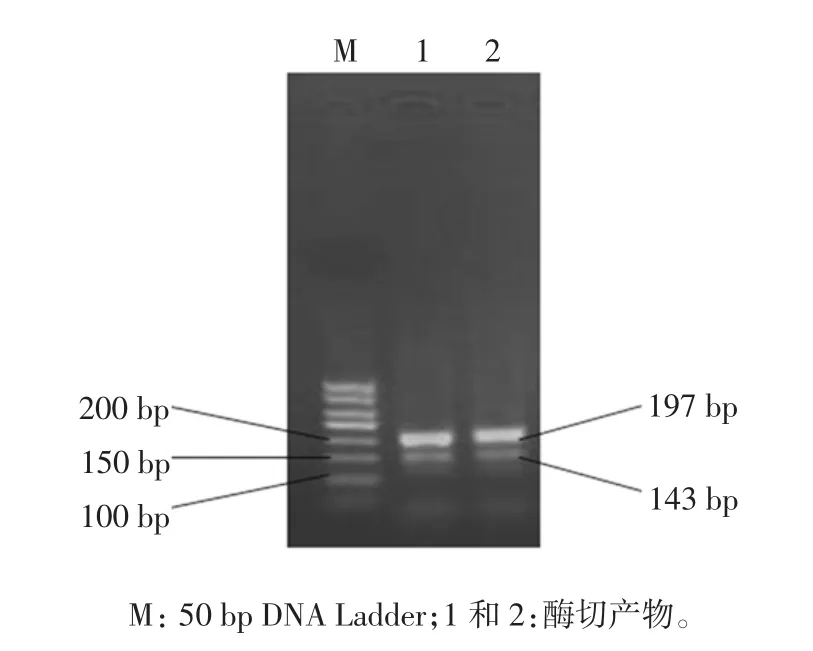
图1 实时荧光LAMP扩增产物酶切分析Fig.1 Restriction analysis of the RF-LAMP products
2.2 实时荧光LAMP的特异性
实时荧光LAMP的特异性试验见图2。
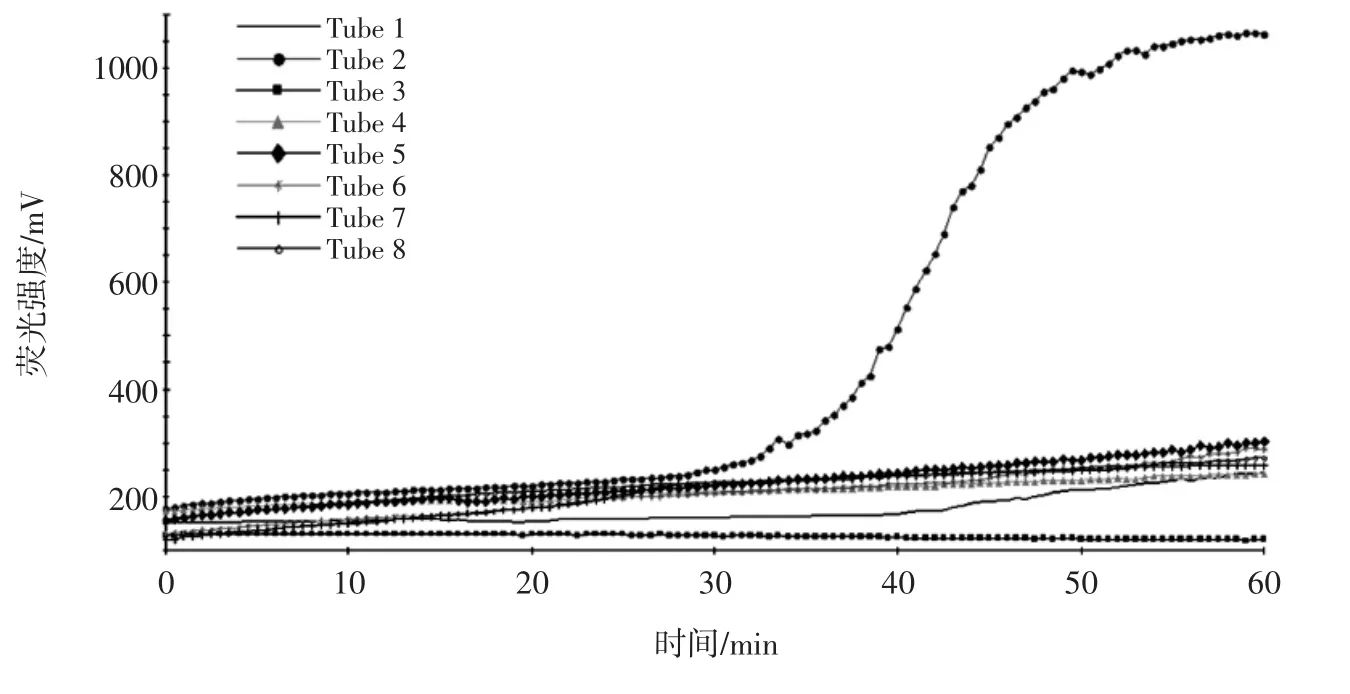

图2 实时荧光LAMP的特异性试验Fig.2 The specificity test of RF-LAMP
从图2中可以看出,用于实时荧光LAMP特异性试验的13株试验菌株中,1株Y.enterocolitica有明显的扩增峰出现,仪器自动判定为阳性;其他12株非Y.enterocolitica菌检测均未出现扩增峰,判定为阴性。表明本研究建立的方法特异性强。
2.3 实时荧光LAMP检测纯菌的灵敏度
实时荧光LAMP反应的灵敏度试验见图3。
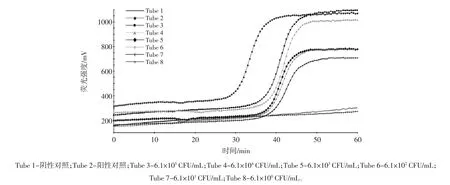
图3 实时荧光LAMP反应的灵敏度试验Fig.3 Sensitivity test using RF-LAMP
如图3所示,当Y.enterocolitica纯培养物浓度为6.1×105CFU/mL~6.1×101CFU/mL 时,荧光曲线出现明显的扩增峰,仪器自动判定为阳性;当浓度为6.1×100CFU/mL时,荧光曲线平缓,未出现扩增峰,判定为阴性。因此,本研究所建立实时荧光LAMP检测Y.enterocolitica的灵敏度为61 CFU/mL。
2.4 实时荧光LAMP检测人工污染鸡肉的检出限
由平板菌落计数可知人为污染的鸡肉样品中Y.enterocolitica的初始浓度为4.6×107CFU/g。本研究采用热裂解法对人工污染的鸡肉进行Y.enterocolitica基因组DNA的提取,采用实时荧光LAMP检测人工污染鸡肉中的Y.enterocolitica见图4。
从图4中可以看出,当Y.enterocolitica纯培养物浓度为4.6×105CFU/g~4.6×101CFU/g时,荧光曲线出现明显的扩增峰,仪器自动判定为阳性;当浓度为4.6×100CFU/g时,荧光曲线平缓,未出现扩增峰,判定为阴性。因此,本研究所建立实时荧光LAMP检测人工污染鸡肉的检出限为46 CFU/g。
3 讨论
Y.enterocolitica致病性比较强,人感染后可引起肠胃炎、呼吸系统、心血管系统等疾病,甚至引起急性阑尾炎、败血症[14-15],因此,建立灵敏、快速检测Y.enterocolitica的方法对于该菌的溯源和控制具有重要的现实意义。目前,Y.enterocolitica的传统检测方法主要以国家标准为依据,该方法的检测周期在5 d~7 d左右,存在着检验周期长,工作量大,灵敏度低等缺点[16],不能满足日益增长的检测需求。近年来,随着分子生物学的不断发展,人们建立了多种快速检测方法,如PCR法、实时定量PCR法、LAMP方法、RCA方法等检测方法,此外还有免疫学检测方法等。姜英辉等[9]建立了RCA技术检测Y.enterocolitica的方法,灵敏度为1.7×102CFU/mL。其中LAMP技术因具有特异性高、灵敏度高等优点,而被普遍应用于微生物的检测领域。
本研究中所建立的实时荧光LAMP方法在LAMP技术的基础上,向体系中添加荧光染料,通过观察是否有峰图出现就可知道反应是否发生,比普通的LAMP方法省时省力。该方法在结果出现后可直接终止反应,既节省时间又降低了试验成本,同时避免了繁琐的电泳。LAMP引物的设计是针对靶基因上6个特定区域而设计的4条引物,确保了扩增产物的特异性。但在实际操作时需要注意预防污染,避免假阳性结果的出现。
研究结果表明,实时荧光LAMP检测小肠结肠炎耶尔森氏菌的灵敏度为61 CFU/mL,人工污染鸡肉的检出限为46 CFU/g,实现了对Y.enterocolitica高效快速的检测,因此,本研究探索了一种特异性强、灵敏度高的检测Y.enterocolitica的方法,为Y.enterocolitica的快速检测开辟了新途径,适合在基层检测机构推广应用。
[1] Gupta V,Gulati P,Bhagat N,et al.Detection of Yersinia enterocolitica in food:an overview[J].European Journal of Clinical Microbiology&Infectious Diseases,2015,34(4):641
[2] Šárka Bursová,Necidová L,Haruštiaková D,et al.Growth potential of Yersinia enterocolitica,in pasteurised cow's and goat's milk stored at 8℃and 24℃[J].Food Control,2017,73:1415-1419
[3] 徐云明.单增李斯特氏菌和小肠结肠炎耶尔森氏菌LAMP方法的建立[D].长春:吉林大学,2013
[4] Van D I,De Z L,Jacxsens L,et al.Control of human pathogenic Yersinia enterocolitica in minced meat:comparative analysis of different interventions using a risk assessment approach[J].Food Microbiology,2017,64:83-95
[5] 梁磊,李英军,孟兆祥,等.环介导等温扩增技术检测小肠结肠炎耶尔森氏菌的研究[J].食品科技,2011(9):335-339
[6] P Thoerner,C I Bin Kingombe,K Bögli-Stuber,et al.PCR detection of virulence genes in Yersinia enterocolitica and Yersinia pseudotuberculosis and investigation of virulence gene distribution[J].Applied&Environmental Microbiology,2003,69(3):1810-1816
[7] Peruzy M F,Murru N,Perugini A G,et al.Evaluation of virulence genes in Yersinia enterocolitica strains using SYBR Green real-time PCR[J].Food Microbiology,2017,65:231-235
[8] Skerniškyte˙J,Armalyte˙J,Kvietkauskait e˙R,et al.Detection of Salmonella spp.Yersinia enterocolitica,Listeria monocytogenes and Campylobacter spp.by real-time multiplex PCR using amplicon DNA melting analysis and probe-based assay[J].International Journal of Food Science&Technology,2016,51(2):519-529
[9] 姜英辉,张健,雷质文,等.小肠结肠炎耶尔森氏菌滚环扩增检测方法的建立[J].食品研究与开发,2013,34(22):61-63
[10]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research,2000,28(12):63
[11]Niessen L,Luo J,Denschlag C,et al.The application of loop-mediated isothermal amplification (LAMP)in food testing for bacterial pathogens and fungal contaminants[J].Food Microbiology,2013,36(2):191-206
[12]马桂芬,张蕴哲,付博宇,等.实时荧光LAMP技术快速检测变形杆菌[J].食品研究与开发,2016,37(11):127-132
[13]贾雅菁,付博宇,王羽,等.实时荧光环介导等温扩增技术检测牛乳中的蜡样芽孢杆菌[J].食品科学,2016,37(6):184-189
[14]Rodríguez-Lázaro D,Hernández M.Yersinia enterocolitica:Detection and Treatment[J].Encyclopedia of Food&Health,2016:600-605.DOI:10.1016/B978-0-12-384947-2.00764-9
[15]Rohde A,Hammerl J A,Appel B,et al.Differential detection of pathogenic Yersinia,spp.by fluorescence in situ,hybridization[J].Food Microbiology,2017,62:39-45
[16]张霞,温华蔚,倪松,等.新等温扩增技术检测小肠结肠炎耶尔森氏菌[J].食品研究与开发,2015,36(23):113-116

